高效阴离子交换色谱积分脉冲安培法测定蓝藻细胞培养液中的蔗糖和甘油葡糖苷*
梁文辉,法芸,王明林
(1.山东农业大学,食品科学与工程学院,山东泰安 271018;2.中国科学院青岛生物能源与过程研究所,生物燃料重点实验室,山东青岛 266101)
在小分子糖类碳源中,蔗糖可由高等植物通过光合作用直接合成,被认为是自然界最丰富的二糖;同时蔗糖结构简单,很多微生物可以利用,是一种较为理想的碳源。又因为蓝藻具有高光效,生长速度快,遗传操作体系相对成熟,适用于大通量的基因工程改造等一系列优势,通过代谢工程改造蓝细菌生产蔗糖并提供给大肠杆菌等微生物发酵生产生物燃料,必将加速整个生物燃料的产业化进程,相关的研究意义重大[1,2]。
在蓝细菌相关研究中,蔗糖、甘油葡糖苷(GG)等组分的准确测定是一个重要环节。蔗糖的测定方法较多,如近红外光谱法[3]、高效液相色谱蒸发光散射检测法[4]等。测定GG的方法包括核磁共振碳谱[5],气液色谱[6]和酶技术[7]等。以上方法或者操作复杂,或者使用毒性较大的淋洗液。高效液相色谱在分离含有低浓度蔗糖和GG的样品时,RPC柱和IMPC柱的分离能力受到限制;氨基键合硅胶填料的色谱柱和乙腈–水作流动相能够对GG和二糖很好地分离,但是无法分离一些重要的己糖[8]。
高效阴离子交换色谱脉冲安培检测法是糖类检测的有效方法,适用于单糖、二糖、小分子寡糖的测定[9],具有灵敏度高、选择性好等特点。这种方法已被广泛用于食品中糖类的测定[10–17]、烟草[18]和药物中糖类的测定[19]。笔者对离子色谱脉冲安培检测法测定蓝藻细胞培养液中的蔗糖和GG进行了研究。该方法前处理简单、选择性好、灵敏度高。
1 实验部分
1.1 主要仪器与试剂
离子色谱仪:ICS–3000型,配备双泵、自动进样器、电化学检测器,美国赛默飞世尔科技有限公司;
超纯水制备仪:Milli-Q®Advantage A10型,法国Millipore公司;
氢氧化钠溶液:质量分数为50%,比利时Acros Organics公司;
蔗糖标准品:纯度不小于99.5%,国家标准研究中心;
GG标准品:纯度不小于99.5%,德国Bitop AG公司;
蓝藻培养液样品:自制;
实验用水为电阻率18 MΩ·cm的超纯水,进样前经过0.22 μm水相滤膜过滤。
1.2 标准品的配制
准确称取0.01 g(精确至0.001 g)经过干燥至恒重的蔗糖,用超纯水定容于10 mL容量瓶中,制得1 000 mg/L的蔗糖标准储备液。同法配制相同浓度的GG标准储备液。
用移液枪分别准确吸取1,5,10,20,50,100,200,500,1000 μL上述两种标准储备液,用超纯水定容于10 mL容量瓶中,质量浓度分别为0.1,0.5,1.0,2.0,5.0,10.0,20.0,50.0 mg/L。
1.3 样品前处理
经过600 mmol/L NaCl盐胁迫后每隔24 h取样2 mL蓝藻培养液,以12 000 r/min速度离心5 min,取上清液。将上清液稀释10倍后取约10 mL溶液用0.22 μm水相滤膜过滤,过IC–RP柱除去蛋白、色素等有机杂质。
IC–RP柱(1.0 mL,Agela Technologies)使用前须先经5 mL甲醇、10 mL水活化,放置20 min后使用。当样品溶液通过该柱时,前面3 mL弃去,后面溶液待检测。
1.4 色谱条件
色谱柱:CarboPac MA1分析柱和保护柱(美国Thermo Scientific公司);淋洗液:800 mmol/L氢氧化钠溶液等度洗脱;进样体积:25 μL;流量:0.4 mL/min;柱温:30℃;利用Chromeleon 6.8 色谱软件自动控制和数据处理。积分脉冲安培检测;金工作电极;Ag/AgCl参比电极;检测电位波形见表1。

表1 检测电位波形
2 结果与讨论
2.1 淋洗液浓度的选择
分别考察300,500,800,1 000 mmol/L氢氧化钠淋洗液对蔗糖和GG分离效果的影响,结果表明:淋洗液浓度在300,500 mmol/L时,蔗糖和GG已经能够分开,但分离时间较长(超过1 h);淋洗液浓度为800 mmol/L时,蔗糖与GG可在30 min内实现完全分离;淋洗液浓度为1 000 mmol/L时,蔗糖与GG分离效果不理想。所以选择800 mmol/L的氢氧化钠溶液作为淋洗液。
2.2 色谱柱的选择
使用HPLC在分离含有低浓度蔗糖和GG的样品时,RPC柱和IMPC柱的分离能力受到限制[8]。CarboPac PA10色谱柱能分开蔗糖和GG,但检测实际样品时,有杂峰和蔗糖的色谱峰重合,干扰了蔗糖检测。利用CarboPac MA1柱分离效果较好,检测实际样品时,蔗糖和其它未知组分无共淋洗现象发生。蔗糖和GG标准品的分离情况如图1 所示。

图1 蔗糖和GG标准品的色谱图
2.3 线性方程与检出限
逐级稀释蔗糖、GG标准储备液分别得到0.10,0.50,1.00,2.00,5.00,10.00,20.00,50.00 mg/L的蔗糖和GG混合标准溶液,进样量为25 μL,以标准品的质量浓度与对应的色谱峰面积进行线性回归得线性方程。线性范围、线性方程、相关系数和检出限(S/N=3)见表2。由表2可知,蔗糖和GG线性相关系数均大于0.999 9,检出限分别为0.15 mg/L和0.03 mg/L。

表2 线性范围、线性方程、相关系数及检出限
2.4 方法精密度
用2 mg/L的蔗糖和GG混合标准品重复进样8次,测定结果见表3。由表3可知,蔗糖和GG 8次测定结果的相对标准偏差分别为0.755%和1.694%,表明本法测量精密度较高。
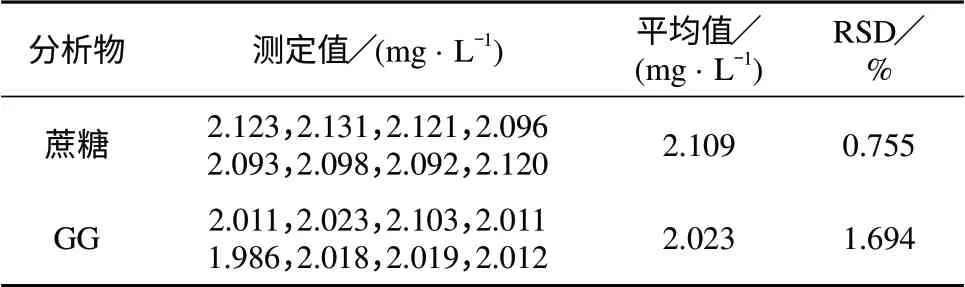
表3 精密度试验结果
2.5 加标回收试验
取蓝藻培养液样品,按照1.3方法处理,在1.4色谱条件下测定,然后在样品中分别加入1.0,10.0,20.0 mg/L的蔗糖和GG混合标准品,重复试验,测定结果见表4。由表4可知,蔗糖和GG的平均加标回收率为99.13%和94.23%,表明本法测量准确度较高。
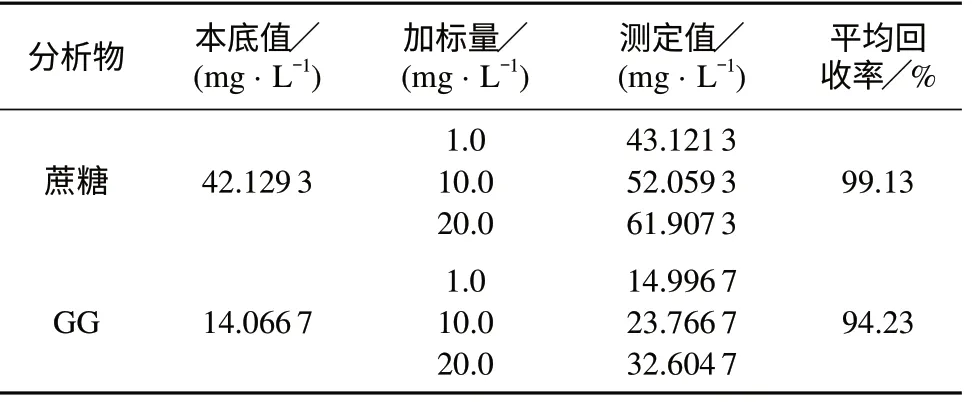
表4 加标回收试验结果
2.6 样品测定
应用此方法测定5种不同时间间隔取样的蓝藻细胞培养液中的蔗糖和GG,样品中蔗糖和GG的含量测定结果见表5,样品色谱图如图2所示。由图2可见,蔗糖和GG相互之间及其与样品基底成分分离良好,测定无干扰。

表5 不同蓝藻培养液样品中的蔗糖和GG含量 mg/L
3 结语
离子色谱脉冲安培检测法测定蓝藻培养液中的蔗糖和GG,最低检测限分别达到0.03 mg/L和0.15 mg/L,比高效液相色谱蒸发光散射检测法测定蔗糖的最低检测线14 mg/L要低[4]。测量精密度和准确度满足要求,可用于蓝藻细胞培养液中蔗糖和GG的同时测定。
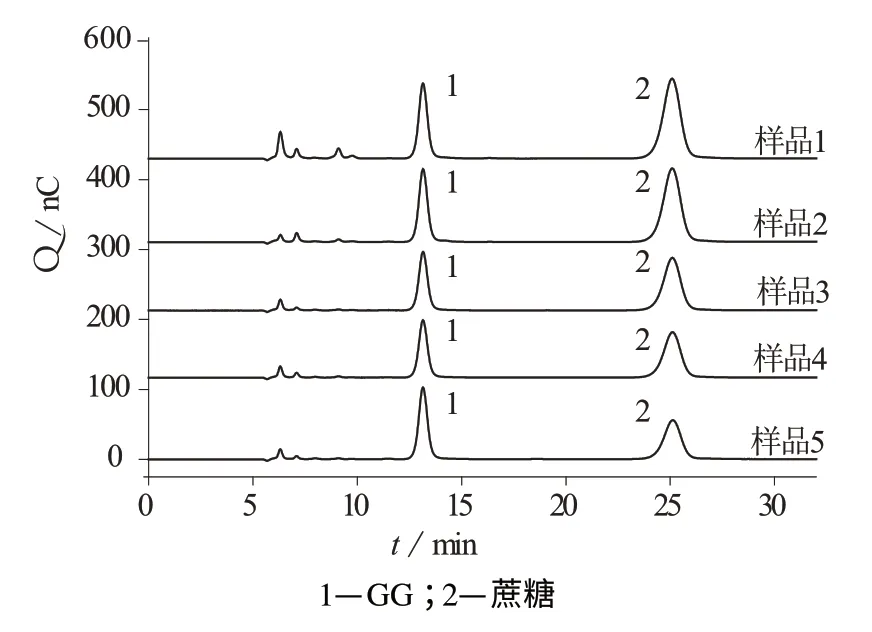
图2 不同蓝藻细胞培养液中蔗糖和GG的色谱图
[1]Du Wei,Liang Fei Yan,Duan Yang Kai,et al. Exploring the photosynthetic production capacity of sucrose by cyanobacteria Metabolic Engineering [J]. Metabolic engineering,2013,32(3): 457–461.
[2]T Heidorn,D Camsund,HH Huang,et al. Synthetic biology in cyanobacteria engineering and analyzing novel functions.Methods Enzymol [J]. Methods in Enzymology,2011,497: 539–579.
[3]叶升锋,闵顺耕,覃方丽,等.同时测定水溶液中葡萄糖、果糖和蔗糖的近红外光谱法[J].分析测试学报,2003,22(3): 89–91.
[4]蔡欣欣,张秀尧.HPLC测定转化糖注射液中果糖、葡萄糖含量[J].中国卫生检验杂志,2007,17(6): 968–969.
[5]Badar-Goffer R S,Bachelard H S,Morris P G,et al. Cerebral metabolism of acetate and glucose studied by13C-NMR spectroscopy. A technique for investigating metabolic compartmentation in the brain[J]. Biochemical Journal,1990,266: 133–139.
[6]Sweeley C C,Bentley R,Makita M,et al. Gas-liquid chromatography of trimethylsilyl derivatives of sugars and related substances[J]. Journal of the American Chemical Society,1963,85: 2 497–2 507.
[7]Gouda M D,Kumar M A,Thakur M S,et al. Enhancement of operational stability of an enzyme biosensor for glucose and sucrose using protein based stabilizing agents[J]. Biosensors and Bioelectronics,2002,17: 503–507.
[8]Schoor A,Erdmann N,Effmert U,et al. Determination of the cyanobacterial osmolyte glucosylglycerol by high-performance liquid chromatography[J]. Journal of Chromatography A,1995,704: 89.
[9]牟世芬,李宗利.阴离子交换分离一脉冲安培检测分析糖类化合物的进展[J].色谱,1995,13(5): 320–324.
[10]王荔,陈巧珍,宋国新,等.高效阴离子交换色谱–脉冲安培检测法测定烤烟中的水溶性葡萄糖、果糖和蔗糖[J].色谱,2006(2): 201–204.
[11]崔鹤,李戈,纪雷,等.离子色谱脉冲安培法测定蜂蜜中的葡萄糖、果糖、蔗糖[J].化学分析计量,2001,10(1): 25–26.
[12]刘晓玲,李东刚,史娟,等.离子色谱–脉冲安培检测器分析饮料中单糖和二糖[J].光谱实验室,2010,27(2): 441–445.
[13]牟世芬,于泓,蔡亚岐.糖的高效阴离子交换色谱–脉冲安培检测法分析[J].色谱,2009,27(5): 667–674.
[14]李仁勇,梁立娜,牟世芬,等.离子色谱–脉冲安培检测白醋和豆腐水中单糖和大豆低聚糖[J].中国调味品,2009,34(7): 95–98.
[15]唐坤甜,林立,梁立娜,等.高效阴离子交换色谱分离–脉冲安培检测法测定烟草料液中的糖、糖醇和醇类化合物[J].食品科学,2008,29(6): 327–331.
[16]潘媛媛,时国庆.高效阴离子交换脉冲安培检测器分析啤酒和麦汁中的多种糖[C].第11届全国离子色谱学术报告会论文集,2006.
[17]李建文,王国栋,杨月欣.高效离子色谱一脉冲安培检测法测定食品中多聚葡萄糖[J].卫生研究,2008,37(2): 225–227.
[18]胡静,沈光林,温东奇.阴离子交换色谱–积分脉冲安培检测法分离测定烟草料液中的山梨醇和糖[J].色谱,2007,25(3): 451–452 .
[19]李先端,钟银燕,顾雪竹,等.中药炮制辅料蜂蜜中葡萄糖、果糖、蔗糖的含量测定[J].中成药,2008,30(6): 885–888.

