吉非替尼联合5-氟尿嘧啶对肺癌细胞株A549的影响及机制研究*
西安交通大学医学院第一附属医院 (西安710061)
崔 洁△ 王敏聪 郭亚焕▲ 宋丽萍
肺癌是最常见恶性肿瘤之一,其中约80%为非小细胞肺癌,恶性程度高,总体5年生存率仅为15%,大多数患者就诊时为中晚期,化疗和分子靶向治疗是治疗的主要手段,但容易出现耐药[1]。表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)包括吉非替尼、厄洛替尼和埃克替尼,目前被NCCN指南推荐用于晚期非小细胞肺癌的治疗,通过干预EGFR酪氨酸激酶信号转导抑制肿瘤细胞的存活、血管生成、增殖、细胞迁移、细胞侵袭及转移等过程[2]。然而,EGFR-TKI只对部分患者有效,且经过一定时间的治疗后出现疾病进展,即发生了获得性耐药,这种耐药可能与EGFR基因的二次突变有关[3,4]。因此,克服 EGFR-TKI的原发性和获得性耐药是一项重要的研究课题。
本实验将探讨5-氟尿嘧啶联合吉非替尼对A549细胞的影响及其机制,为提高非小细胞肺癌患者对EGFR-TKI的敏感性提供新的思路。
材料和方法
1 材 料 人肺腺癌细胞株A549由西安交通大学医学院中心实验室提供,吉非替尼由英国阿斯利康公司提供,5-氟尿嘧啶购自上海旭东海普药业,PⅠ染料购自Sigma公司,RPMⅠ-1640培养液和胎牛血清购自四季青公司,细胞凋亡检测试剂盒购自自碧云天生物技术有限公司,MTT购自Sigma公司,DNA提取试剂盒购自TakaRa宝信生物工程有限公司,流式细胞仪为美国BD公司,p-EGFR购自Cell Signaling Technology,EGFR 购自bioworld technology,β-actin购自sinopept company。
2 方 法
2.1 细胞培养:将人A549细胞系培养于含10%胎牛血清、100U/ml青霉素及100ug/ml链霉素的PRMI-1640培养基中,置于含5%CO2、100%饱和湿度、37℃孵箱中培养,隔天传代。
2.2 四甲基偶氮唑盐(MTT)法检测细胞增殖:取对数生长期A549细胞,调整细胞浓度为1×104/ml,接种于96孔培养板,置37℃,5%CO2培养箱内培养24h,加入不同浓度的5-Fu(1.2,2.4,4.8,8.6,17.2,34.4μmol/L)和吉非替尼(1.6,3.2,6.4,12.8,25.6,51.2μmol/L)48h后检测,每个浓度设3个复孔。药物联合作用的检测,每孔内分别加入含有终浓度为0.125,0.25,0.5,1,2倍IC50浓度的吉非替尼以及0.125,0.25,0.5,1,2,4倍IC50浓度的5-Fu共同孵育,48h后终止培养,每个浓度设3个复孔,每孔加入MTT20μL,避光培养4h后去培养液,每孔加入DMSO150μL,于振荡器上摇匀后于酶标仪上测OD492值,同时设立阴性对照和无细胞空白对照。计算细胞抑制率=(实验组平均A值/对照组平A值)×100%。采用直线回归方法计算药物的半数抑制浓度(IC50)。实验重复3次。
2.3 吉非替尼和5-氟尿嘧啶的联合效应:根据中效原理,采用Chou-Talalay方法判定2种药物的联合作用。按中效方程式计算出不同抑制率时两药的单用和联用浓度,通过单药和二药合用量效关系参数计算联合用药效应值与二药单用效应值的关系,求出各抑制水平的联合指数(Combination Index,CI),如果 CI<1,认为两药物联用为协同作用;如果CI=1,认为两药联用为相加作用;如果CI>1,则认为两药联用为拮抗作用。
2.4 应用流式细胞术检测凋亡:取对数生长期A549细胞,接种于6孔培养板,调整细胞浓度为1×105/孔,12h后分别应用吉非替尼(5μmol/L),5-氟尿嘧啶(4.8μmol/L),吉非替尼联合5-氟尿嘧啶处理细胞,同时应用1/1000DMSO作为阴性对照,48h后终止培养,胰酶消化,PBS洗涤,弃上清,加入200μL试剂盒提供的结合缓冲液,重悬细胞后,分别加入10μLAnnexinV-FITC和5μLPI,轻轻混匀,4℃避光反应30min,再加入300μL结合缓冲液,上机检测。
2.5 应用流式细胞术检测细胞周期:取对数生长期A549细胞,接种于6孔培养板,调整细胞浓度为1×105/孔,12h后应用吉非替尼(5μmol/L)处理细胞,同时应用1/1000DMSO作为阴性对照,48h后终止培养,0.25%胰酶消化,1500r/min离心5min,弃上清,用冷PBS洗涤2次,70%酒精固定4℃过夜,离心后去上清,用冷 PBS洗涤2次,加入500μLAssay Buffer+10μLRNase A+10μLPI,避光室温孵育30min,上机检测。
2.6 Western-blot检测:取对数生长期A549细胞,接种于6孔培养板,调整细胞浓度为1×105/孔,12h后分别应用吉非替尼(5μmol/L),5-氟尿嘧啶(4.8μmol/L),吉非替尼联合5-氟尿嘧啶处理细胞,同时应用1/1000DMSO作为阴性对照,48h后终止培养,收集细胞,提取蛋白,并用紫外吸收法测定蛋白浓度。SDS-PAGE分离蛋白后进行转膜,将转上蛋白的聚偏二氟乙烯(PVDF)膜置于含5%脱脂奶粉的Tris盐缓冲液-吐温液(TBST)中封闭1h,TBST漂洗。分别加入抗人EGFR/p-EGFR一抗4℃孵育过夜,TBST漂洗3次,每次10min。然后再加入相应的辣根过氧化物酶标记的二抗,在室温下孵育1h后,充分漂洗,最后采用电化学发光法进行显像,暗室中进行X射线曝光压片,再显影,定影,得到目的蛋白条带。实验重复3次,用β-αctin作为内参。
结 果
1 吉非替尼和5-氟尿嘧啶对非小细胞肺癌A549细胞的增殖抑制 应用MTT法分别检测吉非替尼和5-氟尿嘧啶作用于非小细胞肺癌A549细胞48h的增殖抑制效应,研究结果显示,随着药物浓度的提高,细胞抑制率逐渐增高,48h半数抑制率(IC50)见附表。
附表 半数抑制率(±s)

附表 半数抑制率(±s)
药物 吉非替尼(μmol/L) 5-氟尿嘧啶(μmol/L)IC50 12.3±1.5 8.8±1.7
2 吉非替尼和5-氟尿嘧啶联合应用具有协同效应 应用 MTT法检测联合0.125,0.25,0.5,1,2倍IC50浓度的吉非替尼和0.125,0.25,0.5,1,2倍IC50浓度的5-氟尿嘧啶对A549细胞增殖的抑制效应,然后采用Chou-Talalay联用指数法判定2种药物的联合作用。研究结果显示吉非替尼和5-氟尿嘧啶联用具有协同效应,CI值<1,随着药物浓度增高,CI值逐渐减小,协同效应更加显著。
3 联合吉非替尼和5-氟尿嘧啶对A549细胞凋亡的影响 应用流式细胞术检测吉非替尼(5μmol/L),5-氟尿嘧啶(4.8μmol/L),吉非替尼联合5-氟尿嘧啶作用于A549细胞48h后对细胞凋亡的影响,同时应用1/1000DMSO作为阴性对照,研究结果显示吉非替尼或5-氟尿嘧啶单独作用A549细胞48h后,细胞凋亡率分别为1.35%±0.5%和1.41%±0.7%,阴性对照组0.81%±0.2%;吉非替尼和5-Fu联合作用于A549细胞的凋亡率为7.23%±1.5%,高于单独用药组,差异有统计学意义(P<0.05)。
4 吉非替尼对A549细胞细胞周期的影响 吉非替尼(5μmol/L)单独作用于A549细胞48h后,与阴性对照相比较,S期细胞明显增多62.18%±15.5%vs31.25%±9.1%,差异有统计学意义(P<0.05)。
5 联合吉非替尼和5-氟尿嘧啶对A549细胞EGFR/p-EGFR的影响 5-氟尿嘧啶(4.8μmol/L)单独作用于A549细胞48h,对EGFR/p-EGFR表达无显著影响;吉非替尼(5μmol/L)单独作用于A549细胞48h,p-EGFR表达下调;联合应用吉非替尼和5-Fu48h显著下调A549细胞p-EGFR表达水平,附图 。
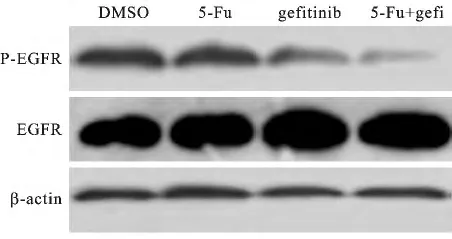
附图 Western-blot检测吉非替尼、5-氟尿嘧啶及联合用药对A549细胞EGFR/p-EGFR的影响
讨 论
随着肺癌分子发病机制的研究,针对这些机制的靶向治疗药物逐渐进入临床,其中EGFR是目前研究最多的肺癌治疗靶点。EGFR含有1个与配体结合的胞外区,1个跨膜区和1个具有酪氨酸激酶活性的胞内受体区。当表皮生长因子、转化生长因子、双调蛋白等配体与EGFR结合后,进行同源或异源二聚化,引起胞内酪氨酸残基自身磷酸化,活化的受体募集信号复合体并活化下游信号转导蛋白,影响细胞周期和凋亡,参与控制细胞的存活、血管生成、增殖、细胞迁移、细胞侵袭及转移等过程[5~7]。吉非替尼是一种表皮生长因子受体酪氨酸激酶抑制剂,其通过竞争性地与EGFR酪氨酸激酶催化区域中的Mg-ATP位点结合,抑制酪氨酸激酶磷酸化,阻断EGFR的信号转导通路,从而抑制细胞周期进程,加速细胞凋亡,是最早应用于治疗非小细胞肺癌的靶向药物,与传统的放化疗相比,具有依从性好、不良反应少等明显的优点。虽然部分非小细胞肺癌患者可从中获益,但不可避免地,此类药物同样存在耐药的同题,包括原发性耐药和获得性耐药。因此如何提高药物敏感性,克服耐药已成为目前国内外研究的热点之一。
本研究显示吉非替尼和5-Fu联合作用于非小细胞肺癌A549细胞具有协同效应。进一步的研究发现,吉非替尼能够使S期细胞比例显著增多,联合应用这两种药物显著提高A549细胞的凋亡,并显著下调p-EGFR表达水平。5-Fu为抗嘧啶类抗代谢药物,在体内转变成5-氟尿嘧啶脱氧核苷酸,抑制脱氧胸苷酸合成酶,阻断脱氧尿苷酸转变成脱氧胸苷酸,从而影响DNA生物,主要作用于S期。因此我们推测吉非替尼可能通过增加S期细胞,下调p-EGFR表达水平,提高凋亡率来增加对5-Fu的敏感性。A549细胞为EGFR野生型并含有K-RAS突变,对EGFR-TKI产生原发性耐药。本研究发现5-Fu能够增加A549细胞对EGFR-TKI的敏感性,该结果为克服肺腺癌对EGFRTKI原发性耐药提供一种新的治疗策略。目前国外有研究表明,联合应用吉非替尼和S1作用于T790M突变的肺腺癌细胞株H1975,具有协同作用,该细胞对EGFR-TKI产生获得性耐药,机制与吉非替尼可以增加胸苷酸合成酶的表达,提高S1的敏感性有关[8]。
5-Fu为卡培他滨或S1的体内代谢产物,目前这两种药物均在进行II-III期临床试验[9],有望应用于非小细胞肺癌的治疗。我们的研究结果提示吉非替尼与卡培他滨或S1联合应用在克服吉非替尼原发性耐药方面是一种有希望的治疗策略。进一步可以开展动物实验,但是否可真正用于临床上对EGFR-TKI靶向药物治疗原发耐药的NSCLC的治疗,还需要进行更多、更深入的研究来评估。
[1] Chen Z,Cheng K,Walton Z,et al.A murine lung cancer co-clinical trial identifies genetic modifiers of therapeutic response[J].Nature,2012,483(7391):613-617.
[2] Dienstmann R,De Dosso S,Felip E,et al.Drug development to overcome resistance to EGFR inhibitors in lung and colorectal can-cer[J].Mol Oncol,2012,6(1):15-26.
[3] Kobayashi S,Boggon TJ,Dayaram T,et al.EGFR mutation and resistance of non-small-cell lung cancer to gefitinib.NEngl JMed,2005,352:786-92.
[4] PaoW,Miller VA,Politi KA,et al.Acquired resistance of lung adenocarcinomas to gefitinib or erlotinib is associated with a second mutation in the EGFR kinase domain.PLo SMed,2005:73.
[5] Inomata M,Shukuya T,Takahashi T,et al.Continuous administration of EGFR-TKIS following radiotherapy after disease progression in bone lesions for non-small cell lung cancer[J].Anticancer Res,2011,31(12):4519-4523.
[6] Ma H,Yao Q,Zhang AM,et al.The effects of artesunate on the expression of EGFR and ABCG2in A549human lung cancer cells and a xenograft model[J].Molecules,2011,16(12):10556-10569.
[7] Suda K,Tomizawa K,Osada H,et al.Conversion from the"onco-gene addiction"to"drug addiction"by intensive inhibition of the EGFR and MET in lung cancer with activating EGFR mutation[J].Lung Cancer,2012,76(3):292-299.
[8] Okabe T,Okamoto I,Tsukioka S.Addition of S-1to the epidermal growth factor receptor inhibitor gefitinib overcomes gefitinib resistance in non-small cell lung cancer cell lines with MET amplification.Clin Cancer Res,2009,15(3):907-13.
[9] Aono N,Ito Y,Nishino K.A retrospective study of the novel combination of paclitaxel and S1for pretreated advanced non-small cell lung cancer.Chemotherapy,2012,58(6):454-60.

