草苁蓉多糖提取物诱导人喉癌Hep2细胞凋亡的实验研究
延安大学附属医院耳鼻喉科二病区 (延安716000) 张 军 张耀明 王正辉 汪 立
肿瘤的发生发展是一个多因素、多步骤和多基因参与的复杂过程。化疗是治疗肿瘤一种重要的治疗手段,然而目前许多化疗作用有限。许多化疗药物被发现即攻击肿瘤细胞,同时损害人体正常细胞及免疫系统。因而目前急需找到一种能够阻止肿瘤生长并且副作用小的制剂。近些年来,植物提取物由于其潜在的抗瘤性及低毒性已受到学者的关注。草苁蓉(Boschniakia rossi)又名不老草,为列当科草本植物,近年来文献报道,草苁蓉具有清除自由基、抗脂质过氧化、抗肿瘤、抗炎及增强免疫功能等作用。研究发现草苁蓉多糖提取物(BRP)可激活巨噬细胞活性,并且对老鼠无毒性及致畸性[1,2]。因而BRP可能对肿瘤是一种安全、有效的制剂。本研究首先提取BRP,然后将BRP作用于Hep2细胞来研究其对细胞的作用及相关分子机制。
材料和方法
1 实验材料与仪器 草苁蓉购买自药店;Hep2细胞购自中国科学院上海细胞中心;卵清蛋白(OVA),MTT,脂多糖(LPS),小牛血清(BSA),二甲基亚砜(DMSO)购买自Sigma;RPMI 1640培养基购自Invitrogen;胎牛血清购自四季青公司;pro-caspase-3,pro-caspase-8,pro-caspase-9,DR5,Bcl-2,Bax,βactin抗体购自Santa Cruz;培养板、培养瓶、培养皿为德国Greiner bio-one公司产品;微孔滤膜为上海亚东核级树脂有限公司产品;正置、倒置相差显微镜及显微摄影系统(Nikon);二氧化碳培养箱,FACS Calibur流式细胞仪等。
2 方 法
2.1 多糖制备及分析:将草苁蓉全草切碎,采用1000ml蒸馏水70~-80度℃过滤,每次3h除去低分子碳水化合物。用等体积乙酸乙酯萃取,取水层。水层继续用等体积正丁醇萃取,正丁醇层经减压蒸馏,原始的多糖放置于DEAE纤维素柱,使用蒸馏水洗脱、高浓度氯化钠浓缩。采用苯硫酸方法在490nm光度下进行低速收集,获得水溶性成分。水溶性成分使用聚丙烯酰胺葡聚糖200HR层析柱在0.15mmol/L Nacl溶液中,以2ml/min低速进行纯化,名为多糖成分(BRP)。对该多糖成分蛋白使用Bradford method进行分析。
2.2 细胞培养:Hep2细胞常规培养于10%FCS RPMI 1640培养基,常规加50U/ml青霉素,50U/ml链霉素。置于37℃、CO2培养箱内,每周传代2次。
2.3 细胞活性测定:Hep2细胞贴壁生长,培养于含10%灭活小牛血清的RPMI 1640培养液中,置37℃、相对湿度5%CO2孵箱内培养。取对数生长期的Hep2细胞按每孔1×105个细胞接种于96孔板中,每孔体积200μl。待细胞贴壁后,药物组加入药物使其终浓度分别为50、100、200μg/ml和400μg/ml,另设不加药物的阴性对照组以及不接种细胞的空白对照组。分别培养24h,每个浓度每个时点均设4个复孔。于终止前4h,每孔加入5g/L MTT溶液20μl,继续孵育4 h后弃去上清液,加入150μl DMSO,轻轻振荡10 min,使结晶物完全溶解,于490nm波长处在酶联分析仪上测光吸收值(A值),计算生长抑制率[3]。抑制率(%)=(对照组A值-实验组A值)/对照组A值×100。
2.4 细胞周期分析:取对数生长期的Hep2细胞按每孔1×106细胞接种于6孔板中,每孔2ml。待细胞贴壁后,药物组加入药物使其终浓度为200μg/ml,另设不加药物的阴性对照组以及不接种细胞的空白对照组。继续作用细胞24h后,收集细胞悬液。弃掉培养液,70%冷乙醇固定,4℃PI和RNaseA酶暗染30 min,用流式细胞仪对各组样本进行DNA含量及细胞周期分析。
2.5 流式细胞仪检测凋亡:取对数生长期的Hep2细胞按每孔1×106细胞接种于6孔板中,细胞密度达到30%~50%时,将不同浓度药物作用于细胞,培养24h后收集细胞。离心后去除上清液,冰预冷PBS洗细胞2次,保证每管细胞数至少106个。加入5μl Annexin V-FITC和2.5μl PI到另一个试管中,再加入100μl细胞悬液,混匀后室温孵育10~15min。加入400μl 1×binding buffer混匀后30min内上机。测定每个上机样管数据,采用Cell Quest软件进行参数获取和分析,计算凋亡细胞百分比。
2.6 Western blot检测相关蛋白:转染后48h,加入单去污细胞裂解液,在4℃以12000×g离心3min,取上清,用Lowry法定量蛋白,经聚丙烯酰胺变性凝胶电泳分离蛋白,用电转法将蛋白转置PVDF膜上,依次加入封闭液、pro-caspase-3,pro-caspase-8,procaspase-9,DR5,Bcl-2,Bax,β-actin抗体、辣根过氧化物酶标记二抗,再经化学发光剂反应,X光片压片曝光。使用GEL DOC 2000system分析软件对条带进行分析。
2.7 统计学方法:以上方法均各取3个样本,每个样本重复3次。采用SPSS 10.0软件包,对实验数据进行配对tq检验和组间方差分析。
结 果
1 BRP化学成分分析 采用乙醇提取法获得水溶性的粗多糖成分。然后经过DEAE层析柱、Sephacryl S-200HR渗透获得纯化的多糖,高通量色谱分析仪结果发现BRP为单个、尖锐的峰,显示出提纯的BRP单一性。根据分子量检测显示BRP大约为22kDa,纯度为96.9%。Bradford法检测结果为阴性,提示BRP内无蛋白及核酸成分。
2 BRP对Hep2细胞活性的影响 与对照组相比,不同浓度的BRP对细胞活性呈时间、浓度依赖性抑制。作用72h后,400μg/ml的BRP对细胞活性抑制率最高达到87.57%,而50μg/ml的BRP在不同时间点对细胞活性抑制率与对照组相比无明显差异(P>0.05)。因此后续检测选用100,200和400μg/ml三个浓度进行检测,见附表。
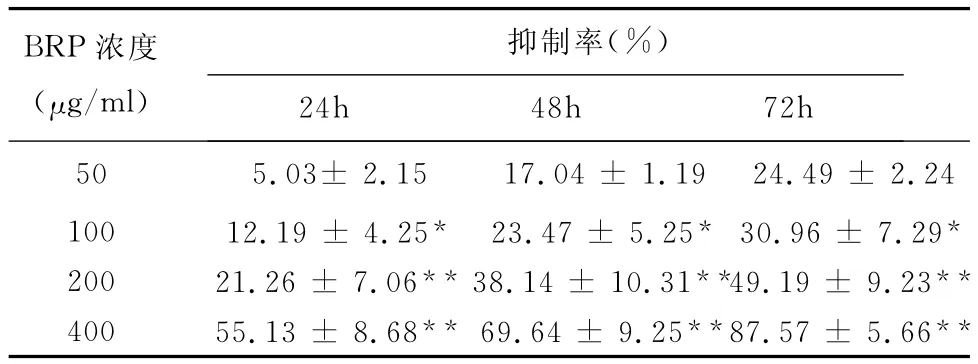
附表 MTT法检测不同浓度BRP对细胞活性的影响
3 BRP对细胞周期的影响 流式细胞仪分析结果显示,空白对照组细胞G0/G1,S和G2/M期细胞比率分别为22.4%,59.4% 和19.3% 。而200μg/ml BRP作用24h后,G0/G1期细胞比率显著上升,多数细胞阻滞在G0/G1期,比率达到67.6%。同时伴随着S期细胞比率达到23.6%。
4 BRP对细胞凋亡的影响 采用annexin-V/PI染色法检测细胞凋亡,结果发现与对照组相比,不同浓度的BRP(100,200,400μg/ml)作用24h后,各组细胞凋亡比率明显增加,分别是23.44%,43.86%,53.67%。这些结果提示BRP可能主要通过诱导Hep2细胞凋亡来抑制细胞的生长。
5 凋亡途径分析 采用 Western blot检测凋亡相关途径,结果发现与对照组相比,随着浓度的增加,BRP 明 显 抑 制 pro-caspase-3、pro-caspase-8、procaspase-9的表达,说明 pro-caspase-3、pro-caspase-8、pro-caspase-9分裂增加,同时可明显抑制 Bcl-2的表达。而死亡受体DR5、Bax的表达则明显增加。
讨 论
喉鳞状细胞癌是人体头颈部高发和高病死率的肿瘤,占到头颈部肿瘤的90%左右,其常规治疗方法是外科手术和放疗。尽管许多研究发现,系统性的化疗对鳞癌有效,然而其手术和术后化疗5年生存率仍较低[4]。故采用新化疗药物并研究新化疗方案,以提高疗效、减低化疗毒性、增强耐受性成为研究的热点。
目前研究发现一些传统的中药对许多肿瘤包括鳞癌有效,并且毒副作用小。这些中药主要通过刺激巨噬细胞及调节人体补体系统来抑制肿瘤的生长[5,6]。研究发现草苁蓉提取物具有多方面的药理活性,而这多重的药理作用决定了它的用途。研究发现草苁蓉提取物具有抗肿瘤和清除自由基作用。王秋燕等研究发现草苁蓉可抑制小鼠肝癌的生长[7],并可激活小鼠的免疫系统[8]。因此本研究采用草苁蓉提取物BRP作用于Hep2细胞,观察其对细胞的影响,研究发现不同浓度的BRP可明显抑制细胞的生长,并使细胞周期发生变化,通过流式细胞仪分析发现BRP作用后细胞凋亡明显增加,说明BRP主要通过诱导细胞凋亡来抑制Hep2细胞的生长。
细胞凋亡的过程是程序化的、多基因调控的。与细胞凋亡相关的基因大致有bcl-2家族、p53、fas、cmyc、k-ras等,细胞是否进入凋亡通道取决于这些凋亡相关基因的综合调控结果[9]。目前研究发现参与细胞凋亡主要有两个途径:外部死亡受体途径与内部线粒体途径。两条途径交汇于capase基因的激活,而这一基因在诱导过程中起关键的调控作用。为了研究BRP诱导Hep2细胞凋亡的分子途径,本研究采用western blot检测分析相关蛋白。结果发现不同浓度BRP作用于细胞后,capase-3、capase-8和capase-9的表达呈浓度性增加,而这些蛋白的变化表明外部途径与线粒体途径都被激活。而死亡受体DR5表达的增强表明外部途径的参与。Bcl-2家族是参与细胞生存或凋亡的重要调节蛋白,与线粒体途径密切相关。其家族成员具备双重功能,其中Bcl-2、Bcl-xl等抑制细胞凋亡的产生,而Bax、Bcl-xs等促进细胞凋亡。本研究发现BRP作用后Bcl-2表达减少,Bax表达增加,这些结果表明BRP激活Hep2细胞线粒体凋亡途径主要通过激活Bcl-2家族来实现。
通过实验我们发现草苁蓉多糖提取物BRP通过使细胞周期变化,诱导细胞凋亡可明显抑制人喉癌Hep2细胞的增殖,其凋亡机制为外部死亡受体和内部线粒体途径共同参与凋亡的发生。这些为研制新的化疗药物提供实验依据,深入研究BRP对喉癌细胞的作用机制可能为治疗鳞癌或其它肿瘤提供新的思路。
[1] Fei R,Chi LC,Du JS,et al .Toxicity of polysaccharides of Boschniakia rossica[J].Northeast Normal Univ,2008,40:98-100.
[2] Chihara G.Recent progress in immunopharmacology and therapeutic effects of polysaccharides[J].Dev Biol Stand,1992,77:191-197.
[3] 李发萍,曹 华,吴玉瑛,RNA干扰Jab1基因对人喉鳞状细胞癌Hep2细胞增殖影响[J].中国耳鼻咽喉头颈外科,2011,18(9):465-468.
[4] 张健梅,文 姝,李 杰,等.三氧化二砷与紫杉醇联合诱导Hep2细胞凋亡的体外研究[J].中国耳鼻咽喉头颈外科,2011,18(4):196-199.
[5] Wang SY,Hsu ML,Hsu HC,et al.The antitumor effect of Ganoderma lucidum is mediated by cytokines released from activated macrophages and T lymphocytes[J].Int J Cancer,1997,70:699-705.
[6] Wasser S.Medicinalmushrooms as a source of antitumor and immunomodulating polysaccharides[J].Appl Microbiol Biotechnol,2003,60:258-274.
[7] 王秋燕,王 晶,倪 颖,等.草苁蓉水萃取物对小鼠肝癌移植瘤的生长抑制作用[J].延边大学医学学报,2012,35(2):107-109.
[8] 金爱花,朴龙,尹学哲,全吉淑.草苁蓉环烯醚萜苷对H22小鼠肝癌移植瘤的抑瘤作用[J].中草药,2012,43(2):332-335.
[9] Lu QL,Poulsom R,Wong L,et al.Bcl-2expression in adult and embryonic non-haematopoietic tissues[J].J Pathol,1993,169(4):431-437.

