放牧干扰对岷江上游山地森林-干旱河谷交错带土壤微生物量及呼吸熵的影响
刘珊珊,王 芬,张兴华,宫渊波,王 燕,尹艳杰,李 渊,马金松,郭 挺
(四川农业大学 长江上游林业生态工程四川省重点实验室,四川 雅安625014)
放牧是山地生态系统中重要的资源利用方式,特别在欠发达地区和贫困山区,放牧仍然是当地居民维持生计的主要途径[1],成为主要的人为干扰形式。放牧通过3种途径影响土壤性质,即采食,践踏和排便,牲畜的行为一方面促使牧道的形成,一方面在形成稳定的牧道后也在一定程度上限制了牲畜的行为。牧道上的践踏强度最大,随与牧道距离增加践踏强度减小,形成从牧道上的裸地中心到几乎不被干扰的不同干扰梯度[2]。岷江上游的放牧早已经超过理论的载畜量,属于过度放牧[3]。一般亚高山或高山由于地温较低,而放牧使得地表植被盖度降低,地表热量提高,有机质分解加快,反而促进了植物生长和更新。但干旱河谷交错带这样的水分限制区,放牧则导致了地表植被稀疏、变干,使得林地水源涵养能力降低[4],同时间接影响土壤的理化性质[5],成为该区生态环境退化的主要影响因子。从20世纪50年代开始,该区成为学者们研究的热点,并取得了很多重要进展。但研究大多以如何对岷江干旱河谷进行植被恢复、遏制生态退化为目标,对于该区域碳储量的研究和植被恢复后生态效益的研究也仅见于最近的报道,对于该区放牧干扰对土壤微生物量及呼吸商影响的研究未见报道。
土壤有机碳库是森林生态系统碳库的重要组成部分,对全球碳循环有重要影响。植被与土壤相互影响,相互促进,使植被演替过程得以进行。植被恢复能有效保持水土、减少土壤侵蚀,通过植被与土壤双重生态系统的交互作用,可改善土壤生物学特性,提高土壤质量。土壤微生物直接参与土壤养分循环及有机质分解等诸多生态过程,是生态系统物质和能量循环的驱动力[6]。土壤微生物呼吸及其熵值(qMB,qCO2)作为土壤质量的敏感性指标,可以在早期预测土壤有机碳的长期变化趋势。
本研究选择人工刺槐林、人工杨柳林、草地和锥花小檗灌丛4种交错带典型的植被类型,运用野外调查、室内试验和计算机软件数据处理相结合的方法,首次运用距牧道距离的远近作为放牧干扰强度梯度,对区域内不同放牧强度对土壤微生物量及呼吸熵的影响进行了研究。
1 材料与方法
1.1 研究区概况
试验地设在四川省西部理县甘堡乡熊耳村熊耳山,地理坐标为31°31′6″—31°32′10″N,103°12′25″—103°13′36″E,地处川西北高原东南缘,邛崃山脉东侧,四川盆地西北部,该地区属于高山峡谷区,地质结构属龙门山断裂带中段,平均海拔2 700m。气候受西伯利亚西风气流、印度洋暖流和太平洋东南季风3个环流的影响,形成季风气候,最高气温37℃,最低气温-19℃,年均气温6~9℃,≥0℃积温3 800~4 500℃,无霜期190d,≥10℃活动积温3 200~3 800℃,年干燥度1.6~2.5,年平均日照时数1 835h,年降雨量400~600mm,年蒸发量739.3~1 656.7mm。实验地植物以旱生灌丛为主,另外分布有恢复人工林和荒草地,主要植物有白刺花(Sophora davidii)、虎榛子(Ostryopsis davidiana)、细裂叶莲蒿(Artemisia gmelinii)、川甘亚菊(Ajania potaninii)、光果莸(Caryopteris tangutica)等。土壤以旱生灌木草丛植被下发育的山地褐土为主,pH值介于5.8~8.4之间。土壤结构紧实致密,粗粉粒含量达51.22%~57.90%,故通气透水和蓄水肥性均较差,造成植物很难生长,进而加速生态环境的恶化。
1.2 样地选取与样品采集
牲畜的干扰行为强度是由牧道向两侧减弱的,即距牧道越远放牧干扰强度越弱,在岷江上游山地森林干旱河谷交错带,牲畜主要为羊、牛和猪,受地形复杂的制约,牧道复杂交错,采得距牧道较远的样本难免跨入到距离另一条牧道较近的范围内,所以以10m为界设置3层干扰梯度,距牧道0m为重度干扰,距牧道5m为中度干扰,距牧道10m为轻度干扰。样地的选择均位于交错带内,海拔高度相差不大。取4种植被类型样地,人工刺槐林、人工杨柳林、锥花小檗灌丛和草地(表1),人工刺槐林位于阴坡,属局部小地形,植被较茂盛,牧道只有明显的一条;人工杨柳林属阶地营林,地形相对平坦且有明显的进入点,牧道往往只有明显的1条或数条;锥花小檗灌丛地和草地位于阶梯状坡间缓坡地上,地形平坦,牧道错综复杂,但有明显的主牧道。在每个样地内选择主牧道,即两侧或一侧在20m范围内无明显牧道,垂直主牧道间隔10m设置3条样线,在每条样线上由牧道与样线交点开始5m等距设置重、中、轻三种干扰程度的点进行取样,每个样点挖取土壤剖面,分两层取样,即0—10cm和10—20cm,相同干扰程度样点的土样混合,并分装两份,一份作为鲜土样,装入有冰块的保温箱带回实验室,另一份作风干土样,同时用环刀在每层取原状土测量土壤容重。

表1 研究样地概况
1.3 测定项目
土壤总有机碳(SOC)采用重铬酸钾氧化外加热法测定[7];土壤微生物量碳(MBC)采用氯仿熏蒸浸提法测定[7];土壤矿化有机碳(MC)采用室内需氧培养法测定[8]。
1.4 数据处理
在SPSS 17.0和Excel软件中完成数据输入与处理。用SPSS 17.0中两独立样本t检验进行土层间显著性检验,用ANOVA中的LSD进行不同干扰程度间显著性差异检验。
2 结果与分析
2.1 放牧干扰对各植被类型土壤总有机碳的影响
从表2可见,各植被类型中土壤有机碳(SOC)含量介于10.68~35.84g/kg之间,3种干扰程度间不同土层SOC值表现出不同的规律,总体上随着放牧强度增加SOC值降低。
人工刺槐林中SOC含量土层间除重度表层大于下层外,其它均表现为表层小于下层,3种干扰程度土层间差异均不显著。从3种干扰程度看表层重度极显著低于另外两种,下层重度低于另外两种,但差异不显著。人工杨柳林中SOC含量土层间除轻度表层大于下层外,其它均表现为表层小于下层,3种干扰程度土层间差异均显著。中度和重度表层SOC含量分别比下层低13.39%和18.59%,而轻度土层间的变化幅度为60.97%,表明干扰程度增强使土壤表层有机碳低于下层,且土层间差异变小;从不同干扰程度看,表层重度和中度极显著低于轻度,分别低38.3%和51.97%(平均47.83%),下层则是重度最高,中度和轻度降幅为13.99%和40.47%,不同干扰程度间差异极显著,表层变化幅度较大。草地中,SOC含量土层间均表现为表层大于下层,除轻度外其它均差异显著,从3种干扰程度看,重度和中度均极显著低于轻度,前两者差异不显著。灌丛中,SOC含量土层间均表现为:表层>下层,差异均显著,从3种干扰程度看,表层重度和中度低于轻度,且差异极显著,下层各干扰间差异均不显著。各植被类型间土壤SOC表现为:草地>人工杨柳林>灌丛>人工刺槐林,这是由于植被类型不同,枯落物的数量和易分解程度不同,人工恢复刺槐林虽为乔木,但郁闭度小,叶片稀少,林下草本茂盛,常被作为饲料和柴草刈割,所以有机质损失比较大。各植被类型下重度的SOC降幅大小顺序为:人工杨柳林(平均47.83%)>草地(平均33.27%)>人工刺槐林(平均25.28%)>灌丛(平均21.50%)。
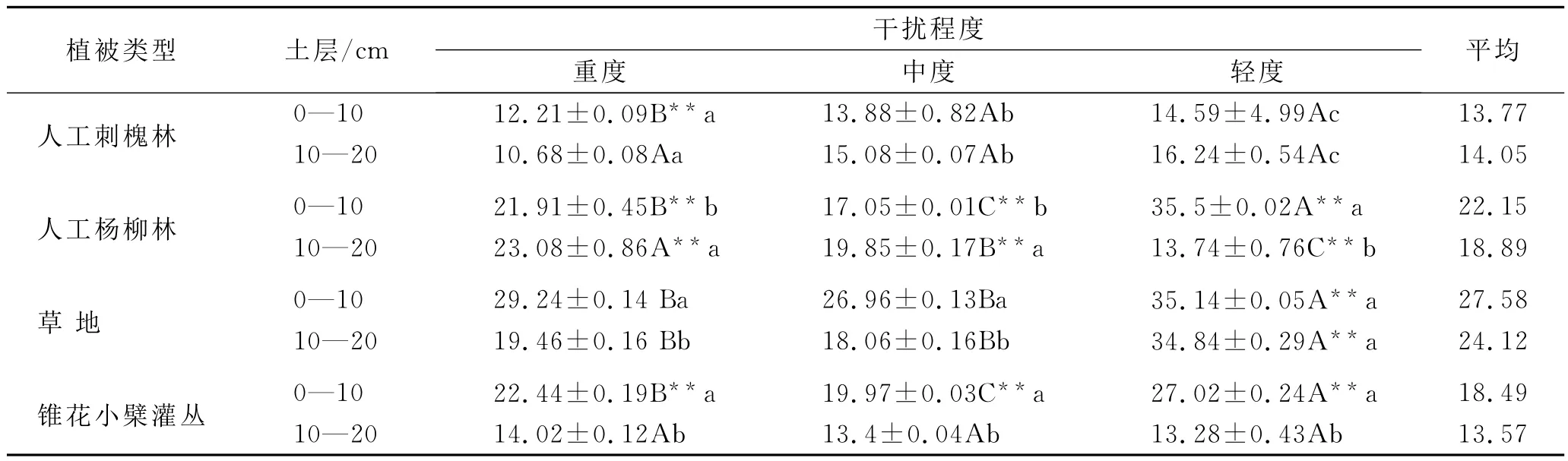
表2 研究区放牧干扰下不同植被类型土壤SOC的含量 g/kg
2.2 放牧干扰对各植被类型土壤 MBC,MC,qMB和qCO2的影响
人工刺槐林中,MBC含量介于184.25~298.58 mg/kg(平均250.92mg/kg),轻度表现为表层高于下层,重度和中度相反,差异均不显著,不同干扰程度间,两土层均表现为重度极显著低于中度和轻度,重度分别比中度和轻度 MBC含量低27.20%~37.01%(平均31.10%),两土层间变化程度相差不大。人工杨柳林中,MBC含量介于413.6~878.67 g/kg(平均560.11mg/kg),沿土壤剖面下降,重度和轻度差异显著,不同干扰程度间,重度和中度比轻度低,表层平均降低38.34%,下层平均降低17.10%,表层较下层变化幅度高2.24倍。表明林下放牧对表层土壤MBC影响较大,对下层土壤MBC影响较小,原因是下层土壤受地表植物变化影响小。草地中,MBC含量介于274.81~695.71mg/kg(平均464.00 mg/kg),两土层均表现为表层高于下层,差异均不显著,不同干扰程度间,MBC含量随放牧强度增加先降低后增加,这与SOC变化一致,重度比轻度降低29.21%,中度比轻度降低56.26%,干扰间差异均显著,表明MBC含量受SOC制约。土壤沿剖面分布较均匀,表明放牧干扰不仅影响到了土壤表层还影响到了土壤下层,但是MBC沿剖面下降的幅度远小于SOC,表明表层MBC损失的比SOC快,导致上下层趋于均匀。灌丛中,MBC含量介于184.61~282.57 mg/kg(平均231.39mg/kg),土层间变化规律与人工刺槐林相同。表层重度和中度比轻度低,降幅平均为30.19%,中度降幅较大,下层重度略有增加,但干扰间无显著差异。表明放牧干扰对下层MBC影响较小,中度损失较快。
综上,MBC表现为:人工杨柳林>草地>人工刺槐林>灌丛。各植被类型下重度或中度MBC平均降幅大小顺序为:草地(42.72%)>人工刺槐林(31.70%)> 灌 丛 (30.19%)> 人 工 杨 柳 林(27.72%),人工林地为重度降幅较大,草地和灌丛则表现为中度降幅较大。
从表3可以看出,21d积累矿化有机碳(MC)在各植被类型下表现出不同的规律,而且表层与下层间甚至表现出完全不同的规律。人工刺槐林中MC含量介 于 196.49~480.89mg/kg(平 均 303.38 mg/kg),沿土层剖面含量下降,差异显著。各干扰程度间,两土层呈现出相反的规律,表层中度极显著高于重度和轻度,升幅为47.56%和29.49%(平均38.52%),重度比中度和轻度平均降低22.23%,下层中度则显著低于重度和轻度,造成中度两土层间差异最大,重度和中度比轻度平均低16.6%。人工杨柳林中 MC 含量介于 255.89~595.73mg/kg(平均389.71mg/kg),沿土层剖面含量下降,差异显著,不同干扰程度间两土层规律一致,均为重度显著低于中度和轻度,降幅为9.78%~34.42%(平均22.90%),表层分异较大,其中表层中度可矿化碳量最大,增幅平均为45.04%。在人工林地下层变化幅度较小,表明放牧干扰对下层影响不大。而中度干扰使可矿化碳大幅增加,但中度干扰没有使SOC和MBC增加。草地中 MC含量介于248.06~518.03mg/kg(平均371.41mg/kg),沿土层剖面下降,差异显著;两土层分异规律不一致,表层中度极显著低于重度和轻度,降幅为28.22%和26.49%,重度则较轻度略有升高,无显著差异,重度较中度增加39.32%,下层重度极显著高于中度和轻度,增幅为25.63%和31.26%(平均28.44%),重度的平均增幅为33.88%,表层增幅较大。表明随着放牧强度增加可矿化碳含量增加,其中重度干扰增幅最大。锥花小檗灌丛中MC含量介于177.23~510.35mg/kg(平均316.01mg/kg),沿土层剖面下降,差异显著;两土层分异规律一致,均表现为:轻度>重度>中度,且差异显著,其中表层达到极显著水平,中度降幅 (53.63% 和 42.71%,平均48.71%)大于重度降幅(14.46%和26.98%,平均20.72%),平均较轻度下降32.715%。在草地和锥花小檗灌丛中,放牧均使表层MC大幅下降,这与MBC分布大致一致,表明MC受微生物量影响较大。
各植被类型间 MC表现为:人工杨柳林(389.71 mg/kg)> 草 地 (371.41mg/kg)> 灌 丛 (316.01 mg/kg)>人工刺槐林(303.38mg/kg)。重度比其它两种降幅平均表现为:灌丛(32.715%)>人工杨柳林(22.09%)>人工刺槐林(18.54%)。草地重度干扰MNC值平均增加33.88%。总体上,土壤可矿化碳值没有统一的分异规律。

表3 放牧干扰下不同植被类型土壤微生物量碳MBC和可矿化碳MC的含量
qMB微生物熵是土壤微生物量碳与土壤总有机碳的比值,可以解释总碳库的可利用度。从表4可以看出,各植被类型下,表层重度和中度qMB值均低于轻度值(杨柳林中度最高),人工刺槐林、人工杨柳林、草地和灌丛重度和中度(或重度)分别比轻度降低了16.74%,11.32%,30.42%和11.10%,下层各植被下变化不一。呼吸熵(qCO2)又称为代谢熵,是微生物可矿化碳与微生物生物量碳的比率[8]。
qCO2可以反映微生物固定碳的效率,qCO2越低,表明微生物对土壤碳的利用效率越高,单位微生物固定的碳越多,相反qCO2越高,单位微生物固定的碳越少。各样地qCO2值表现为表层变化较大,重度或中度使该值增加,人工刺槐林、人工杨柳林、草地和灌丛重度和中度(或比中度)分别比轻度增加了59.67%,82.72%,75.97%和62.23%,表明放牧使土壤微生物对有机碳的利用率降低。各样地间qCO2由小到大的顺序为:人工杨柳林<草地<人工刺槐林<灌丛。

表4 放牧干扰下不同植被类型土壤qMB和qCO2 %
3 结果讨论
3.1 放牧干扰对不同植被下土壤有机碳的影响
本研究MBC的变化幅度大体上高于SOC,表明在交错带内,活性有机碳组分更能较敏感的指示土壤碳变化,这与以往有的研究一致[9-10]。研究发现,人工杨柳林、草地和锥花小檗灌丛总有机碳均表现为随牧压增大,SOC先降低后增加。江源等[11]对高山草甸的研究也发现随牧压增加有机质的变化是先减小后增大。原因有:一是重度干扰使牲畜更频繁活动的区域,粪便较多,土壤尚未被完全侵蚀,但植被覆盖度低,致使植物对土壤养分的利用效率低,有机质分解变缓,而致使有机质积累;二是牧道有输送径流的作用,这些径流一部分会被牧道一侧的植物拦截,使得该区域的水分多于远离牧道的区域,这可能是灌丛和草地近牧道含水量高的原因(而人工林这种趋势较弱),所以含水量的优势增加了有机质的可溶性和微生物活性,使仅有的枯枝落叶分解较好,该区域的碳组分值暂时维持在一个相对高的水平。三是放牧对土壤系统的影响较植物滞后,这与放牧强度、放牧时间及气候、植物种类组成等多种因素有关,是一种间接的影响。虽然有机碳得到短暂积累,但是土壤已经退化,如果不及时加以管理,任其发展,经过一段时间养分大流失到难以提供植物正常的生长所需的时候,裸地就会形成,加速水土流失。
3.2 放牧干扰对不同植被下土壤微生物量及呼吸熵的影响
马秀枝等[12]对冷蒿—小禾草草原连续放牧11a恢复2a后的研究表明,随放牧率增加qMB比SOC变化更快。李香真等[13]的研究中也表明各放牧强度间SOC差异不显著,但重牧使qMB由轻度的1.16%降低至0.72%。这表明在表征放牧对土壤有机碳的影响上,活性组分更能在总有机碳变化之初敏感的指示变化趋势。
MBC分配比例不仅可以反映SOC自身被分解矿化的能力,还能综合反映外界环境条件对SOC分解矿化的影响。MBC分配比例(qMB)主要从分解转化有机碳的能力方面指示SOC活性特征,该值大表明土壤微生物活性高,容易分解和利用SOC[14]。本研究中随牧压增加qMB值在人工林刺槐林和灌丛降低,在人工杨柳林先增加再降低,在草地先降低再增加,表明牧压力增加使人工刺槐林和灌丛地微生物活性降低,使人工杨柳林重度降幅最大,使草地中度降幅最大。
代谢熵(qCO2)是可矿化碳与微生物量碳的比率,可灵敏反映环境因素、管理措施变化等对微生物活性影响[15-16],qCO2较小,表明形成单位微生物质量所呼出的CO2少,土壤碳损失少;qCO2较大,利用相同能量而形成的微生物生物量小,释放的CO2较多,微生物体的周转率快,土壤碳保存率低。各植被样地表层qCO2值均随牧压增加而增大(除灌丛中度干扰),增幅为15.14%~100.54%,表明放牧干扰使微生物体的周转率加快,释放的CO2较多,土壤碳保存率低,形成碳源。
综上所述,在交错带,放牧强度的增加使土壤自身矿化分解能力降低,微生物活性下降,土壤SOC更容易流失,稳定性下降,有沙化趋势,碳损失增加,形成碳源。
4 结论
(1)人工刺槐林、人工杨柳林、草地和锥花小檗灌丛土壤有机碳随放牧干扰程度的增加,土壤表层SOC下降16.9%~51.98%,MBC的变化幅度大体上高于SOC,表明在交错带,活性有机碳更能敏感地指示土壤碳变化。
(2)各植被样地表层qCO2值均随牧压增加而增大(除灌丛中度干扰),增幅为15.14%~100.54%,表明放牧干扰使微生物体的周转率加快,而使SOC的利用率降低,释放的CO2较多,土壤碳保存率降低。
总之,随着放牧强度增加,土壤有机碳更容易流失,稳定性下降,有沙化趋势,碳损失增加,形成碳源。但是不同植被下放牧强度的增加对土壤表层和下层两个土层有机碳、微生物活性的影响特征和程度不同,这不仅与植被类型和土壤状况有关,还与放牧利用的不同有关。岷江上游山地森林—干旱河谷交错带生态环境脆弱,过度放牧更增加了C的排放,所以规范放牧制度,制定合理的放牧分配有利于实现C减排目标。
[1] 阎建忠,张镱锂,摆万奇,等.大渡河上游生计方式的时空格局与土地利用/覆被变化[J].农业工程学报,2005,21(3):83-89.
[2] 刘金鑫,宫渊波,左琴,等.山地牧道与植被空间异质性研究评述[J],草业学报,2012,21(1):254-261.
[3] Liddle M J,Grieg S P.A survey of tracks and paths in a sand dune ecosystem(Ⅱ)[J].Journal of Applied Ecology,1975,12(3):909-930.
[4] 张建平,叶延琼,樊宏.岷江上游草地资源及合理利用[J].山地学报,2002,20(3):343-348.
[5] 刘庆,尹华军,吴宁,等.岷江上游山地退化生态系统恢复与重建试验示范研究[C].湖北 武汉:2007年中国科学技术协会年会.
[6] 从怀军,成毅,安韶山,等.黄土丘陵区不同植被恢复措施对土壤养分和微生物量C、N、P的影响[J].水土保持学报,2010,24(4):217-221.
[7] Ocio J A,Brookes P C.An evaluation of methods for measuring the microbial biomass in soils following recent additions of wheat straw and the characterization of the biomass that develops[J].Soil Biol.Biochem.,1990,22(5):685-694.
[8] 文启效.土壤有机质研究法[M].北京:中国农业出版社,1984:273-284.
[9] Biederbeck V O,Janzen H H,Campbell C A,et al.Labile soil organic matter as influenced by cropping practices in an arid environment[J].Soil Biology and Biochemistry,1994,26(2):1647-1656.
[10] 赵钦.岷江上游山地森林—干旱河谷交错带土壤理化性质研究[D].四川 雅安:四川农业大学,2009.
[11] 江源,章异平,杨艳刚,等.放牧对五台山高山、亚高山草甸植被—土壤系统耦合的影响[J],2010,30(4):0837-0846.
[12] 马秀枝,王艳芬,汪诗平,等.放牧对内蒙古锡林河流域草原土壤碳组分的影响[J],植物生态学报,2005,29(4):569-576.
[13] 李香真,陈佐忠.不同放牧率对草原植物与土壤C、N、P含量的影响[J].草地学报,1998,6(2):90-98.
[14] Murnoz C,Monreal C M,Schnitzer M,et al.Influence of Acaciacaven(Mol)coverage on carbon distribution and its chemical composition in soil organic carbon fractions in a Mediterranean-type climate region[J].Geoderma,2008,14(4):352-360.
[15] Brookes P C.The use of microbial parameters in monitoring soil pollution by heavy metals[J].Biol.Fert.Soils,1995,19(4):269-279.
[16] Christensen B T.Physical fraction of soil and organic matter in primary particle size and density separates[M]∥Advances in Soil Science.New York:Springer Verlag,1992.

