多药耐药相关蛋白在食管鳞癌原发灶与淋巴结转移灶中的差异表达及意义
方强 董丹丹 杨红 任光国 韩泳涛 肖波
1.四川省肿瘤医院胸外科,四川 成都610041;
2.四川省人民医院病理科,四川 成都610072
研究表明,食管癌根治术后辅助化疗能明显延长T3、T4和淋巴结阳性患者的无病生存时间,且有可能提高生存率[1-4]。因此,术后辅助化疗是综合治疗的重要环节之一。食管癌根治术后辅助化疗主要针对淋巴结转移灶,但转移灶中肿瘤细胞群多药耐药(multidrug resistance,MDR)的异质性是影响化疗效果的主要因素[5]。目前有关食管鳞癌MDR的研究多限于肿瘤原发灶[6-8],其原发灶与淋巴结转移灶MDR是否存在异质性鲜见报道。本研究通过比较食管胸段鳞癌患者原发灶及相应淋巴结转移灶MDR相关蛋白肺耐药相关蛋白(LRP)、P-糖蛋白(P-gp)、拓扑异构酶Ⅱ(TOPO-Ⅱ)、胸甘酸合成酶(TS)、谷胱甘肽-S-转移酶(GST-π)表达程度的差异,为食管鳞癌根治术后选择合理化疗方案的提供依据。
1 材料与方法
1.1 材料
选择四川省肿瘤医院胸外科2008年7月—2010年8月行食管次全切除及二野或三野淋巴结清扫术、经病理学检查证实为伴淋巴结转移的食管胸段鳞癌患者54例,男性47例,女性7例,年龄42~71岁,中位年龄59岁,其中低分化鳞癌25例,中分化鳞癌16例,高分化鳞癌13例,所有患者术前均未行放、化疗。转移淋巴结位于隆突下7例,左喉返神经旁7例,右喉返神经旁8例,病灶旁5例,胸导管旁2例,贲门旁6例,胃左血管旁11例,颈部5例,奇静脉弓旁1例,下段食管旁2例(表1)。
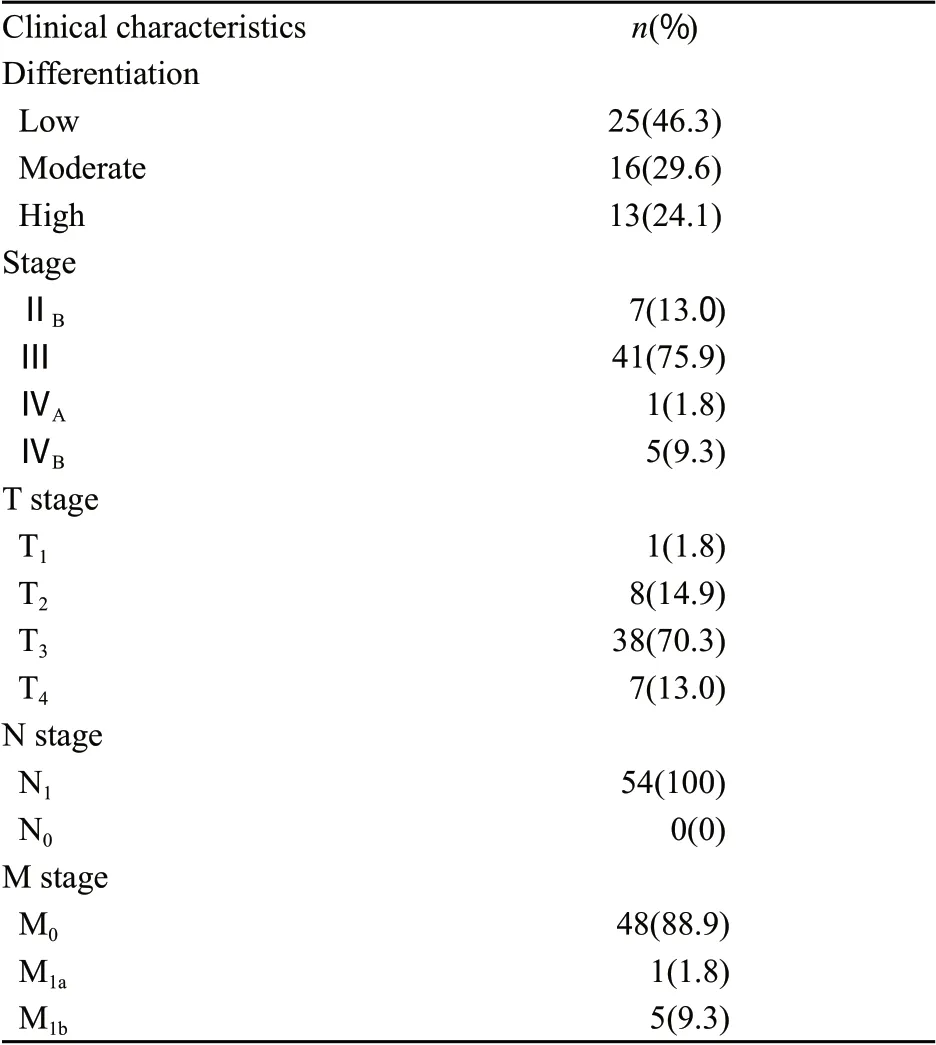
表1 54例食管胸段鳞癌的临床特征Tab.1 Clinical characteristics in 54 esophageal squamous cell carcinoma patients
1.2 试剂与方法
每例肿瘤原发灶、相应的转移淋巴结标本均经4%甲醛溶液固定、樱花VIP-E300F全自动组织脱水机处理,用Leica 2245型轮转式石蜡切片机制作石蜡标本,切片厚4 μm。即用型抗LRP、P-gp、TopoⅡ、TS、GST-π单克隆抗体均为美国Neomarker公司产品,购于北京中杉金桥生物试剂公司和福州迈新生物试剂公司。采用免疫组化LDP法进行切片标记,具体操作步骤按试剂盒说明书进行。
1.3 结果判断
1.3.1 阳性反应及定位
LRP、P-gp、TS、GST-π表达定位于细胞质(LRP、TS、GST)或细胞膜(P-gp),癌细胞胞质內或胞膜上(P-gp)出现均质状、颗粒状或线条状的棕黄色信号为阳性反应,TopoⅡ的表达定位于细胞核,癌细胞胞核內出现黄或棕黄色信号为阳性反应。
1.3.2 结果判断
随机观察10个高倍视野,癌细胞阳性数量占总计数细胞的百分比即为各抗体在癌灶标本中的表达率。结合切片内癌细胞阳性细胞百分比与阳性细胞的信号强度,将结果分为无表达(-):切片中无阳性肿瘤细胞,未见阳性信号;低度表达(+):肿瘤阳性细胞数<25%,阳性信号弱;中度表达(++):肿瘤阳性细胞数25%~50%,阳性信号较强;高度表达(+++):肿瘤阳性细胞数>50%,阳性信号极强。每张切片由2位病理专家分别独自分析,最后判断取2位病理专家分析结果的平均值。每例肿瘤原发灶和淋巴结转移灶所测同一MDR相关蛋白的表达结果不相同,即记为不一致,表达不一致的总例数/总病例数(54例)就是一种MDR相关蛋白的表达不一致率。同样,对于检测结果对耐药的提示每例肿瘤原发灶和淋巴结转移灶不相同,即为耐药不一致,耐药不一致的总例数/总病例数(54例)就是一种MDR相关蛋白的耐药不一致率。
1.4 检测结果对耐药的提示
LRP、P-gp、TS、GST-π表达(++/+++)提示肿瘤对化疗药物耐药,表达(-/+)提示肿瘤对化疗药物敏感。Topo-Ⅱ表达(-/+)提示肿瘤对化疗药物耐药,表达(++/+++)提示肿瘤对化疗药物敏感。
1.5 统计学处理
数据用SPSS 12.0统计软件包进行分析。计数资料采用χ2检验。原发灶与淋巴结转移灶的MDR相关蛋白表达比较采用Wilcoxon signedrank test,MDR相关蛋白表达与组织分化程度分析采用Kruskal Wallis test,P<0.05为差异有统计学意义。
2 结 果
2.1 肿瘤原发灶、淋巴结转移灶MDR相关蛋白表达的异质性
肿瘤原发灶与淋巴结转移灶LRP、P-gp、TS、TOPO-Ⅱ、GST-π表达和耐药不一致率分别为63.0%和26.9%、42.6%和22.2%、48.1%和25.9%、50.0%和29.6%、18.5%和1.9%。LRP在原发灶与淋巴结转移灶的表达差异有统计学意义(P=0.026)。其余4种蛋白在原发灶与淋巴结转移灶的表达没有差异,GST-π在原发灶与淋巴结转移灶中均表达(表2、3,图1、2)。
2.2 肿瘤原发灶、淋巴结转移灶MDR相关蛋白表达的异质性与与组织分化程度的关系
Kruskal Wallis test结果显示,肿瘤原发灶、淋巴结转移灶MDR相关蛋白表达的异质性与组织分化程度无关(表4)。

图1 食管鳞癌原发灶MDR蛋白的表达Fig.1 The expression of multidrug-resistant (MDR) proteins in primary tumors in esophageal squamous cell carcinoma (ESCC) patients(×100)
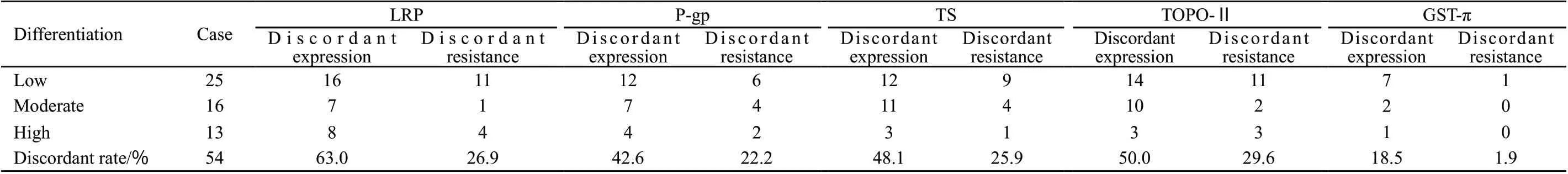
表2 食管胸段鳞癌原发灶与淋巴结转移灶MDR相关蛋白表达差异性变化Tab.2 The heterogenous expression of MDR associated proteins in primary tumors and metastatic lymph nodes in patients with esophageal squamous cell

表3 食管胸段鳞癌原发灶与淋巴结转移灶MDR相关蛋白表达的异质性Tab.3 Comparison of the MDR associated protein expression levels between primary ESCC tumors and metastasized lymph nodes[n(%)]
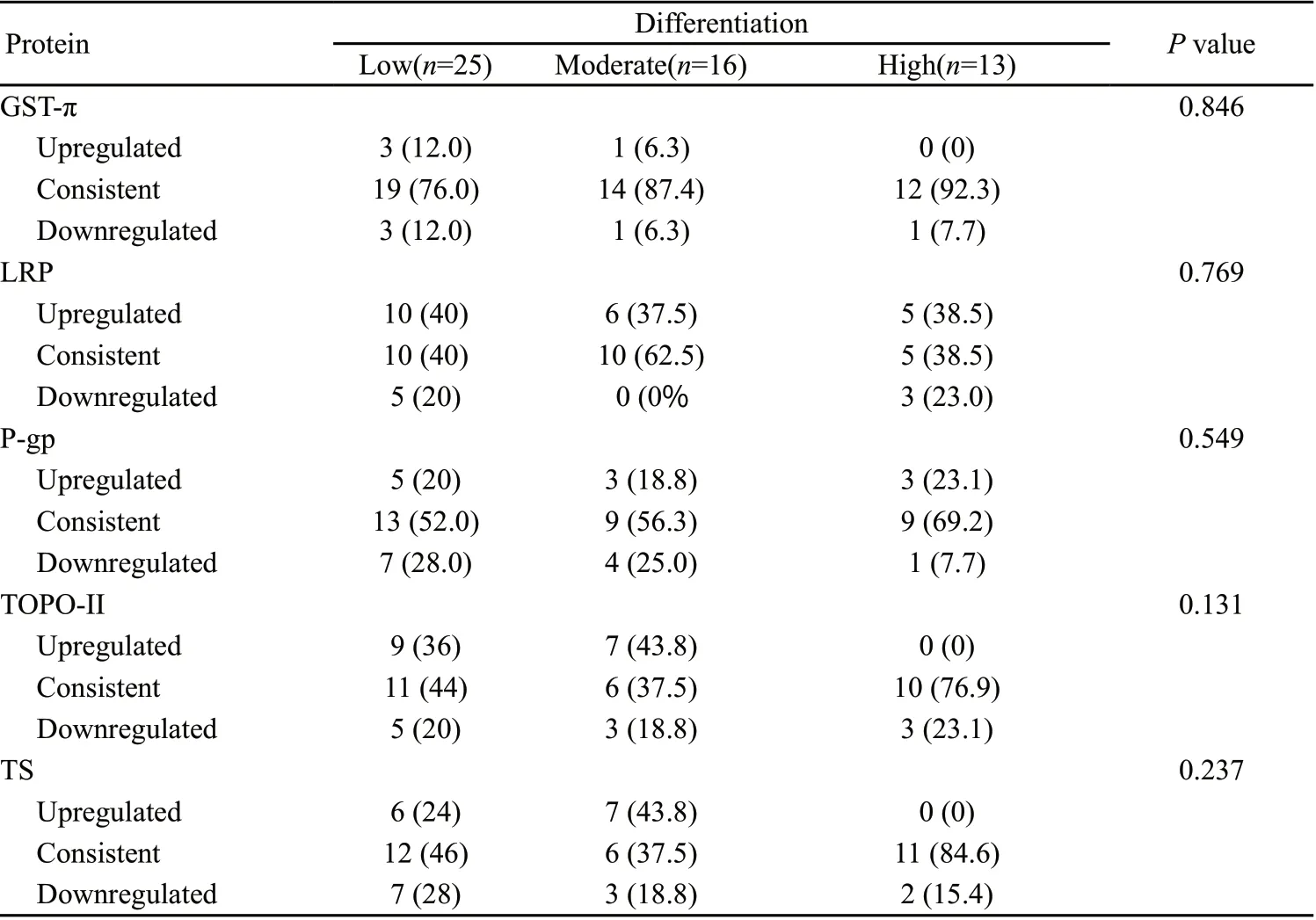
表4 肿瘤原发灶、淋巴结转移灶MDR相关蛋白表达的异质性与组织分化程度的关系Tab.4 Associations of MDR associated protein expression in primary tumors and lymph nodes based on degree of differentiation[n(%)]

图2 食管鳞癌淋巴结转移灶MDR蛋白的表达Fig.2 The expression of MDR proteins in metastatic lymph nodes in patients diagnosed with ESCC (×100)
3 讨 论
临床上接受根治术的食管胸段鳞癌患者多属中晚期,淋巴结转移率高,成为影响预后的主要因素[9]。目前研究表明,食管癌根治术后辅助化疗,虽然没有明显提高总生存率,但在有淋巴结转移的患者中有改善生存时间的趋势。国内的研究结果显示,术后辅助化疗提高了有淋巴结转移的食管癌患者生存率[10-11]。因此术后辅助化疗仍是延长食管癌患者术后生存时间的重要环节。然而临床结果也显示,术后辅助化疗在一部分患者中并未有效控制术后淋巴结转移,即耐药是困扰食管癌化疗的关键性难题。抗肿瘤药物的耐药现象可能是自然发生或是获得性的。我们推测,食管癌淋巴结转移灶中肿瘤细胞群MDR的异质性变化可能是影响术后辅助化疗效果的一个重要机制。
目前对消化道恶性肿瘤淋巴结转移灶MDR异质性的研究结果表明,胃癌、大肠癌的淋巴结转移灶确实存在MDR异质性的变化,原发灶的耐药基因相关蛋白表达水平不能预测淋巴结转移灶的MDR[12-13]。对乳腺癌原发灶与相应腋窝淋巴结转移灶的分子遗传学研究也发现此类现象[14]。但对食管胸段鳞癌淋巴结转移灶MDR异质性的研究目前鲜见报道。本研究结果显示,食管胸段鳞癌原发灶与相应的淋巴结转移灶LRP、P-gp、TS、TOPO-Ⅱ、GST-π表达和耐药不一致率分别为63.0%和26.9%、42.6%和22.2%、48.1%和25.9%、50.0%和29.6%、18.5%和1.9%。虽然只有LRP在原发灶与淋巴结转移灶的表达差异有统计学意义(P=0.026),但仍表明食管鳞癌原发灶与淋巴结转移灶存在MDR的异质性变化。本研究结果还显示,与胃癌、大肠癌两种消化道腺癌不同,食管鳞癌原发灶与淋巴结转移灶MDR相关蛋白表达的差异性与组织分化程度无关。
有关消化道恶性肿瘤原发灶与淋巴结转移灶MDR异质性研究的文献中是通过比较MDR相关蛋白表达水平的差别来分析结果的。由于在免疫组化结果判断中无表达(-)与低度表达(+),中度表达(++)与高度表达(+++)虽然表达水平有差别,但在耐药的提示意义上是一致的,因此检测结果对耐药的提示才能更好反映耐药性的差异性。本研究结果显示,虽然原发灶与相应的淋巴结转移灶MDR耐药不一致率均比表达不一致率低,但除GST-π外,LRP、P-gp、TS、TOPO-Ⅱ耐药不一致率并不低,均在20%~30%之间,表明原发灶的MDR不能预测淋巴结转移灶的MDR。
为了提高治疗效果和探索新的方案,目前临床上有更多的新药引入食管鳞癌的化疗,对传统经典的顺铂联合5-FU方案有取代的趋向。本研究中对反映铂制剂、植物碱类药物敏感性的LRP和反映5-FU敏感性的TS的检测结果显示,大多数肿瘤原发灶与淋巴结转移灶对上述药物是敏感的,说明传统经典的顺铂联合5-FU方案总体上是有效的。值得注意的是,从LRP的结果来看,淋巴结转移灶比原发灶更敏感,因此当检测原发灶提示耐药时,仍有必要检测淋巴结转移灶。本研究对P-gp检测的结果显示肿瘤原发灶与淋巴结转移灶总体上对紫杉醇、长春碱类药物敏感,而TOPO-Ⅱ的检测结果反映出肿瘤原发灶与淋巴结转移灶总体上对伊立替康不敏感。GST-π在原发灶与淋巴结转移灶中均表达且主要是中高度表达,提示对于反映此类机制的药物如环磷酰胺、氮芥、瘤可宁类药物均不适合。综上所述,食管鳞癌存在原发灶与淋巴结转移灶MDR的异质性现象,仅检测原发灶MDR相关蛋白水平难以反映淋巴结转移灶或微转移灶的MDR。食管癌根治术后影响远期疗效的主要原因之一是淋巴结转移,因此术后辅助化疗主要针对淋巴结转移灶,检测淋巴结转移灶MDR相关蛋白表达水平有助于指导食管鳞癌术后选择合理化疗方案,从而可提高术后辅助化疗效果。
[1]LIU H C, HUNG S K, HUANG C J, et al.Esophagectomy for locally advanced esophageal cancer, followed by chemoradiotherapy and adjuvant chemotherapy[J].World J Gastroenterol, 2005, 11(34): 5367–5372.
[2]ANDO N, IIZUKA T, IDE H, et al.Surgery plus chemotherapy compared with surgery alone for localized squamous cell carcinoma of the thoracic esophagus: a Japan Clinical Oncology Group Study–JCOG9204[J].J Clin Oncol, 2003, 21(24): 4592– 4596.
[3]LEE J, LEE K E, IM Y H, et al.Adjuvant chemotherapy with 5-fluorouracil and cisplatin in lymph node-positive thoracic esophageal squamous cell carcinoma[J].Ann Thorac Surg, 2005, 80(4): 1170–1175.
[4]SHIOZAKI A, YAMAGISHI H, ITOI H, et al.Longterm administration of low-dose cisplatin plus 5-fluorouracil prolongs the postoperative survival of patients with esophageal cancer[J].Oncol Rep, 2005, 13(4): 667–672.
[5]DONNENBERG V S, DONNENBERG A D.Multiple drug resistance in cancer revisited: the cancer stem cell hypothesis[J].J Clin Pharmacol, 2005, 45(8): 872–877.
[6]甘思远, 钟雪云, 谢思明, 等.肿瘤耐药相关蛋白及β-catenin在食管鳞状细胞癌中的表达及意义[J].癌症, 2010, 29(3): 323–329.
[7]TAKEBAYASHI Y, AKIYAMA S, NATSUGOE S, et al.The expression of multidrug resistance protein in human gastrointestinal tract carcinomas[J].Cancer, 1998, 82(4): 661–666.
[8]倪型灏 许沈华 张谷, 等.食管癌P-gp和P27表达水平及对生存的影响[J].中国癌症杂志, 2005, 15(5): 458–461
[9]张合林, 刘瑞林, 石彦涛, 等.胸段食管癌切除术患者的预后分析[J].中华肿瘤杂志, 2009, 31(7): 541–545.
[10]ZHANG J, CHEN H Q, ZHANG Y W, et al.Adjuvant chemotherapy in oesophageal cancer: a meta-analysis and experience from the Shanghai Cancer Hospital[J].J Int Med Res, 2008, 36(5): 875–882.
[11]郑琇山, 赵云平, 王如文, 等.影响胸段食管癌根治术预后的因素[J].中华消化外科杂志, 2008, 7(1): 41–42.
[12]韩杰, 吕炳蓉, 植碧波, 等.消化道肿瘤淋巴结转移灶多药耐药性的变化及其意义[J].中华实验外科杂志, 2006, 23(12): 1495–1496.
[13]李勇莉, 李红军, 张 敏, 等.胃癌淋巴结转移灶与原发灶P-糖蛋白的表达及意义[J].世界华人消化杂志, 2008, 16(21): 2404–2407.
[14]BECKER T E, ELLSWORTH R E, DEYARMIN B, et al.The genomic heritage of lymph node metastases: implications for clinical management of patients with breast cancer [J].Ann Surg Oncol, 2008, 15(4): 1056–1063.

