唇形科植物——苏麻和紫苏亲缘关系鉴定
罗 霞,陶 金,危克周,文晓鹏
(1.贵州大学贵州省农业生物工程研究院,贵州 贵阳 550025;2.贵州大学生命科学学院,贵州 贵阳 550025)
苏麻(Perilla frutescens Britt.var.frutescens),唇形科紫苏属一年生草本植物[1]。苏麻籽富含油脂和蛋白质,其中,含α-亚麻酸高达53.63%[2],而α-亚麻酸对降低胆固醇、降低血脂、防止动脉粥样硬化、降低脑血栓、护肝养颜、改善记忆、保护视力、缓解过敏反应、延缓衰老等具有重要作用[3]。形态学鉴定出苏麻(Perilla frutescens Britt.var.frutescens)与紫苏(P.frutescens Britt.var.acuta Kudo)为紫苏属紫苏的不同的不同变种。根据植物分类学理论,种是具有一定的自然分布区和一定的生理、形态特征的生物类群,而变种是某些遗传特征已有别于原来的种[3]。所以,单用形态学分析方法较难以鉴定其亲缘关系。本文通过ISSR标记技术结合形态学鉴定方法结果对苏麻和紫苏进行亲缘关系鉴定,更能准确的、直观的鉴定紫苏属植物苏麻与紫苏的亲缘关系,也为苏麻的综合利用及其产品的研究开发奠定基础。
1 试验材料与方法
1.1 材料
本次研究采集了贵州省苏麻样品1份和紫苏样品3份作为实验材料(表1)。

表1 供试材料的名称及主要性状Tab.1 Accession names and chief characters of the tested germplasms used for identification
1.2 方法
1.2.1 形态学鉴定 据《中国植物志》唇形科编者介绍,花萼在结果时增大与增大不明显为紫苏变种鉴定的主要指标。对4份供试材料的茎、叶、花、萼片、唇瓣等形态学性状进行记载[4-5]。
1.2.2 DNA提取及检测 取-80℃下保存的鲜嫩茎尖,利用 Plant GenomicDNA Kit(DP305-03,天根生化科技有限公司)提取基因组DNA。利用1%琼脂糖凝胶电泳和紫外分光光度计检测其质量和浓度,并用TE缓冲液将其稀释至约20mg/L。置于-20℃冰箱储存备用。
1.2.3 PCR扩增及检测 本文所用已发表文献的20个引物,由上海生工生物工程技术服务有限公司合成。从中共筛选出10个扩增效果和重复性较好的引物,其中引物M05、M06和856等扩增出的标记能将4份种质区分开来,M05:(GCT)4Y,退火温度为 50.4℃,M06:(AGC)4Y,退火温度 为 56.0℃,856:(AC)8YA,退 火 温 度 为55.0℃。其优化后的PCR扩增反应体为:10 μL反应 体 系 含 3.0 μL ddH2O,0.5 μL 引 物 (10 μmol/L),1.5 μL 模板 DNA,5.0 μL 2 × Taq PCR Master Mix。2×Taq PCR Master Mix(购于天根生化科技有限公司)含0.1 U/μL Taq polymerase,500 μmol/L dNTP each,20 mmol/L Tris-HCl(pH 8.3),100 mmol/L KCl,3 mmol/L MgCl2,以及其他稳定剂和增强剂。PCR扩增程序为:首先94℃下进行5 min的预变性;然后进行94℃变性35 s,Tm 退火45 s,72 ℃ 延伸(90 s),35 个循环;最后72℃ 延伸10 min,于4℃ 保存。
1.2.4 数据统计与分析 相同迁移位上有清晰的扩增带记为1、无带记为0,并分别用NTSYS 2.01软件与UPGMA法进行其相似性系数的计算和亲缘关系图的构建。
2 结果与分析
2.1 形态学数据
形态学结果显示苏麻与3份紫苏的差别主要为苏麻茎绿色,叶边缘不具尖锯齿,花萼结果时明显增大(10月中旬始),长1.1 cm,为紫苏(原变种);而紫苏茎紫色,花萼结果时增大不明显,长4~6 mm,为野生紫苏(变种)。
2.2 DNA提取及PCR扩增检测
利用1%琼脂糖凝胶电泳和紫外分光光度计检测DNA质量和浓度,结果表明所提取的基因组DNA质量较好(图1),可用于后续研究。图2为引物M05对苏麻及3份紫苏基因组DNA的扩增结果。

图1 供试材料基因组DNA琼脂糖凝胶电泳检测Fig.1 Agarose gel electrophoresis of genomic DNA of the tested germplasms
2.2 ISSR标记分析
从20个ISSR引物中筛选出能扩增出清晰、稳定性和重复性好且相对条数较多带纹的10个引物,对4份供试材料进行PCR分析。结果表明10个引物共获得69个标记,平均每个引物扩增6.9个,其中多态性标记51个,多态性比率为73.9%。即4份供试材料的特异性指纹图谱均有区别,其产生的标记信息可将4份供试材料完全区别开。

图2 引物M05对供试材料的扩增产物电泳图Fig.2 PCR profiles of the tested germplasms accessions amplified from primer M05
图3与表2分别为供试材料的扩增产物电泳图和特异性指纹(引物856),此引物共获得6个标记,其中多态性标记4个,多态性比率为66.7%。其标记信息可将供试材料1、2与材料3、4区别开。
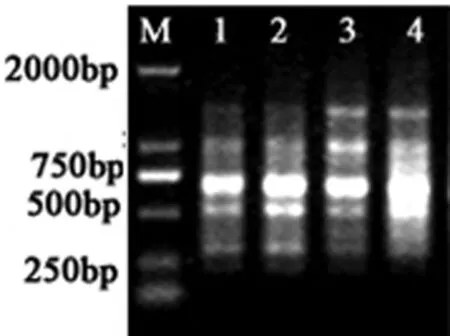
图3 引物856对供试材料的扩增产物电泳图Fig.3 PCR profiles of the tested germplasms accessions amplified from primer 856

表2 供试材料的特征ISSR谱带(引物856)Tab.2 Specific fingerprints for the tested germplasms
2.3 亲缘关系分析
根据扩增结果建立ISSR表型数据矩阵后,采用NTSYS 2.1软件分析,计算出4份供试材料间的遗传相似性系数为1.01~8.20,平均为2.71(表3)。对4份供试材料进行基于UPGMA法的树状聚类图的绘制。如图4所示:4份供试材料之间的遗传距离范围为0.35~0.53,在遗传距离为0.53处,4份供试材料可分为两个类群份供试材料可聚为两组,其中苏麻为一组,其余3份紫苏聚为一组。在遗传距离为0.35~0.44之间,3份紫苏构成一个聚类群,这个类群的品种(系)亲缘关系很近,遗传距离在0.09以内。而苏麻与3份紫苏间的亲缘关系较远,3份紫苏之间的遗传相异系数最小,为0.01。形态学鉴定出紫苏为野生紫苏,而苏麻为紫苏(原变种),苏麻与3份紫苏属于紫苏属紫苏,但属于紫苏的不同变种。即ISSR聚类结果与形态学鉴定结果相吻合。
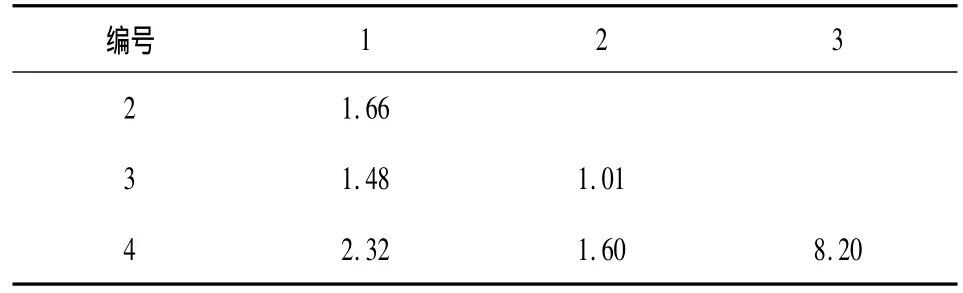
表3 4份供试材料间的遗传相似性系数Tab.3 The gennetic similarity of the tested germplasms
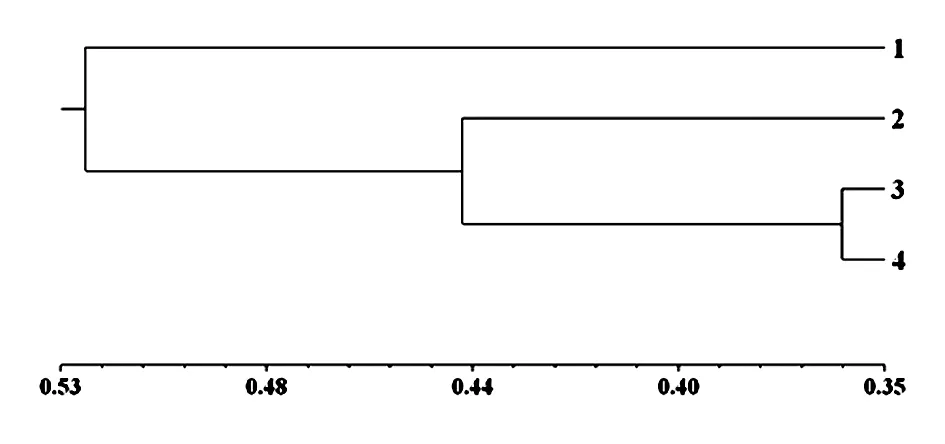
图4 供试材料的亲缘关系聚类图Fig.4 The UPGMA dendrogram of the tested germplasms
3 讨论
目前,关于利用形态学鉴定、分子标记技术或两者技术相结合用在植物分类、遗传多样性分析、亲缘关系鉴定等方面的研究报道较多。高山等采用ISSR分子标记技术对源自中国7个省份的38份瓠瓜种质进行遗传多样性分析,12个ISSR引物共扩增出96条多态性带,多态性比例为83.5%,聚类分析将供试的38份种质分为4个类群8组[6];在进行遗传多样性分析和亲缘关系鉴定研究中,形态学方法传统而又直观,DNA标记则相反,稳定性较好,已发展成为植物种质资源研究的重要手段。杨懋勋等通过形态学方法对野百合及其变种百合进行了分析[7]。Wolfe等研究表明,采用ISSR分子标记能灵敏地揭示遗传关系十分相近个体间的差异[8]。
本文应用形态学分析结合ISSR标记技术鉴定了苏麻的亲缘关系,形态学鉴定结果表明了供试苏麻为紫苏属紫苏(原变种),3份供试紫苏为紫苏属野生紫苏,即苏麻与3份紫苏属于同种的不同变种。分析其遗传相似性系数得出4份供试材料的遗传相似性系数1.01~8.20,平均为2.71,且紫苏3与紫苏4的遗传相似性系数最高,为8.20。亲缘关系聚类图显示了4份供试材料之间的遗传距离范围为0.35~0.53,在遗传距离为0.53处,4份供试材料可分为两个类群份供试材料可聚为两组,其中苏麻为一组,其余3份紫苏聚为一组,这个类群的种质亲缘关系很近,遗传距离在0.09以内。此外,3份紫苏茎均为紫色、花萼结果时均增大不明显,主要区别在于紫苏1叶缘具尖锯齿,而紫苏2和紫苏3叶缘均无齿。在遗传距离0.44处,这3份紫苏可分为两个类群,紫苏1聚为一类,紫苏2和紫苏3聚为一类,遗传距离在0.09以内,且紫苏2和紫苏3亲缘关系最近,遗传距离为0.01。ISSR聚类分析结果不仅与形态学鉴定的结果一致,且能更准确、更有效的对4份供试材料进行亲缘关系鉴定。近来,季祥彪等应用形态学结合分子标记技术研究贵州12种兰属植物资源的结果也证明了这一点[8]。本研究利用ISSR分子标记技术结合形态学鉴定方法,能很好地把紫苏(原变种)和野生紫苏明显区分开来。实际上,现行的任何一种检测技术都不是万能的,但都能提供许多有价值的信息,应该注重它们的协同性。
[1]中国科学院植物志编辑委员会.中国植物志:66卷[M].北京:科学出版社,1977:282-286.
[2]焦士蓉,谢贞建,李 倩,等.苏麻籽油及其粕的组成成分[J].中国油脂,2008,33(3):72-73.
[3]王佛生,盖琼辉.紫苏属植物分类刍议[J].甘肃农业科技,2010,10:50-52.
[4]陈谦海.贵州植物志[M].贵阳:贵州科技出版社,2004:310-566.
[5]陈俊愉.中国花卉品种分类学[M].北京:中国林业出版社,2001.
[6]高 山,许端详,林碧英,等.38份瓠瓜种质资源遗传多样性的ISSR分析[J].植物遗传资源学报,2007,8(4):396-400.
[7]杨懋勋,张 晖,董 斌.野百合及其变种百合的形态分类研究[J].广东林业科技,2008,24(2):42-45.
[8]WOLFE A D,XIANG Q Y,KEPHART S R.Assessing hybridization in natural populations of Penstemon(Scrophulariaceae)using hypervariable intersimple sequence repeat(ISSR)bands[J].Molecular Ecology,1998,7(9):1 107-1 125.
[9]季祥彪,王国鼎,康继川.贵州12种兰属植物资源形态学和RAPD标记的比较分析[J].种子,2008,27(2):56-59.
- 山地农业生物学报的其它文章
- 紫茎泽兰水浸液对不同玉米品种的化感效应分析

