单侧输尿管梗阻肾间质纤维化大鼠肾组织PHB1和PHB2的表达及意义
雷凤英,陈秀萍,周志强,周添标,黄韦芳,覃远汉,蒋 玲
(1广西医科大学第一附属医院,南宁 530021;2中山大学附属第六医院)
肾间质纤维化(RIF)是多种肾脏疾病慢性进展至终末期肾病(ESRD)的共同病理特征[1],其主要病理特征为肾间质成纤维细胞增生和包括Ⅳ型胶原(Col-Ⅳ)和纤维连结蛋白(FN)在内的细胞外基质(ECM)的过度积聚[2]。PHB是一种存在于细胞内的抗增殖蛋白,与细胞周期、凋亡与增殖、维持线粒体功能、抗肿瘤等密切相关[3]。前期研究发现,PHB与RIF发生发展密切相关[4]。本研究观察单侧输尿管梗阻(UUO)RIF大鼠肾组织PHB1和PHB2的表达,并探讨其意义。
1 材料与方法
1.1 动物 80只雄性6周龄Wistar大鼠,购于广西医科大学实验动物中心。
1.2 方法
1.2.1 动物分组及处理 Wistar大鼠随机分为假手术组和模型组,每组40只。模型组大鼠无菌条件下行左侧输尿管双重结扎术。假手术组大鼠在同样的条件下,仅探及肾包膜,不结扎输尿管。两组大鼠均常规喂养。于术后第2周末和第4周末腹腔麻醉后分别处死20只大鼠,摘除左侧肾脏。分别取1/2肾脏立即用10%中性甲醛固定,用于肾脏病理学检查;另1/2肾脏立即置于液氮冷冻保存,用于实时荧光定量RT-PCR及Western blot检测。
1.2.2 肾组织病理学检查 常规石蜡包埋肾脏组织,4 μm切片,行Masson染色后,光镜下观察肾脏的病理改变。结果采用DMR加Q550病理图像分析系统(德国Leica公司)进行半定量分析。在400倍下每张切片随机选择5不重叠视野,避开大血管和肾小球,将呈现绿色的纤维区域视为阳性目标,以阳性面积与整个视野总面积的比值作为RIF指数[5]。RIF指数(%)=(纤维化面积/肾小管间质总面积)×100%。
1.2.3 肾组织 PHB1、PHB2、TGF-β1mRNA 测定采用实时荧光定量RT-PCR法。取大鼠冰冻肾脏组织100 mg,按RNA提取试剂盒提取总RNA。步骤参照试剂盒说明书。引物均由上海生物工程公司生产。每个样本重复测量3次,取其平均值为样本Ct值,用 2-△△CT法[6,7]进行 mRNA 相对表达量比较。
1.2.4 肾组织 PHB1、PHB2、TGF-β1、Col-Ⅳ、FN 蛋白检测 采用Western blot法。取大鼠肾脏组织100 mg,在液氮中将肾组织研磨至粉末后,提取总蛋白,测定浓度。总蛋白变性后进行Western blot检测,步骤参照试剂盒说明书。工作液浓度:PHB1:1∶1 000、PHB2:1∶1 500、TGF-β1:1∶2 000、Col-Ⅳ:1∶1 000、FN:1∶2 000。
1.2.5 统计学方法 采用SPSS16.0统计软件。计量资料用±s表示,组间比较采用完全随机设计t检验;采用直线相关分析进行相关分析。P≤0.05为差异有统计学意义。
2 结果
2.1 肾脏病理改变 手术后第2周末和第4周末光镜下假手术组大鼠肾脏无明显病理改变。模型组大鼠手术后第2周末,肾小管和集合管呈囊状扩张,肾皮质区分布大量弥漫性炎性细胞,肾间质面积增宽、肾间质组织纤维化;第4周末肾小管结构出现严重破坏,小管间质明显变宽,肾小管明显萎缩,肾小管上皮细胞(RTEC)出现大量坏死,大量炎性细胞和纤维组织增生。两组RIF指数比较见表1。
表1 两组大鼠肾组织RIF指数比较(±s,n=40)

表1 两组大鼠肾组织RIF指数比较(±s,n=40)
注:与同组第2周末比较,*P<0.01;与假手术组同时间点比较,△P <0.01
组别 RIF 指数第2周末 第4周末假手术组0.78 ±0.10 0.81 ±0.09模型组 24.48±1.33△ 40.59±1.35*△
2.2 肾组织 PHB1、PHB2、TGF-β1mRNA 检测结果见表2。
表2 两组大鼠肾组织PHB1、PHB2、TGF-β1mRNA比较( ± s,n=40)
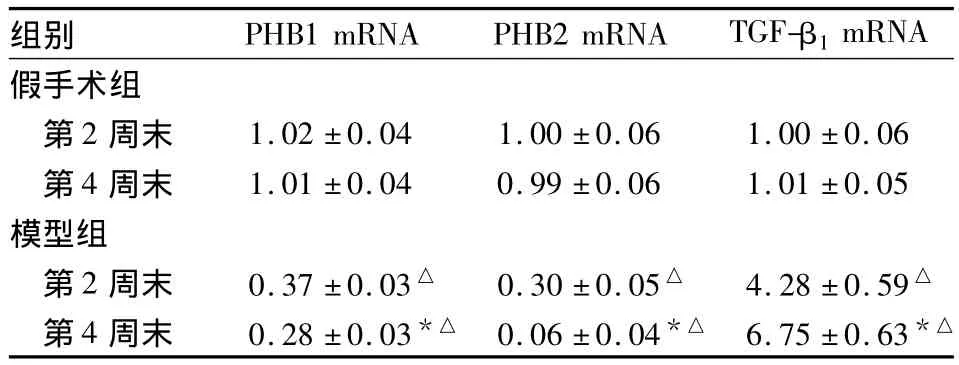
表2 两组大鼠肾组织PHB1、PHB2、TGF-β1mRNA比较( ± s,n=40)
注:与同组第2周末比较,*P<0.01;与假手术组同时间点比较,△P <0.01
组别 PHB1 mRNA PHB2 mRNA TGF-β1mRNA假手术组第2 周末 1.02 ±0.04 1.00 ±0.06 1.00 ±0.06第4 周末 1.01 ±0.04 0.99 ±0.06 1.01 ±0.05模型组第2周末 0.37±0.03△ 0.30 ±0.05△ 4.28±0.59△第4 周末 0.28 ±0.03*△ 0.06 ±0.04*△ 6.75 ±0.63*△
2.3 肾组织 PHB1、PHB2、TGF-β1、Col-Ⅳ、FN 蛋白检测结果 见表3。
表 3 两组大鼠肾组织 PHB1、PHB2、TGF-β1、Col-Ⅳ、FN 蛋白比较( ± s,n=40)
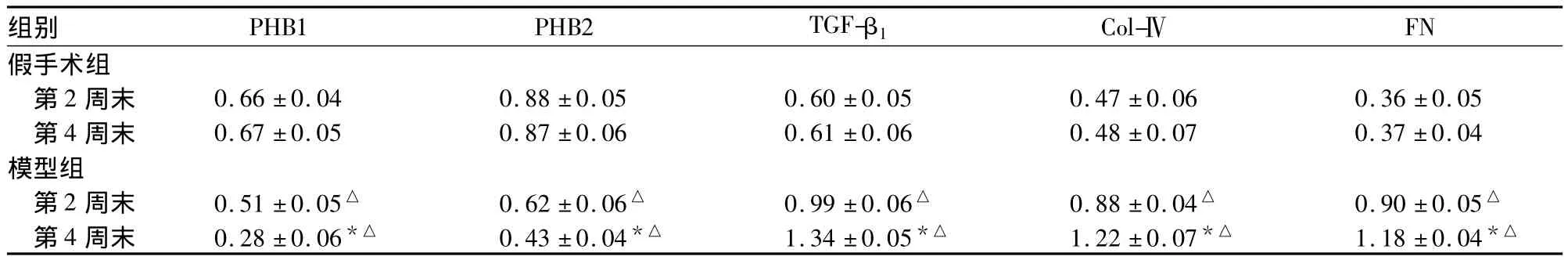
表 3 两组大鼠肾组织 PHB1、PHB2、TGF-β1、Col-Ⅳ、FN 蛋白比较( ± s,n=40)
注:与同组第2周末比较,*P<0.01;与假手术组同时间点比较,△P<0.01
组别 PHB1 PHB2 TGF-β1 Col-ⅣFN假手术组第2 周末 0.66 ±0.04 0.88 ±0.05 0.60 ±0.05 0.47 ±0.06 0.36 ±0.05第4 周末 0.67 ±0.05 0.87 ±0.06 0.61 ±0.06 0.48 ±0.07 0.37 ±0.04模型组第2周末 0.51±0.05△ 0.62 ±0.06△ 0.99±0.06△ 0.88±0.04△ 0.90±0.05△第4周末 0.28±0.06*△ 0.43 ±0.04*△ 1.34±0.05*△ 1.22±0.07*△ 1.18±0.04*△
2.4 相关性分析结果 大鼠肾组织PHB1蛋白表达与 RIF 指数、TGF-β1、Col-Ⅳ、FN 均呈负相关(r分别为 -0.86、-0.87、-0.70、-0.73,P均 <0.05);PHB2 蛋白表达与 RIF 指数、TGF-β1、Col-Ⅳ、FN 均呈负相关(r分别为 -0.73、-0.81、-0.91、-0.84,P均 <0.05);PHB1蛋白表达与 PHB2蛋白表达呈正相关(r=0.78,P<0.05)。
3 讨论
UUO大鼠模型是目前研究RIF的经典动物模型。UUO大鼠首先出现肾脏血流动力学改变和代谢改变,继而出现肾小管损伤和RTEC凋亡和坏死,肾间质巨噬细胞和单核细胞浸润,肾间质成纤维细胞和肌成纤维细胞增殖,导致包括FN和Col-Ⅳ在内的 ECM 积聚和 RIF 发生[8,9]。TGF-β1是一种多效因子[10],是目前公认的强致纤维化因子之一,能刺激成纤维细胞分泌Col-Ⅳ和FN,加剧纤维化,在RIF进程中发挥重要作用。本研究结果显示,模型组术后第2周末和第4周末大鼠肾脏病理改变为肾小管间质变宽,肾小管萎缩,大量炎性细胞浸润和纤维组织增生;与假手术组比较,模型组大鼠术后第2周末和第4周末肾组织RIF指数显著增高,TGF-β1、Col-Ⅳ、FN蛋白表达均增高,与文献报道相符[11],提示UUO模型构建成功。
PHB是一种结构高度保守的肿瘤抑制因子,广泛分布于真核生物、细菌、真菌、植物及哺乳动物等细胞中,能通过作用于核转录因子E2F使细胞周期阻滞于G1/S期,与细胞凋亡及增殖、维持线粒体功能、抗肿瘤等密切相关[3,12]。PHB 家族包括 PHB1和PHB2,分布并游离在线粒体、细胞核、细胞质膜等部位[12]。在正常肾脏组织中可检测到 PHB表达。Guo等[13]在不同程度肾小管间质损伤儿童肾病的肾脏组织活检中发现,PHB1在损伤的肾小管间质中表达降低,并且其蛋白表达水平与肾小管间质损伤程度呈负相关,同时在体外培养的大鼠成纤维细胞株中过表达 PHB后发现,PHB可以抑制TGF-β1诱导成纤维细胞的增殖和表型改变。Quan等[14]应用质谱分析高尿酸诱导体外培养RTEC损伤的蛋白表达变化,发现损伤的RTEC中PHB2表达显著下调。前期研究发现,UUO大鼠肾脏组织PHB表达与细胞凋亡指数显著相关[4]。
本研究结果显示,UUO大鼠梗阻时间越长,肾脏组织PHB1和PHB2表达越低,RIF越严重。提示PHB1和PHB2表达显著降低,可能参与了RIF的发生发展,但确切的作用机制有待进一步深入探讨。
[1]Farris AB,Colvin RB.Renal interstitial fibrosis:mechanisms and evaluation[J].Curr Opin Nephrol Hypertens,2012,21(3):289-300.
[2]Genovese F,Manresa AA,Leeming DJ,et al.The extracellular matrix in the kidney:a source of novel non-invasive biomarkers of kidney fibrosis[J].Fibrogenesis Tissue Repair,2014,7(1):4.
[3]Zhou TB,Qin YH.Signaling pathways of prohibitin and its role in diseases[J].J Recept Signal Transduct Res,2013,33(1):28-36.
[4]Zhou TB,Qin YH,Zhou C,et al.Less expression of prohibitin is associated with increased caspase-3 expression and cell apoptosis in renal interstitial fibrosis rats[J].Nephrology(Carlton),2012,17(2):189-196.
[5]Yokoi H,Mukoyama M,Nagae T,et al.Reduction in connective tissue growth factor by antisense treatment ameliorates renal tubulointerstitial fibrosis[J].J Am Soc Nephrol,2004,15(6):1430-1440.
[6]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J].Methods,2001,25(4):402-408.
[7]Chen XP,Lei FY,Qin YH,et al.The role of retinoic acid receptors in the signal pathway of all-trans retinoic acid-induced differentiation in adriamycin-induced podocyte injury[J].J Recept Signal Transduct Res,2014:1-9.[Epub ahead of print].
[8]Chevalier RL,Forbes MS,Thornhill BA.Ureteral obstruction as a model of renal interstitial fibrosis and obstructive nephropathy[J].Kidney Int,2009,75(11):1145-1152.
[9] Klahr S,Morrissey J.Obstructive nephropathy and renal fibrosis[J].Am J Physiol Renal Physiol,2002,283(5):861-875.
[10]Brophy TM,Coller BS,Ahamed J.Identification of the thiol isomerase-binding peptide,mastoparan,as a novel inhibitor of shear-induced transforming growth factor beta1(TGF-beta1)activation[J].J Biol Chem,2013,288(15):10628-10639.
[11]Chaabane W,Praddaude F,Buleon M,et al.Renal functional decline and glomerulotubular injury are arrested but not restored by release of unilateral ureteral obstruction(UUO)[J].Am J Physiol Renal Physiol,2013,304(4):432-439.
[12]Chowdhury I,Garcia-Barrio M,Harp D,et al.The emerging roles of prohibitins in folliculogenesis[J].Front Biosci(Elite Ed),2012(4):690-699.
[13]Guo W,Xu H,Chen J,et al.Prohibitin suppresses renal interstitial fibroblasts proliferation and phenotypic change induced by transforming growth factor-beta1[J].Mol Cell Biochem,2007,295(1-2):167-177.
[14] Quan H,Peng X,Liu S,et al.Differentially expressed protein profile of renal tubule cell stimulated by elevated uric acid using SILAC coupled to LC-MS[J].Cell Physiol Biochem,2011,27(1):91-98.

