二甲苯对小鼠脑组织损伤的研究
张自强,刘玉梅,朱雪敏,位 兰,李梦云,司丽芳,李 健
(河南科技大学动物科技学院,河南 洛阳,471003)
二甲苯属于芳香烃类,是一种无色透明、易挥发的液体,被广泛应用于树脂及油漆等生产工艺中。随着树脂粘合剂、泡沫塑料、人造板材和油漆等的大量应用,致使二甲苯污染日益严重,成为室内空气污染物的主要成分。研究表明,二甲苯的主要危害是影响中枢神经系统,并伴有头痛、头晕和恶心;还可影响造血机能,引起血液系统的疾病,是白血病的主要诱因,被世界卫生组织确认为有毒致癌物质之一[1]。大量试验证实,二甲苯可损害眼角膜[2-3]、肝[4-5]、肾[4]、肺[5]、胚胎[6]等组织,但是二甲苯对脑组织的毒副作用尚缺乏详细报道。本研究通过给小鼠注射不同浓度的二甲苯,观察其对小鼠海马组织形态的影响,并测定小鼠脑组织中超氧化物歧化酶(Total superoxide dismutase,T-SOD)活性和丙二醛(Malondialdehyde,MDA)含量,研究二甲苯致小鼠脑组织损伤情况,以进一步揭示二甲苯对神经系统的毒副作用。
1 材料与方法
1.1 实验动物 健康昆明系小鼠,体重20±2 g,共96只,雌雄各半,购自河南科技大学实验动物中心。
1.2 试验分组 将小鼠随机分为4组,对照组和二甲苯低、中、高剂量组,每组24只。二甲苯低、中、高剂量组分别每天腹腔注射0.125、0.25、0.5 mL/kg二甲苯,对照组小鼠每日注射等量生理盐水,连续注射15 d。
1.3 试验取材 小鼠连续注射二甲苯15 d后,禁食12 h,速眠新麻醉,打开胸腔暴露心脏,剪开右心耳,快速用生理盐水灌注左心室,使小鼠体内血液全部排出,迅速取出整个脑组织,一侧大脑半球制成匀浆用于检测T-SOD活性和MDA含量,另一侧大脑半球保存于4%多聚甲醛溶液中,用于制作石蜡切片。
1.4 小鼠海马组织切片的制作 小鼠大脑组织固定42 h后,脱水、透明、包埋于石蜡中,连续冠状5 μm厚切片被制作,每组分别选取第310张到320张之间的切片,H.E.染色。为了观察二甲苯对小鼠脑组织的毒性,不同组的小鼠,其同一位置切片的同一区域被拍照比较。
1.5 T-SOD活性和MDA含量的测定 将4组小鼠取出的新鲜脑组织在电子天平上称重,加入适当的生理盐水,研磨配成5%和10%匀浆。按照试剂盒上的说明书配制并测定脑组织内T-SOD活性和MDA含量,再用考马斯亮蓝试剂盒测定每组小鼠脑组织蛋白含量,其结果分别以U/mg prot及nmol/mL表示。
1.6 数据处理 试验结果采用SPSS16.0软件进行单因素方差分析,组间差异采用LSD多重比较,显著水平为P<0.05。试验结果均以X±SD表示。
2 结果
2.1 二甲苯对小鼠海马齿状回和CA1区神经细胞形态的影响 小鼠切片H.E.染色结果显示,对照组海马齿状回和CA1区锥体细胞排列整齐,紧密,形态正常,无变性,无胶质细胞增生,核大而圆,轮廓清晰,呈均匀淡蓝色或蓝色,核仁清晰,细胞质丰富(图1A和图2A);二甲苯低剂量(0.125 mL/kg)组小鼠海马结构相对完整,细胞形态良好,无明显变性细胞(图1B和图2B),与对照组差异不明显。二甲苯中剂量组(0.25 mL/kg)小鼠海马齿状回细胞排列不规则,有部分细胞染色加深、出现核固缩,CA1区细胞间隙增大、排列松散(图1C和图2C);二甲苯高剂量组(0.5 mL/kg)小鼠海马齿状回和CA1区细胞排列稀疏紊乱,细胞脱失明显,甚至仅见少量残存的不规则细胞,较多神经细胞出现核固缩、核溶解、细胞间隙扩大,排列松散,细胞轮廓不清晰(图1D和图2D)。
2.2 二甲苯对小鼠脑组织T-SOD活性和MDA含量的影响 二甲苯对小鼠脑组织T-SOD活性和MDA含量的影响见表1。由表1可知,对照组小鼠脑组织T-SOD活性为77.61 U/mg prot,二甲苯腹腔注射后,小鼠脑组织T-SOD分别降低了4.20%、22.97%和32.16%,与对照组相比,中、高剂量的二甲苯能引起小鼠脑组织T-SOD活性显著降低。对照组小鼠脑组织MDA含量3.61 nmol/mg prot,二甲苯腹腔注射后,小鼠脑组织MDA含量分别升高了23.27%、83.93%和94.74%,与对照组相比,中、高剂量的二甲苯能引起小鼠脑组织MDA含量显著升高。
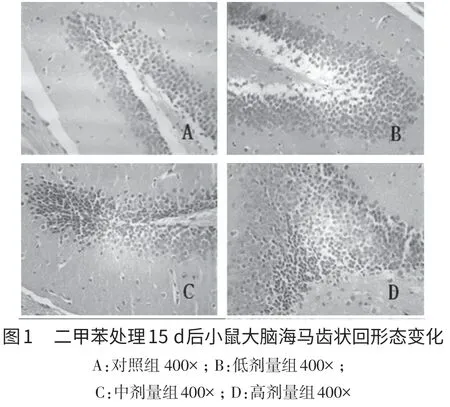
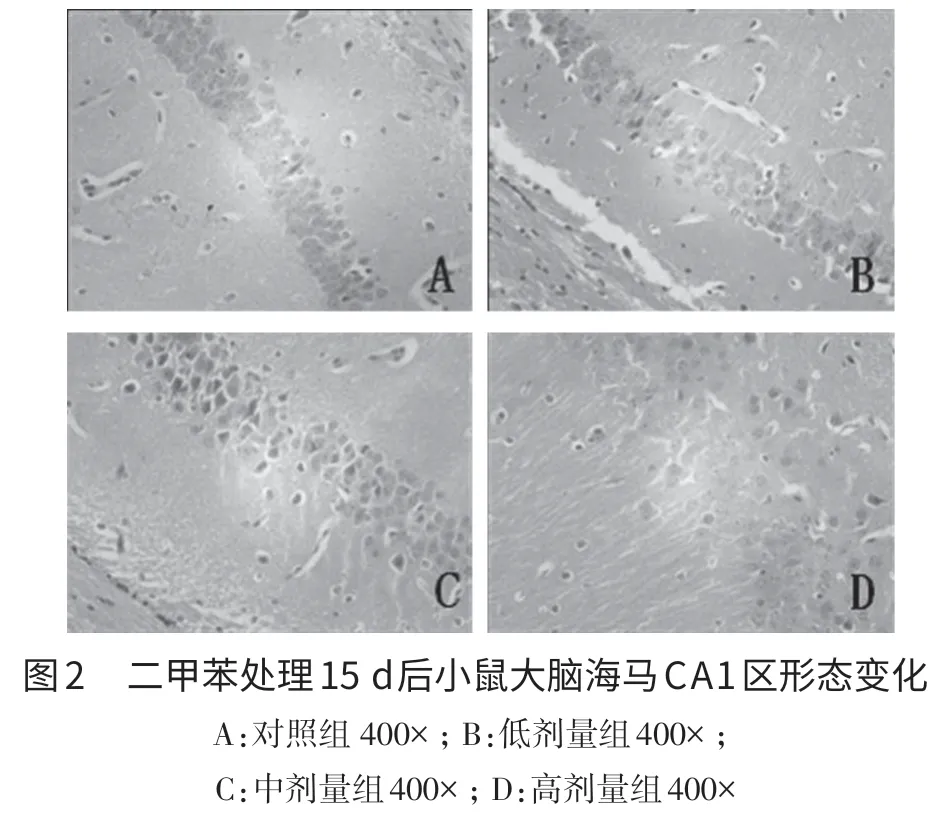
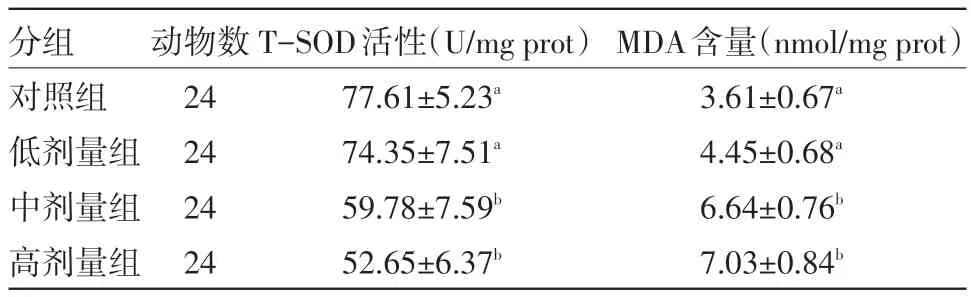
表1 二甲苯对小鼠脑组织T-SOD活性和MDA含量的影响 (X±SD)
3 讨论
研究证实,脑组织比其他任何组织器官更容易受到毒物的攻击,这是由于脑组织具有较高的需氧量、高水平的不饱和脂质、极高的代谢率。大量研究表明,体内外很多因素都易引起脑组织的损伤。Silvia等人报道,乙醇能通过激活神经免疫系统和Toll样受体,从而引起神经细胞营养不良,最终诱发脑组织损伤[7];Kim等人证实了慢性冷刺激能诱发海马细胞凋亡、活性氧自由基增多以及脑组织脂质过氧化水平升高[8]。文献表明,二甲苯具有广泛的生物毒性,可损害眼角膜、肝、肾、肺、卵巢等组织,且对妊娠及胚胎发育具有毒性作用。流行病学调查[1,9]显示,经常接触二甲苯的生产工人,神经行为明显改变,表现为记忆力减退,视觉反应时延长,焦虑及嗜睡等,并随着接触时间的延长而加重,在脱离接触二甲苯一段时间后症状可有所缓解。本文通过给小鼠腹腔注射不同剂量的二甲苯15 d后,观察发现,中、高剂量组部分小鼠出现角弓反张,后肢麻痹托地,行走不稳,不能站立,瞳孔放大,全身震颤抽搐不止,抓耳挠头,烦躁不安,部分出现扎推,精神抑郁等症状(图片未显示)。可见,二甲苯对神经系统有毒性作用。
大脑海马区是大脑中与学习记忆密切相关的区域,其齿状回、CA1区和CA3区在长时程增强的三突触回路中发挥关键作用。研究表明,体内外很多致病因素如衰老、自由基等很容易引发海马区的损伤[10-11]。由此,本研究通过形态学观察发现,小鼠腹腔注射高剂量的二甲苯后脑组织海马齿状回和CA1区神经细胞核溶解,坏死脱失较多,结构破坏,细胞层数明显减少,排列紊乱,出现胞浆深染、核固缩等一系列病理变化。分析其原因,可能是由于二甲苯具有挥发性强和脂溶性高等特征,其穿过血脑屏障后,促使细胞膜和质膜中的脂类物质溶解,从而引起神经细胞的功能损伤所致。有文献报道,二甲苯能够增加体外原代培养神经细胞的乳酸脱氢酶(Lactate dehydrogenase,LDH)漏出率[1],推测二甲苯能够引起细胞膜损伤,增加细胞膜的通透性;当加入神经节苷酯后,神经细胞损伤程度有所缓解,而神经节苷酯是神经细胞膜的主要成分之一,可见二甲苯很可能穿过血脑屏障后通过损伤神经细胞膜而诱发神经毒性。另有资料证实,苯可通过上调Bax蛋白和下调Bcl-2蛋白表达诱发小鼠睾丸细胞凋亡[12],由此推测二甲苯很可能也会通过影响凋亡相关蛋白的表达而损伤脑组织。
由于脑组织内抗氧化防御系统相对缺乏(各种抗氧化酶活力低),因此极易受到自由基的攻击[13,14]。由此本研究进一步从氧化应激角度揭示二甲苯对脑组织的毒性。结果表明,二甲苯能够引起小鼠脑组织T-SOD活性降低,MDA含量升高,且随着剂量的增加,这种变化越明显。SOD是机体细胞抵御氧化损伤最重要的酶类之一,主要功能是清除体内有氧代谢产生的超氧自由基,使机体免受损害[15],说明二甲苯致使小鼠脑组织清除超氧自由基的能力降低,从而造成了脑组织损伤,继而会诱发形态发生病变。MDA是机体内氧自由基攻击生物膜中的不饱和脂肪酸形成的脂质过氧化物[16],测试MDA含量可反映机体内脂质过氧化程度,而脂质过氧化是一个发生在细胞膜性组分并由自由基介导可导致细胞结构破坏、组织内容物外溢、细胞死亡的过程,由此本研究进一步推测二甲苯最终可能是通过破坏了神经细胞的膜性成分而引起脑组织损伤。神经细胞中膜受体是影响信号转导的关键成分,而二甲苯是否通过影响膜受体的功能继而阻碍神经细胞间的信号传递还需进一步研究。
[1]颜士勇,郭丰涛,竺青,等.二甲苯对原代培养神经细胞毒性的实验研究[J].海军医学杂志,2002,23(3):200-202.
[2]曾曙芳,王贵平.二甲苯致角膜损伤的临床研究[J].中国初级卫生保健,2011,25(5):129-130.
[3]李白霓,李红枝,魏凤香,等.二甲苯致小鼠角膜损伤以及角膜染色体损伤的研究[J].中国实用医药,2008,3(9):90.
[4]蒋灵芝,熊平,谢穗贤,等.二甲苯对小鼠染毒后肝肾某些形态学变化[J].毒理学杂志,2007,21(5):415-416.
[5]逯越,于新宇,赵东利,等.二甲苯染毒小鼠肝和肺的形态学观察[J].中国职业医学,2006,33(3):239.
[6]吕丹瑜,刘雅琼,刘宁,等.二甲苯对妊娠小鼠及胚胎发育的毒性作用[J].解剖学报,2006,37(3):355-359.
[7]Silvia A L,Pascual M,Guerri C.Gender differences in alcohol-induced neurotoxicity and brain damage[J].Toxicology,2013,311:27-34.
[8]Kim Y K,Lee J S,Han J M,et al.Myelophil attenuates brain oxidative damage by modulating the hypothalamus-pituitary-adrenal(HPA)axis in a chronic cold-stress mouse model[J].Journal of ethnopharmacology,2013,148(2):505-514.
[9]Olson B A,Gamberale F,Iregren A.Coexposure to toluene and pxylene in man:central nervous functions[J].Br J Ind Med,1985,42:117-122.
[10]Pellmar T C,Kaisho Y,Hughes P,et al.Free radicals accelerate the decay of long-term potentiation in field CA1 of guinea-pig hippocampus[J].Neuroscience,1991,44:353-359.
[11]Xu N,Majidi V,Markesbery W R,et al.Brain aluminum in Alzheimer′s disease using an improved GFAAS method[J].Neurotoxicology,1992,13:735-744.
[12]杨双波,李纯颖,张英彪,等.苯与甲醛对小鼠睾丸细胞凋亡及Bcl-2和Bax表达的影响[J].实用预防医学,2008,15(4):1319-1321.
[13]Sun S W,Yu H Q,Zhang H,et al.Quercetin attenuates spontaneous behavior and spatial memory impairment in D-galactosetreated mice by increasing brain antioxidant capacity[J].Nutr Res,2007,27:169-175.
[14]Benzi G,Pastoris D,Mazzatico F,et al.Age related effect induced by oxidative stress on the cerebral glutathione system[J].Neurochem Res,1989,14:473-81.
[15]McCord J M,Fridovich I.The reduction of cytochrome C by milk xanthine oxidase[J].J Biol Chem,1968,243:5753-5760.
[16]Todorova I,Simeonova G,Kyuchukova D,et al.Reference values of oxidative stress parameters(MDA,SOD,CAT)in dogs and cats[J].Comp Clin Path,2005,13:190-194.

