水疱性口炎病毒两血清型G蛋白的截短表达和间接ELISA方法的建立
臧京帅,高志强,张乐萃,张鹤晓
(1.青岛农业大学动物科技学院,山东 青岛 266109;2.北京出入境检验检疫局,北京 朝阳 100026)
水疱性口炎(Vesicular stomatitis,VS)是由水疱性口炎病毒(Vesicular stomatitis virus,VSV)引起的动物病毒性传染病,VSV可感染马及其他多种动物,其中马的易感性最强。其临床特征为短期发热,口腔黏膜、乳头上皮、趾间及蹄冠部出现丘疹和水疱[1]。人偶发感染,以流感症状为主。水疱性口炎病毒属于弹状病毒科水疱性病毒属,为负链RNA有囊膜病毒。根据病毒的抗原性,可将VSV分成两个血清型,即新泽西型(VSV-NJ)和印第安那型(VSV-IND);但这2个血清型的病毒在结构基因组成、转录调控和病毒蛋白等方面均相同[2]。由于我国还没有该病发生和流行的报道,故将其列为外来病,在进出境动物检疫对象中被列为二类病。该病毒是通过糖蛋白G吸附于敏感细胞表面受体磷酰丝氨酸(PS)而开始感染。如果利用蛋白酶去掉G蛋白,可使病毒的感染性大幅度降低,但一旦将完整的G蛋白重新加入无包膜突起的病毒粒子中,又可恢复其感染性[3]。
在进出口动物检疫中,对于水疱性口炎病毒抗体检测,目前采用的方法为中和试验(VN),液相阻断ELISA(LP-ELISA)和补体结合试验(CF)。其中VN生物安全要求较高,且检测周期长;LP-ELISA和CF操作相对繁琐。由于VSV-NJ和VSVIND仅有部分交叉反应,因此在采用LP-ELISA检测抗体时需要将两种血清型的抗原等量混合后检测抗体。
本研究在对VSV-IND和VSV-NJ的G蛋白抗原性进行分析的基础上,选取抗原表位较密集且交叉性较多的区域,利用大肠杆菌体外分别表达两个血清型的G-657 bp和G-666 bp基因片段,将表达纯化的蛋白等量混合后建立间接ELISA方法检测水泡性口炎病毒抗体。
1 材料与方法
1.1 试剂 TRIZol,购自Invitrogen公司;DNA片段回收试剂盒,限制性内切酶Bam HI,Hind III,购自TaKaRa公司;M-MLV反转录酶,Taq DNA聚合酶,购自Promega公司;HRP标记的Protein G,购自SouthernBiotech公司。
1.2 病毒核酸、质粒、宿主菌及血清 VSV-IND G6R mutant株病毒核酸,本实验室保存;VSV NJ株病毒核酸,美国NVSL提供;原核表达质粒pET-32a,大肠杆菌(E.coli)TOP10,Rosetta,本实验室保存;IND型、NJ型水疱性口炎中和抗体阳性血清,美国NVSL提供。
1.3 水疱性口炎病毒IND型和NJ型G蛋白截短后基因扩增、克隆 根据已知序列,用DNAStar分析VSV-IND和VSV-NJ G蛋白,根据其抗原表位分布,选取了长度为657 bp和666 bp的两段基因片段,分别命名为IND-G-657和NJ-G-666,并在其两端利用Oligo 6.0设计以下两对引物,设计的引物名称、序列见表1。
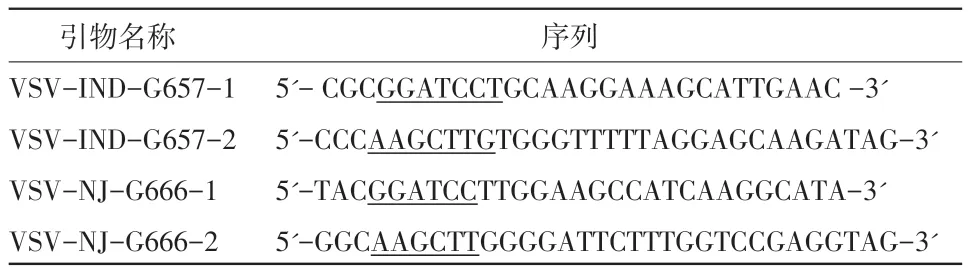
表1 用于扩增VSVIND-G-657和NJ-G-666的引物名称和序列
将VSV-IND株和VSV-NJ株核酸分别进行RT-PCR扩增,将扩增的目的片段克隆于pMD-T20载体并转化至大肠杆菌TOP10中,将鉴定正确的阳性克隆子进行测序,分别命名为pMD-T20-INDG657和pMD-T20-NJ-G666。
1.4 原核表达载体构建与序列分析 分别用限制性内切酶BamHI,Hind III对pMD-T20-IND-G657、pMD-T20-NJ-G666以及pET-32a表达载体37℃双酶切后与pET-32a表达载体进行连接,转化至大肠杆菌TOP10。将鉴定为阳性的质粒分别命名为pET-32a-IND-G657和pET-32a-NJ-G666。
1.5 重组蛋白的诱导表达 将重组质粒pET-32a-IND-G657和pET-32a-NJ-G666分别转化Rosetta宿主菌,加入终浓度为1.0 mmol/L的IPTG,在27℃进行诱导表达,将表达产物进行SDS-PAGE电泳。
1.6 重组蛋白的诱导表达优化 对加入IPTG的终浓度、培养温度及诱导时间等条件进行优化。
1.7 包涵体蛋白的洗涤与溶解 将包涵体用含2 mol/L尿素的Tris缓冲液进行洗涤,重复两次后将沉淀用含8 mol/L尿素的Tris缓冲液溶解,进行SDS-PAGE检测。
1.8 包涵体蛋白的纯化、复性 使用HIS.BIND resin蛋白纯化试剂盒在变性条件下进行蛋白纯化。
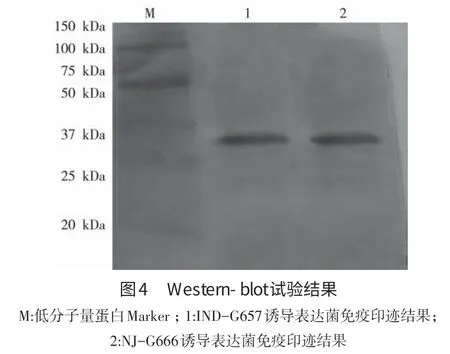
1.9 重组蛋白的反应原性检测 将纯化蛋白经SDS-PAGE电泳后,进行电转印。转印结束,分别用VSV-IND、VSV-NJ中和抗体阳性血清以及HRP标记的蛋白G进行Western-blot检测。
1.10 重组间接ELISA方法的建立 将纯化的VSV-IND和VSV-NJ重组蛋白等量混合后,按照ELISA方法建立的常规程序,对方法建立过程中的各个条件进行了优化和确定。
1.11 间接ELISA方法特异性试验 以最适浓度等量混合的抗原包被酶标板,分别对VSV-IND阳性血清、VSV-NJ阳性血清、东部马脑脊髓炎阳性血清、西部马脑脊髓炎阳性血清、委内瑞拉马脑脊髓炎阳性血清以及马西尼罗病毒阳性血清作1∶100稀释,作ELISA测定,验证该方法的特异性。
1.12 板内和板间重复性试验 用重组蛋白包被ELISA板,对2份阳性血清和2份阴性血清样品进行检测,重复4孔,进行板内重复性试验;用重组蛋白分别包被4块反应板,分别对2份阳性血清和2份阴性血清进行板间重复性试验。
1.13 对已知中和效价抗血清的检测 对中和效价均为1∶64的VSV-IND和VSV-NJ阳性血清从1∶4开始作2倍系列稀释至1∶64,用建立的方法作ELISA检测,用OD值对稀释度对数进行线性回归。
1.14 对临床样品的检测 用建立的间接ELISA方法检测了VSV阴性马血清样品184份和已知中和抗体效价的VSV-IND和VSV-NJ阳性血清各2份。
2 结果
2.1 VSV病毒两血清型截短的G蛋白基因片段扩增结果 IND型和NJ型水泡性口炎病毒截断的G蛋白基因扩增结果,电泳结果显示,PT-PCR扩增产物大小与预期结果一致,分别为657 bp和666 bp(见图1)。

2.2 IND型水疱性口炎病毒G657、NJ型水疱性口炎病毒G666原核表达载体的构建与序列测定分析 将RT-PCR产物克隆至pMD-T20载体后,通过BamHI、Hind III双酶切和T4连接酶的连接,成功将目的片段分别构建到表达载体pET-32a上,测序结果表明,插入的IND-G-657和NJ-G-666基因的重组质粒序列与GenBank中基因序列一致,方向和位置与预期结果一致。
2.3 IND型和NJ型水疱性口炎病毒截断的G蛋白的诱导表达 将重组质粒pET-32a-IND-G657和pET-32a-NJ-G666转化Rosetta宿主菌后。经摸索,确定在37℃培养至OD600达0.6左右,加入IPTG至终浓度为1 mmol/L,27℃继续培养5 h,此条件下表达量较大。结果见图2和图3,诱导后5 h,可观察到分子量约为30 kDa的重组蛋白。
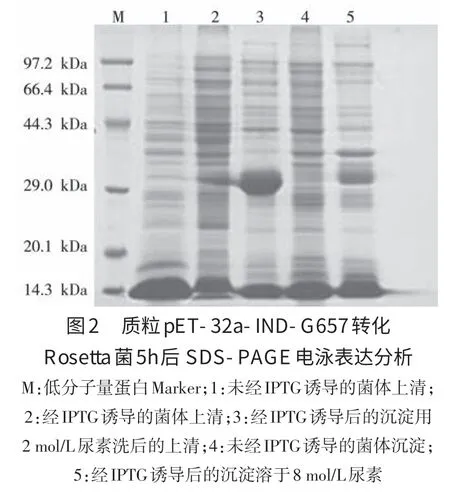
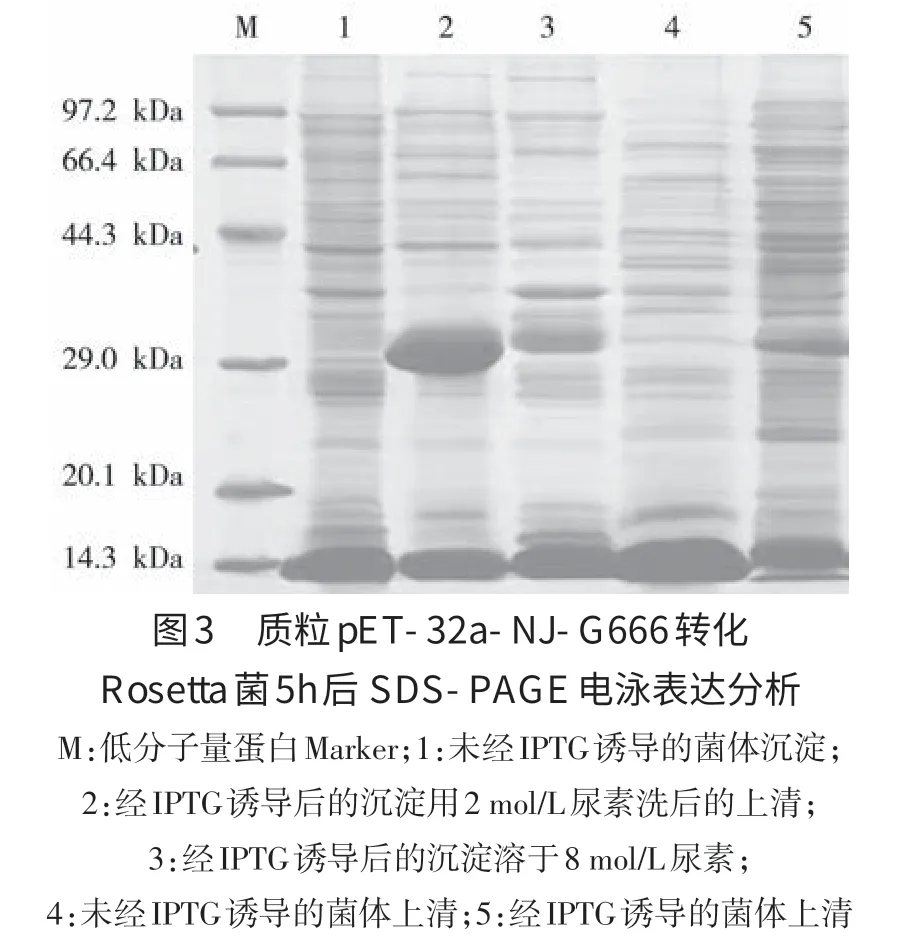
2.4 重组蛋白的表达条件优化 经研究确定的最佳表达条件为在菌液OD600nm=0.6时,用1 mmol/LIPTG在27℃诱导5 h,可产生部分可溶性表达,但大部分目的蛋白为包涵体表达,但极易溶于2 mol/L尿素中。
2.5 重组蛋白的反应原性检测 进行Westernblot检测,可以检测到约30 kDa大小的预期条带,结果见图4。表明重组蛋白具有良好的反应原性。2.6 重组ELISA方法的建立 经对ELISA建立过程中的各个条件进行优化结果如下:抗原最佳包被浓度为0.24 μg,血清最佳稀释度为1∶100时;最佳包被条件为37℃作用2 h,然后4℃过夜;最佳封闭液为含1%卵清蛋白的PBST。
经对30份VSV阴性血清进行测定,确定样本临界值为0.3。
2.7 特异性交叉反应试验 结果表明,除VSV IND型和NJ型阳性血清结果为阳性外,其他病毒血清和阴性对照血清的OD450nm值均小于0.3,为阴性。
2.8 重复性试验 对于4份血清样品,板内重复试验变异系数最大为3.24%,小于5%;板间重复试验的变异系数最大为9.84%,小于10%。
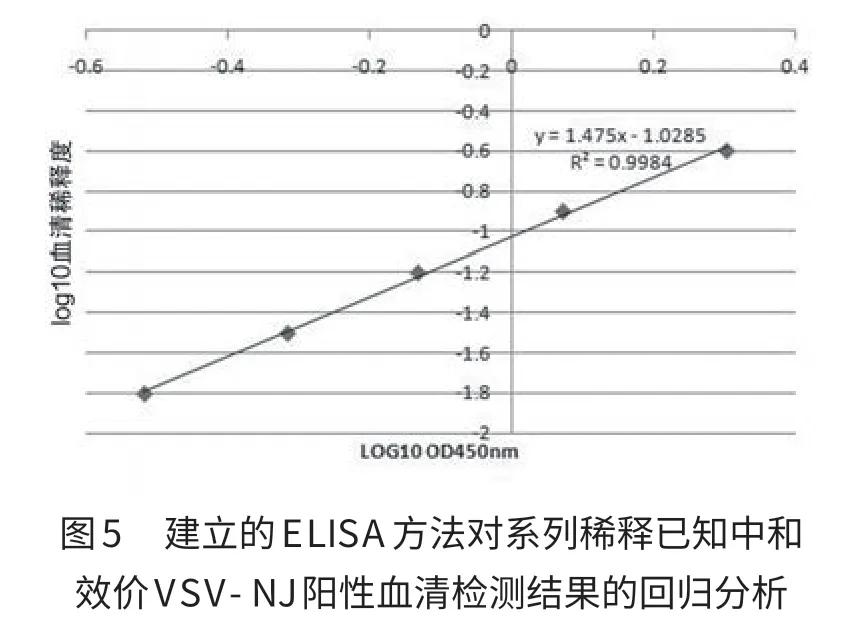
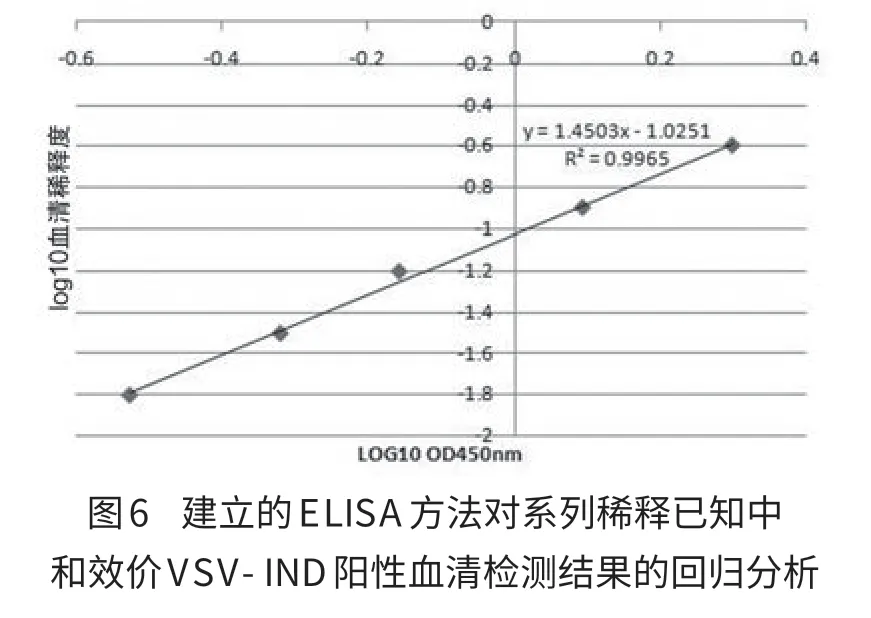
2.9 对已知中和效价抗血清的检测 线性回归结果见图5和图6。已知中和抗体效价的血清稀释度的对数与OD450的平均值的对数呈线性相关,R2分别为0.996和0.998,进一步说明建立的方法可用于VSV中和抗体的检测。
2.10 对临床样品的检测 用建立的间接ELISA方法和中和试验方法检测了VSV阴性马血清样品184份和已知中和抗体效价的VSV-IND阳性血清和VSV-NJ阳性血清各2份,其检测结果一致。
3 结论与讨论
在本研究中,用分子生物学软件分析水疱性口炎病毒印第安那型(IND型)和新泽西型(NJ型)G蛋白抗原表位分布,在抗原表位较密集的区域设计引物,采用RT-PCR方法分别扩增水疱性口炎病毒IND型657 bp G蛋白基因片段和NJ型666 bp G蛋白基因片段,并将其克隆到pET-32a表达载体。对表达蛋白进行纯化及Western-blot检测验证正确后,将2个血清型的重组G蛋白等量混合作为检测抗原包被酶标板,建立了可检测IND型和新泽西NJ型水疱性口炎病毒抗体的间接ELISA方法。
ELISA方法具有特异、敏感、重复性好以及易于操作等优点,已经广泛用于多种动物传染病的检测。本研究利用原核表达的重组蛋白建立了同时检测水疱性口炎病毒IND型和NJ型两种血清型抗体的间接ELISA方法,并通过试验表明,重组蛋白与VSV IND型和NJ型两种血清特异性反应均良好,可以用于水疱性口炎病毒的IND型和NJ型的检测。进一步收集更多数量的血清对我们的方法进行验证和完善,将是我们今后的重要任务。
[1]殷震,刘景华.动物病毒学[M].北京:科学出版社,1997.
[2]周学章,高丰,赵文斌.动物水泡性口炎病毒的抗原性[J].黑龙江八一农垦大学学报,2003,15(2):68-72
[3]Schmidtmanm E T,Tabachnick W J.Epizootic of vesicular stomatitis in the western united states[J].J Med Entoma,1999,36(1):71 991-71 995.

