舒芬太尼对体外循环大鼠脑损伤的保护作用*
张 鲲 李 曼 王力甚 董爱萍 王 蓉 沈述威
体外循环(CPB)期间脑血管微栓子(脱落的主动脉粥样斑块、气栓和组织碎屑)、脑氧代谢异常及炎性因子大量释放,可造成脑损伤,引起术后一系列神经、精神并发症[1]。认知功能障碍为CPB围术期主要并发症,其发生与脑损伤有关[2]。神经组织蛋白S100β血清水平和脑组织含水量两项指标能较客观反映脑损伤严重程度[3];脑组织“钙超载”也是脑损伤的机制之一[4]。舒芬太尼是一种新型μ阿片受体激动剂,主要作为CPB心脏手术麻醉药物;但近年有研究认为舒芬太尼对大脑缺血缺氧损伤具有保护作用[5]。本研究通过大鼠CPB时给予舒芬太尼,检测大鼠脑组织含水量、总钙含量和血清S100β水平变化,观察舒芬太尼对CPB大鼠脑损伤的保护作用。
1 材料与方法
1.1 实验动物和药品
健康成年雄性SD大鼠(长江大学医学院动物实验中心提供)24只,体重400±20g,动物的使用符合实验动物保护条例。药物:枸橼酸钠舒芬太尼注射液(湖北宜昌人福药业有限责任公司,批号12101934)。 试 剂:S100β-ELISA 试 剂 盒 由 美 国GBD公司原装进口。
1.2 动物分组处理
实验大鼠随机分为4组:假CPB组(Sham组)、CPB组、1μg/Kg舒芬太尼组(S1组)和5μg/Kg舒芬太尼组(S5组)。CPB组按下述方法麻醉和建立CPB;Sham组除不行CPB外,其它操作与CPB组完全相同;S1组和S5组于麻醉后在转流管道中分别给予负荷剂量的舒芬太尼1μg/Kg和5μg/Kg,给药后立即开始CPB,CPB开始后维持剂量90μg/Kg·min和300μg/Kg·min,直到CPB后1h,CPB时间1.5h;其CPB操作亦与CPB组完全相同。
1.3 麻醉方法
给予舒芬太尼前:0.02mg/Kg阿托品肌肉注射;舒芬太尼使用时:异氟醚吸入,初始浓度4%-6%,吸入2min后改为维持浓度2%,同时腹腔注射维库溴铵,用量0.1mg/Kg;舒芬太尼使用后:机械通气频率60次/min,气道峰压9.0cmH2O。
1.4 CPB建立
大鼠CPB的建立参照 Wang等[6]的方法修正(图1):(1)采用22G套管针行右侧股动脉穿刺,在肝素化状态下(肝素用量500μ/Kg)监测动脉压及动脉血气;(2)采用20G套管针行尾动脉穿刺,建立CPB灌注端;(3)采用14G套管针行右颈静脉插入,达右心房-下腔静脉交界处,建立CPB流出端。
CPB环路主要包括贮血器,恒流蠕动泵(Cole-Parmer Insturment Co,USA)和大鼠微型膜氧合器(上海复旦生物材料有限公司)以及连接管道等。CPB无血预充液由乳酸林格液12ml、6%羟乙基淀粉7ml及甘露醇1ml组成。CPB期间,应用适量1∶1晶胶液加入贮血器维持血液量2ml-3ml。
CPB开始灌注量100ml/Kg·min,5min后160ml/Kg·min,维持到CPB结束,氧流量保持0.2-0.5L/min。CPB建立后立即降温,经变温室10℃循环水使直肠温度降至28℃-30℃;CPB结束前20min,经变温室复温至直肠温36℃-37℃。总转流时间1.5h。CPB时用异氟醚(2%)输注以维持麻醉深度。停CPB后,维持呼吸和循环稳定1h。各组大鼠均顺利完成实验过程。
1.5 测定指标和方法
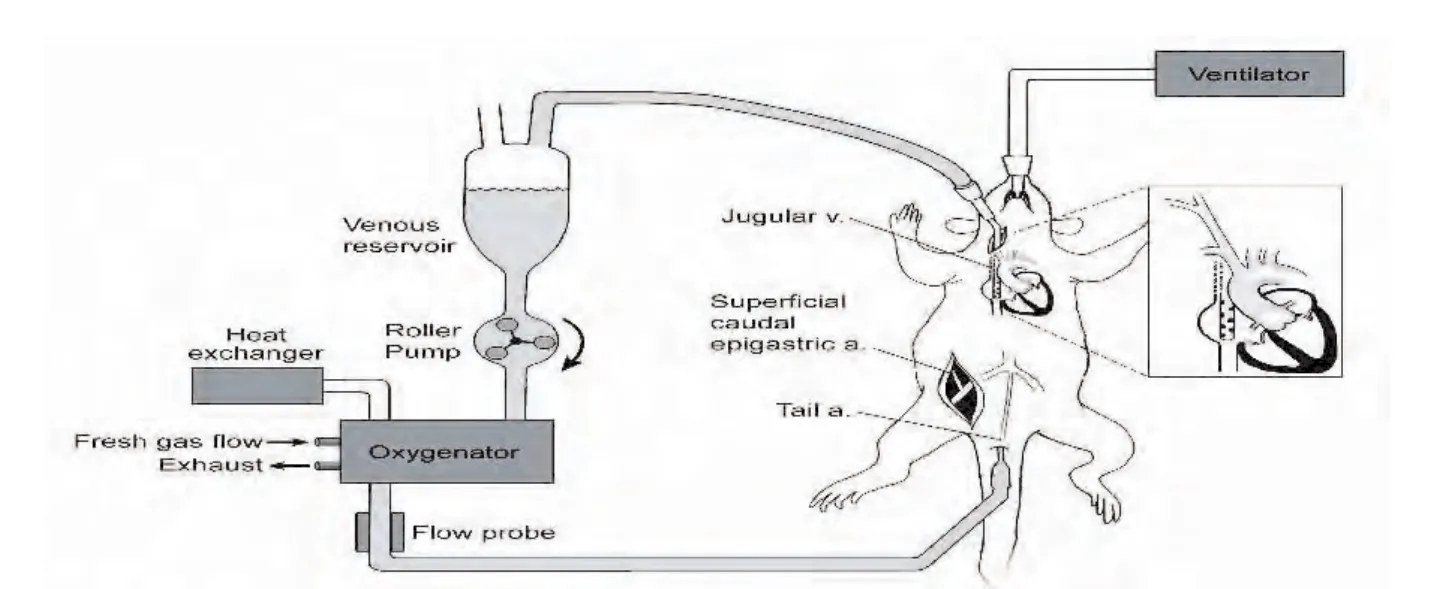
图1 大鼠CPB示意图
1.5.1 脑组织含水量:处死大鼠后,迅速取出右侧大脑,吸水纸吸干表面水分及血液,称取湿重;之后将脑组织置于恒温干燥箱(60℃),烘烤72h,称取干重;计算脑组织含水量(%)=[(湿重-干重)/湿重]×100%。
1.5.2 脑组织总钙含量:处死大鼠后,迅速取出左侧大脑,置于含混合酸(硝酸∶高氯酸=4∶1)4ml、以三蒸水定容至7ml溶液中;采用电感耦合等离子发射光谱仪(GT-2000,上海宏达公司)进行脑组织总钙含量测定。
1.5.3 血清S100β水平:CPB后1h抽取大鼠颈静脉血约1ml,室温静置20min后4 000r/min离心10min;取上层血清,按照S100β-ELISA试剂盒说明书操作。
1.6 统计学处理
采用SPSS 11.5统计分析软件。计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,两两比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
CPB组脑组织含水量、总钙含量和血清S100β水平明显高于Sham组(P<0.05);S1、S5组明显低于CPB组(P<0.05);S1组低于S5组,尤以脑组织含水量降低更明显(P<0.05)。见表1。
表1 4组大鼠脑组织含水量、总钙含量和血清S100β水平(±s,n均=6)

表1 4组大鼠脑组织含水量、总钙含量和血清S100β水平(±s,n均=6)
注:与Sham组比较,1)P<0.05;与CPB组比较,2)P<0.05;与S5组比较,3)P<0.05
?
3 讨 论
CPB心脏手术后认知功能障碍发病率高达15%-30%[7],其发生机制与CPB可部分引起大脑缺血缺氧和神经元损伤有关[8]。有研究显示脑缺血和缺血再灌注损伤机制与细胞内钙超载有密切关系[9,10],其组织形态学变化有脑水肿,其严重程度表现在脑组织含水量的增加。本实验结果表明:CPB组脑组织含水量即明显高于Sham组,经舒芬太尼处理的S1、S5组则明显低于CPB组,尤其小剂量舒芬太尼S1组降低脑水肿作用更强。脑组织总钙含量能间接反映细胞内钙水平,CPB可引起总钙含量升高。本文CPB组的脑组织总钙含量即明显高于Sham组,表明脑组织总钙含量与脑损伤有关;而不同剂量舒芬太尼处理组脑组织总钙含量明显低于CPB组,证明舒芬太尼能够有效减轻脑组织总钙含量,从而减轻脑损伤。S100β是神经组织蛋白之一,主要由活化的星型胶质细胞产生。生理剂量的S100β主要是营养胶质细胞、促进神经元轴突生长;并借助突触递质的传递来实现信息传递,通过调节细胞膜上的Ca2+浓度,同时与游离Ca2+结合形成结合钙。高浓度的S100β可诱导神经细胞凋亡[11],CPB后血清S100β蛋白水平显著升高与认知功能降低有关。目前,大多数学者[12]认为,脑损伤导致神经元和神经胶质细胞受损,使可溶性S100β进入脑脊液,进而经受损血脑屏障进入血液;敏感地反映脑组织、血脑屏障损害程度及范围。本实验结果显示CPB组血清S100β显著高于Sham组,经舒芬太尼处理的两组CPB大鼠,其血清S100β水平明显低于未经舒芬太尼处理CPB组,提示舒芬太尼可有效减轻CBP后脑组织损伤,并以较小剂量的S1组(1μg/Kg)效果更明显。进一步证实小剂量舒芬太尼对脑组织的保护作用更好。
综上所述,CPB心脏手术时使用舒芬太尼可以减轻脑损伤,实现脑功能保护,且以较低剂量为宜。
1 Hennig AK,Peng GH,Chen S.Transcription coactivators p300and CBP are necessary for photoreceptor-specific chromatin organization and gene expression[J].PLoS One,2013,8(2):e69721.
2 Arrowsmith JE,Grocott HP,Reves JG,et al.Central nervous system complications of cardiac surgery [J].Br J Anaesth,2000,84(5):304-307.
3 Rasmussen LS,Christiansen M,Eliasen K,et al.Biochemical markers for brain damage after cardiac surgery-time profile and correlation with cognitive dysfunction[J].Acta Anaesthe-siologica Scandinavica,2002,46(8):547-551.
4 Motiani P,Chaudhary S,Bahl N,et al.Intrathecal sufentanil versus fentanyl for lower limb surgeries-a randomized controlled trial[J].J Anaesth Clin Pharmacol,2010,26(4):507-513.
5 Sobrado M,Lopez MG,Carceller F,et al.Combined nimodipine and citicoline reduce infarct size,attenuate apoptosis and increase bcl-2expression after focal cerebral ischemia [J].Neuroscience,2003,118(12):107-113.
6 Wang M,Meng J,Wei H.Effects of sufentanil preconditioning on total calcium of brain tissue and S100βprotein in rats with cerebral ischemia-reperfusion[J].Journal of Ningxia Medical University,2011,33(11):1 023-1 025.
7 Cuvas O,Basar H,Yeygel A,et al.Spinal anesthesia for transurethral resection operations:Levobupivacaine with or without fentanyl[J].Middle East J Anesthesiol,2010,20(4):547-552.
8 Wainwright MS,Craft JM,Griffin WS,et al.Increased susceptibility of S-100βtransgenic mice to perinatal hypoxia-ischemia[J].Ann Neurol,2004,56(10):61-67.
9 Bedford DC,Kasper LH,Fukuyama T,et al.Target gene context influences the transcript-tional requirement for the KAT3family of CBP and p300histone acetyltrans-ferases[J].Epigenetics,2010,5(10):9-15.
10 Li XM,Yang JM,Hu DH,et al.Contribution of downregulation of L-type calcium currents to delayed neuronal death in rat hippocampus after global cerebral ischemia and reperfusion[J].Neurosic,2007,27(11):5 249-5 259.
11 Erdil F,Bulut S,Demirbilek S,et al.The effects of intrathecal levobupivacaine and bupivacaine in the elderly[J].Anaesthesia,2009,64(5):942-946.
12 Thorngren-Jerneck K,Ailing C,Herbst A,et a1.S-100βproteinin serum as a prognostic marker for cerebral injury in term newborn infants with hypoxic ischemic encephalopathy[J].Pediatr Res,2004,55(1):406-412.

