硫酸法生产碳酸锂流程中的杂质行为
陈悦娣
(新疆昊鑫锂盐开发有限公司 乌鲁木齐 830006)
1 前言
碳酸锂作为基础锂盐产品,主要用于制取各种锂的化合物、金属锂及其同位素,还用于制备化学反应的催化剂。半导体、陶瓷、电视、医药和原子能工业也有应用。
随着科学技术的不断发展,锂离子电池以其特有的性能优势在便携式电器如手提电脑、摄像机、移动通讯中得到普遍应用。电池级碳酸锂作为加工生产锂电池材料的基础原料,其市场需求量不断增大,品质要求也较工业级产品有了很大提高,特别对产品中钠、硫酸根、铁等对电池电化学性能有较大影响的杂质要求更加严格。另外,随着中央空调业的发展,用于生产制冷剂的碳酸锂用量也随着增大,制冷剂行业对碳酸锂产品中的杂质镁提出了特殊要求。
灵活控制碳酸锂产品中的杂质含量是锂盐生产企业一直追求的目标。本文通过对硫酸法生产碳酸锂流程中杂质的来源、行为、控制手段进行分析和讨论,找出了控制杂质含量的有效措施,使产品能够满足不同的市场需求。
2 杂质的来源
2.1 硫酸法生产碳酸锂工艺流程

图1 硫酸法生产碳酸锂工艺流程
2.2 可溶性杂质的来源
对于碳酸锂产品而言,影响其产品性能的可溶性杂质主要是钠离子和硫酸根。
钠离子主要来源于沉锂时加入的纯碱,锂精矿带入的钠离子可忽略不计;
硫酸根主要由酸化焙烧时加入的硫酸带入。
2.3 不溶性杂质的来源
碳酸锂流程中的不溶性杂质主要包括:镁、钙、铁、铝的化合物,不溶性杂质的主要来源:锂辉石矿、纯碱等。
锂辉石带入的不溶性杂质,通过一系列化学及物理过程,大部分进入了浸出渣及钙渣,少量进入了硫酸锂溶液。
纯碱配制成溶液时,纯碱中所含的不溶性杂质大部分以氢氧化物或碳酸盐形式存在,采用过滤的办法将其分离到碱渣中,只有极少量的不溶性杂质进入纯碱溶液。硫酸锂溶液和纯碱液进行沉锂反应:
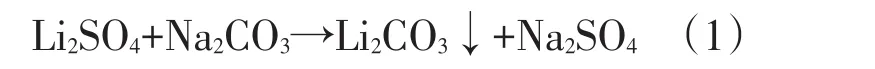
硫酸锂溶液和碱液中残存的极少量不溶性杂质以氢氧化物或碳酸盐形式进入碳酸锂产品中。
3 杂质的存在形态
3.1 可溶性杂质
经过处理得到的硫酸锂溶液中Li2O浓度60g/L、浓度120g/L,硫酸锂溶液中的Na+相对纯碱溶液来说可忽略不计。纯碱溶液的浓度为300g/L;折算成Na+浓度为130g/L。
3.2 不溶性杂质
(1)纯碱带入的不溶性杂质的存在形态及反应机理,纯碱的水解反应:

由H2CO3在25 ℃时的离解常数Ka1=4.2×10-7,Ka2=5.6×10-11[1],可求得CO3=的水解常数:
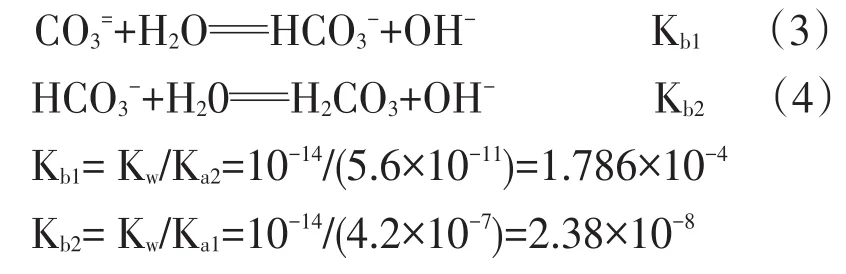
可见Kb1≫ Kb2,因此,反应(4)可忽略不计。

浓度为300g/L纯碱溶液中:

纯碱水解得到:

即碱液pH为12.35,此时纯碱溶液中不溶性杂质的反应机理:

溶液中残留的杂质浓度分别为:

可见,碱液里的不溶性杂质以氢氧化物沉淀形式存在,溶液中离子形态的不溶性杂质可忽略不计。
(2)锂辉石精矿带入的不溶性杂质的存在形态:锂辉石精矿带入的不溶性杂质,大部分可随浸出渣丢弃,得到的硫酸锂溶液中Ca2+、Mg2+浓度分别为0.9g/L、0.4g/L左右,此溶液在沉锂前须进行碱化除钙操作。
首先,硫酸锂溶液中加入适量烧碱,将pH调整到≥11,此时,镁、铝、铁离子基本形成氢氧化物沉淀,残留在溶液中离子态不溶性杂质可忽略不计。

其次,碱化后的硫酸锂溶液中加入适量的纯碱液,钙离子形成碳酸钙沉淀:
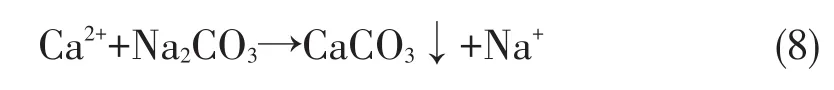
可见,经过碱化除钙操作的硫酸锂溶液中不溶性杂质以氢氧化物或碳酸盐的形式沉淀出来,进入液相的杂质极其微少。
4 杂质的控制
4.1 不溶性杂质的控制
不溶性杂质在碱液中形成的氢氧化物沉淀,可采取过滤的办法从碱液中分离出来被丢弃,称为碱渣。
硫酸锂溶液进行碱化除钙操作后,形成的不溶性杂质的氢氧化物或碳酸盐沉淀须从溶液中分离出去。
由于形成的氢氧化物沉淀为胶体物质,当过滤压强差增大时,颗粒间的孔道可能变窄,有时也会因为颗粒过于细密而将通道堵塞,在实际操作中表现为滤布发粘,过滤速度慢或者跑混等现象,分离效果不好。
如果采用沉降的办法,则过程满足以下方程:
在Mg(OH)2沉降过程中,颗粒的自由沉降速度计算公式【3】为:

由此,推出了三个沉降速度公式[3]:
滞流区:ut=d(2ρs-ρ)g/18μ(斯托克斯公式)
由于Mg(OH)2沉淀颗粒密度ρs=2.36~2.40kg/m3[2],较溶液密度ρ=1.0~1.1kg/m3大,上述公式可以看出,采用沉降分离的办法较过滤分离更适用于氢氧化物沉淀的分离。
对于过程形成的碳酸盐也可采取过滤的方式进行液固分离。
经过碱化除钙操作,得到的净化液中Ca2+、Mg2+浓度分别小于0.035g/L和0.0004g/L,完全可以满足生产低钙、低镁产品的需要。
4.2 可溶性杂质的控制
碳酸锂的溶解度较小,100℃温度下,100g水可溶解碳酸锂0.72g,可采取热水洗涤的方式降低产品中钠、硫酸根等可溶性杂质的含量(但对于沉锂过程已经形成包晶的可溶性杂质将无法除去)。
假设沉锂过程没有包晶现象产生,湿碳酸锂的附着水质量百分比为12%,则1000kg湿碳酸锂中含附着水120kg,干产品880kg,用附液理论可计算出产品中钠和硫酸根的含量:
一次沉锂得到的湿碳酸锂:沉锂母液中钠、硫酸根浓度分别为60g/L、120g/L,则附液(假设比重为1kg/L)带入的钠和硫酸根的量分别为7.2kg、14.4 kg,它们在880kg产品中所占的比例为0.82%和1.63%,不能满足标准的要求。
搅洗加淋洗得到的湿碳酸锂:最终淋洗母液中钠、硫酸根浓度分别为1.5g/L、3.0g/L,用附液理论可计算出产品中的钠和硫酸根的含量为0.02%和0.04%,完全满足电池级碳酸锂的质量要求。
5 小结及建议
对碳酸锂生产工艺中杂质的控制能力是体现锂盐生产企业技术水平的关键指标,为了满足低钠、低硫酸根、低钙、低镁等不同质量要求的碳酸锂市场需求,锂盐生产企业必须了解不同杂质在流程中的行为,根据需要灵活控制、及时调整。
尽管碱液和硫酸锂溶液都有相应的除杂工序,建议锂盐生产企业必须严格控制采购原料的杂质含量,以减轻除杂过程的难度及成本。
硫酸锂溶液进行碱化除钙操作时,严格控制pH值≥11,才能确保不溶性杂质完全形成氢氧化物沉淀;加入适量纯碱,使钙离子以碳酸钙形式沉淀出来。对于形成的氢氧化物和碳酸盐沉淀可采取沉降和过滤相结合的方式除去。
沉锂配比会直接影响碳酸锂产品中的钠、硫酸根含量。若碱液过量太多,产品中的钠离子将超标;若硫酸锂溶液过量,产品中的硫酸根将超标。在沉锂过程中必须严格控制碱液和硫酸锂溶液的配料比例,确保产品中所含的可溶性杂质达到标准要求,建议纯碱加入量比理论需要量过量5%。
沉锂反应时,采用向碱液中加入硫酸锂溶液的加入方式(即所谓的反加入方式),防止硫酸根形成包晶无法洗去,影响碳酸锂产品质量。
向碱液中加入硫酸锂溶液时,建议采用分散多点、缓慢加入的方式,最好采用喷头方式加入,可防止包晶现象的出现。
[1]薛潮明.分析化学.地质出版社,1995.
[2]马佩璋,等.化工百科全书.11-镁、钙、铁、铝的化合物;化学工业出版社,1996.
[3]天津大学化工原理教研室.化工原理.天津科学技术出版社,1983.

