雷帕霉素减缓大鼠被动Heymann肾炎的进展*
杨凤杰, 周建华, 吕倩影, 蒲金赟, 张 瑜
膜性肾病(membranous nephropathy,MN)是原发性肾病综合征的主要病理类型之一。其临床表现轻重不一,预后差别较大,虽然部分患者可自发缓解,但近半数患者最终进展至终末期肾脏病,且停药后复发率高[1]。因此,对于MN的治疗一直存在较大争议,至今尚无十分有效的治疗方案。大鼠被动Heymann肾炎(passive Heymann nephritis,PHN)的病理变化与人类MN非常相似,被视为最经典的MN模型。近年来,来自人类和动物模型的大量研究均显示,细胞自噬与多种肾脏疾病的进展及预后密切相关,如足细胞病[2-3]、IgA 肾病[4]、糖尿病肾病[5]、自身免疫性肾脏病[6]、中毒性肾损伤[7]等。而雷帕霉素不仅是一种免疫抑制剂,同时也是一种自噬反应增强剂。因此,本研究通过观察雷帕霉素对PHN大鼠的蛋白尿水平、肾脏病理改变及足细胞病变等的影响,来证实我们提出的假说“雷帕霉素可能通过增强自噬而减缓MN进展”。
材料和方法
1 分组与大鼠PHN模型的建立
体重(180±5)g的SPF级雄性SD大鼠(北京维通利华实验动物技术有限公司),SPF级标准适应性喂养2 d。按随机数字表法分成对照组、PHN模型组和雷帕霉素治疗组,每组各8只。PHN模型组以5 mL/kg剂量静脉注射第1剂羊抗Fx1A抗体(Probetex)[8],次日再以 3 mL/kg剂量静脉注射第 2剂Fx1A抗体加强免疫,对照组同期注射等量生理盐水。雷帕霉素组是在PHN模型基础上,腹腔注射1 mg/kg的雷帕霉素(LC Laboratories),连续注射21 d,对照组和PHN组则同期注射等量生理盐水。
2 主要方法
2.1 尿蛋白、血尿素氮(blood urea nitrogen,BUN)和血清肌酐(serum creatinine,SCr)检测以及肾组织病理分析 于观察结点前1 d收集大鼠24 h尿液,测定24 h尿蛋白。于观察结点当天处死动物,留取血样,测定BUN和SCr。留取肾组织做病理形态学观察[过碘酸-六次甲基四胺银(periodic acid-silver methenamine,PASM)染色]。
2.2 组织免疫荧光染色 冰冻切片室温晾干15 min,PBS 浸洗 10 min,10%山羊血清封闭 60 min,吸干封闭液,滴加小鼠抗大鼠C5b-9单抗(Santa Cruz)4℃孵育过夜,PBS洗片3次,滴加FITC标记的羊抗小鼠IgGⅡ抗(武汉博士德生物公司)37℃孵育60 min,PBS洗片3次,封片后荧光显微镜下观察、摄像。
2.3 肾小球足细胞计数 由于肾小球内仅足细胞核有WT1的表达,本文采用免疫组织化学方法(En-Vision二步法)对大鼠足细胞进行特异性染色。石蜡切片脱蜡至水,于柠檬酸盐缓冲液(pH 6.0)中进行微波抗原修复处理,室温自然冷却,PBS洗片,滴加3%H2O2室温孵育10 min,PBS洗片,正常羊血清37℃封闭1 h,滴加抗WT1多克隆抗体(Bioworld)4℃孵育过夜,次日37℃复温1 h,PBS洗片,滴加EnVision酶标抗兔/鼠聚合物,37℃孵育30 min,PBS洗片,DAB显色,苏木素复染,脱水透明后中性树脂封片,观察。以PBS取代Ⅰ抗作为阴性对照。采用HPIAS-1000彩色病理图文分析软件在Olympus BX60显微镜高倍视野下采集图像,每只大鼠选取10个以上非重复非硬化的肾小球,参照文献[9-10]采用Weibel-Gomez方法,进行图像处理分析,并计数单个肾小球体积(V,×10-3mm3)、足细胞相对密度(Nv,×103mm-3)及单位肾小球足细胞绝对数目(Npodo)。每只大鼠检测≥10个非重复非硬化的肾小球,并取其平均值。
2.4 免疫组织化学染色 采用EnVision法对大鼠肾组织切片行caspase-3特异性染色。步骤同4,Ⅰ抗为兔抗大鼠caspase-3抗体(武汉博士德生物公司)。结果判定:细胞浆或(和)细胞核呈棕黄色为caspase-3阳性反应,本研究将细胞核呈棕黄色者计为活性caspase-3阳性细胞,即凋亡细胞,见图4。高倍镜下,每只大鼠随机观察10个非重复非硬化肾小球,计算单个肾小球内活性caspase-3阳性细胞比例(阳性细胞数/有核细胞总数),取其平均值。
2.5 Western blotting检测 大鼠肾脏离体后迅速保存于液氮罐中,按文献[11]的方法分离获取肾小球,加入细胞裂解液和蛋白酶抑制剂冰上超声3 s×5次,冰上裂解30 min,而后12 000 r/min、4℃离心15 min,取上清,测蛋白浓度,热处理变性。取40 μg总蛋白经12%SDS-PAGE分离后转移至PVDF膜,5%脱脂奶粉封闭,Ⅰ抗4℃孵育过夜,TBST缓冲液洗膜,HRP标记的Ⅱ抗孵育,TBST洗膜,电化学发光法显影,通过凝胶成像系统定量分析。以GAPDH为内参照。Ⅰ抗为兔抗大鼠 LC3抗体(Cell Signaling Technology)。
3 统计学处理
数据以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析,应用SPSS 16.0统计软件处理,以P<0.05为差异有统计学意义。
结 果
1 雷帕霉素对PHN模型鼠体重、尿蛋白排泄量及肾功能的影响
如表1所示,在第21天时,雷帕霉素治疗组大鼠的平均体重明显低于对照组和PHN模型组(P<0.05),但在药物治疗期间大鼠的健康状况并未受影响,3组大鼠均无中途死亡。PHN模型组24 h尿蛋白排出量明显高于对照组(P<0.05),而雷帕霉素治疗组的尿蛋白排出量明显低于PHN模型组(P<0.05),表明雷帕霉素可减轻PHN模型鼠的蛋白尿水平。各组大鼠血清BUN和SCr无显著差异。

表1 雷帕霉素对PHN模型鼠体重、尿蛋白排泄量及肾功能的影响Table 1.The effect of rapamycin on rat weight,proteinuria and renal functions(Mean±SD.n=8)
2 雷帕霉素对PHN模型C5b-9沉积的影响
免疫荧光染色显示,PHN模型组和雷帕霉素治疗组大鼠的肾小球内可观察到膜攻击复合物C5b-9沿基底膜呈线状沉积,2组之间没有明显差异,而对照组未见C5b-9显色,表明雷帕霉素不影响C5b-9的沉积,见图1。
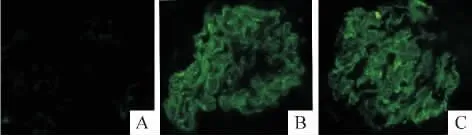
Figure 1.Effect of rapamycin on C5b-9 deposition in glomeruli of PHN rats(immunofluorescence staining,×400).A:control;B:PHN;C:PHN+rapamycin.图1 C5b-9在大鼠肾小球基底膜的沉积
3 雷帕霉素对PHN大鼠肾脏病变的影响
PASM染色显示,PHN模型组和雷帕霉素治疗组大鼠均有局灶节段性肾小球基底膜增厚,部分节段基底膜上皮侧可见钉突形成,但雷帕霉素组基底膜增厚的程度和范围较PHN模型组有所减轻;而对照组大鼠的肾小球毛细血管腔开放良好,系膜细胞及基质无明显增生,肾小球基底膜无增厚,见图2。

Figure 2. The sections of the kidneys with PASM staining(×400).A:control;B:PHN;C:PHN+rapamycin.图2 各组大鼠肾组织病理改变
4 雷帕霉素对PHN大鼠肾小球足细胞数量的影响
WT1抗原特异性表达于肾小球足细胞的胞核,肾小球内其它细胞及肾小管上皮均未见其表达,藉此标记可准确地评估肾小球足细胞数量。如图3所示,与对照组相比,PHN模型组大鼠的单位肾小球足细胞绝对数目显著下降,但单个肾小球毛细血管簇平均体积无明显改变,提示在该病理状态下存在足细胞缺失;而雷帕霉素治疗组大鼠的足细胞缺失情况较PHN模型组有所改善。

Figure 3.Podocyte number per glomerulus estimated using Weibel-Gomez methods(immunohistochemical staining for WT1,×400).Mean±SD.n=8.*P<0.05 vs control group.图3 足细胞数量的变化
5 雷帕霉素对PHN大鼠肾小球内caspase-3表达的影响
PHN模型鼠肾小球内均可见caspase-3表达,并且大多见于足细胞胞核区(即凋亡细胞),雷帕霉素治疗组大鼠的肾小球内活性caspase-3阳性细胞比例较PHN模型组明显减少,而在正常对照组,肾小球内未见caspase-3表达,见图4。

Figure 4.Immunohistochemistry for caspase-3(×400).The arrow indicates podocyte apoptosis.A:control;B:PHN;C:PHN+rapamycin.图4 肾小球内细胞凋亡的检测
6 各组大鼠肾小球内细胞自噬的检测
如图5所示,与对照组相比,PHN大鼠肾小球内自噬标志物LC3-Ⅱ表达明显增强,而雷帕霉素治疗组大鼠的LC3-Ⅱ表达水平又显著高于PHN模型组和对照组。
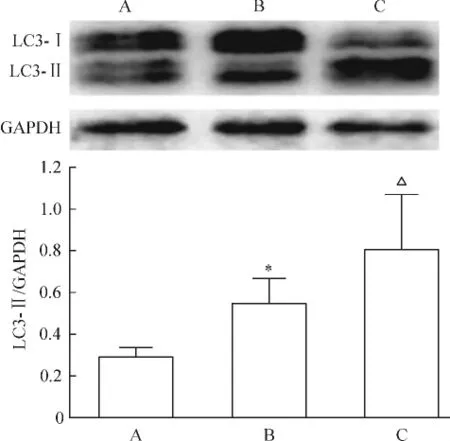
Figure 5.Western blotting for LC3 expression in the glomerulus.A:control;B:PHN;C:PHN+rapamycin.Mean±SD.n=8.*P<0.05 vs control group;△P<0.05 vs PHN group.图5 各组大鼠肾小球内细胞自噬的检测
讨 论
1963年De Duve首次提出“细胞自噬”这个生物学概念,它是广泛存在于真核细胞的一种溶酶体依赖的降解途径,主要调节细胞内长寿命蛋白和细胞器的降解,使降解产物被细胞再利用,因此,其在细胞发育、损伤修复、组织重塑及适应性应答等方面发挥着极为关键的作用。它是一个严格调控的程序性过程:首先,在胞浆中形成一个来源于粗面内质网或高尔基体的扁平双层膜结构,而后不断扩张,称之为“前自噬泡”;前自噬泡不断延伸,将胞浆中废弃组分揽入其中,而后边缘融合,形成密闭的球形双层膜结构,称之为“自噬体”;随后,在细胞骨架蛋白驱动下自噬体与溶酶体融合,形成“自噬溶酶体”,以降解其内容物及双层膜结构[12]。迄今为止,许多研究已证实自噬在足细胞病、肾脏缺血-再灌注损伤、糖尿病肾病等肾脏疾病中发挥促进细胞修复、阻止细胞凋亡等保护性作用[13]。本研究发现,PHN模型组(造模后第21天)大鼠肾小球内LC3-II的表达水平较对照组显著升高,可见,在PHN病变过程中存在肾小球固有细胞的自噬反应活化。但在此病理状态下,自噬是否发挥保护性作用仍需进一步证实。
为研究自噬在PHN病变过程中所充当的角色,我们选用雷帕霉素作为自噬增强剂对模型鼠进行干预。雷帕霉素,又名西罗莫司,是从链球菌中提取的一种大环内酯类药物,具有免疫抑制、抗肿瘤、抗真菌等作用,其作用靶点是哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)。mTOR 通路广泛存在于哺乳动物细胞的胞质内,主要功能是依据细胞的不同状态调节其增殖与分化,对细胞自噬、合成分解代谢、核糖体形成等也均有调控作用。mTOR分为mTORC1和mTORC2两条通路,前者为雷帕霉素敏感性通路,对细胞自噬有负向调控作用,后者为雷帕霉素非敏感性通路,与细胞骨架蛋白形成及延展相关。雷帕霉素与FKBP-12形成复合体后与mTORC1中的mTOR调控相关蛋白相结合,从而抑制mTORC1,诱导细胞自噬。本研究显示,造模后即给予雷帕霉素治疗,可显著缓解PHN模型鼠的蛋白尿,同时肾组织PASM染色也显示雷帕霉素组大鼠肾小球基底膜的病变较PHN模型组有所减轻。表明在PHN病变过程中,肾小球内固有细胞的自噬反应起着保护性作用,而适当增强自噬可在一定程度上缓解病变。
膜性肾病的主要病理特征为肾小球基底膜足细胞下大量免疫复合物沉积伴基底膜弥漫增厚,可见,病变主要位于肾小球毛细血管袢,而足细胞病变为其最突出表现,因此,近年来MN被认为是一种“足细胞病”。我们长期的临床病理观察也发现,所有MN患儿均存在不同程度的足细胞病变,包括足突融合、足突微绒毛化、足细胞肿胀、足细胞空泡变性、足细胞崩解等[10]。足细胞,是一种类似于神经元的多突状高度分化细胞,在体内其分裂增殖能力有限,一旦受损很难再生修复。不少研究表明足细胞损伤乃至缺失是促进肾小球硬化的重要因素之一[14-15]。本研究观察到,与正常大鼠相比,PHN模型鼠存在足细胞缺失现象,并且这种缺失与足细胞凋亡相关,而造模后即给予雷帕霉素治疗可在一定程度上改善足细胞缺失,减少凋亡。从而提示在PHN病变过程中,适当增强自噬水平可有效减少足细胞凋亡,延缓肾脏病变恶化进展。
综上所述,我们认为,在PHN的病变过程中,适当强度的自噬发挥着保护性作用。一定程度地增强自噬,减少足细胞凋亡,进而减轻肾脏病变和缓解蛋白尿,是雷帕霉素减缓大鼠PHN进展的重要机制之一。虽然PHN模型的间质损伤较人类MN明显,未必能诠释MN的整个病变过程,但其21 d以内的病程与人类MN极为类似,因此,本研究仍可提示雷帕霉素可能通过增强自噬的机制延缓膜性肾病的恶化进展。
[1] Ponticelli C.Membranous nephropathy[J].J Nephrol,2007,20(3):268-287.
[2] Asanuma K,Tanida I,Shirato I,et al.MAP-LC3,a promising autophagosomal marker,is processed during the differentiation and recovery of podocytes from PAN nephrosis[J].FASEB J,2003,17(9):1165-1167.
[3] Hartleben B,Godel M,Meyer-Schwesinger C,et al.Autophagy influences glomerular disease susceptibility and maintains podocyte homeostasis in aging mice[J].J Clin Invest,2010,120(4):1084-1096.
[4] Sato S,Yanagihara T,Ghazizadeh M,et al.Correlation of autophagy type in podocytes with histopathological diagnosis of IgA nephropathy[J].Pathobiology,2009,76(5):221-226.
[5] Wu WH,Zhang MP,Zhang F,et al.The role of programmed cell death in streptozotocin-induced early diabetic nephropathy[J].J Endocrinol Invest,2011,34(9):e296-e301.
[6] Anders HJ,Schlondorff DO.Innate immune receptors and autophagy:implications for autoimmune kidney injury[J].Kidney Int,2010,78(1):29-37.
[7] Periyasamy-Thandavan S,Jiang M,Wei Q,et al.Autophagy is cytoprotective during cisplatin injury of renal proximal tubular cells[J].Kidney Int,2008,74(5):631-640.
[8] Lindskog A,Ebefors K,Johansson ME,et al.Melanocortin 1 receptor agonists reduce proteinuria[J].J Am Soc Nephrol,2010,21(8):1290-1298.
[9] White KE,Bilous RW.Estimation of podocyte number:a comparison of methods[J].Kidney Int,2004,66(2):663-667.
[10]张 瑜,周建华,王洪涛.乙型肝炎病毒相关性膜性肾病患儿足细胞缺失的研究[J].中华儿科杂志,2007,45(5):344-348.
[11] Salant DJ,Cybulsky AV.Experimental glomerulonephritis[J].Methods Enzymol,1988,162:421-461.
[12]杜海磊,邱伟华,杨卫平.细胞自噬与肿瘤[J].中国病理生理杂志,2010,26(2):401-404.
[13]于生友,于 力.自噬与儿童肾脏疾病的研究进展[J].中华儿科杂志,2010,48(11):872-875.
[14] D′Agati VD.Podocyte injury in focal segmental glomerulosclerosis:lessons from animal models(a play in five acts)[J].Kidney Int,2008,73(4):399-406.
[15] Ziyadeh FN,Wolf G.Pathogenesis of the podocytopathy and proteinuria in diabetic glomerulopathy[J].Curr Diabetes Rev,2008,4(1):39-45.
——雷帕霉素

