IPO8基因启动子区rs35100176位点变异对基因表达的影响*
熊建军, 江 和, 许晓源, 周小鸥, 王 庭, 李卫东
Importin 8(IPO8)是在1997年发现的核质转运受体 importin β 家族成员[1]。有研究认为,IPO8 是一个在细胞内稳定表达的基因,在多种肿瘤细胞中作为内参照基因用于PCR检测[2-3],但是另一些研究显示IPO8蛋白的功能并不局限于核质转运。研究发现,IPO8与胞质内miRNA介导的基因沉默有内在联系,抑制IPO8表达导致部分miRNA靶基因的上调[4],表明IPO8的表达对于细胞具有重要的意义。前期研究中我们克隆了IPO8基因启动子,发现其转录起始点上游-386 bp存在一处CCT的3碱基插入/缺失变异(rs35100176)。本研究通过 PCR、测序、瞬时转染、双萤光素酶检测及real-time PCR技术研究IPO8基因启动子区rs35100176多态位点3碱基CCT插入/缺失对基因表达的影响。
材料和方法
1 DNA样本、试剂和材料
49例DNA样本随机取自九江学院附属医院体检血样。质粒pGL3-Basic及pRL-TK为Promega产品;real-time PCR试剂、LATaq酶、pMD18-T载体和限制性内切酶Mlu I、Bgl II等购自大连宝生物公司;基因组抽提试剂盒购自北京天为时代公司;DMEM培养基和胎牛血清购自Gibco;转染试剂Fugene 6.0及双萤光素酶报告基因检测试剂盒购自Promega;大肠杆菌 DH5α、人宫颈癌细胞HeLa、人胚胎肾细胞HEK293和人骨肉瘤细胞Saos-2均由本实验室保存;所有引物均由广州英骏生物公司合成。
2 方法
2.1 IPO8基因启动子区包含rs35100176多态位点序列的扩增 基因组DNA采用天根生物公司试剂盒提取。根据GenBank所公布的人IPO8基因序列(Gene ID:10526)设计引物,PCR扩增342 bp的启动子区域,见图 1。引物序列为 5′-ATTTGGGCTGGAAGGCAGGA-3′和 5′-TGTATGGGCATCGCAACTGG-3′。

Figure 1.The position of rs35100176 polymorphism in IPO8 promoter.图1 多态性位点rs35100176在IPO8启动子中的位置
2.2 PCR产物的测序 PCR产物由英骏生物技术公司测序,测序引物为 5′-ATTTGGGCTGGAAGGCAGGA-3′。
2.3 构建IPO8基因启动子区rs35100176位点CCT插入型和缺失型萤光素酶报告基因载体 以CCT插入纯合子的个体基因组DNA和CCT缺失纯合子的个体基因组DNA为模板,分别扩增IPO8基因启动子区域(-1 330~+134),反应参数为:95℃ 3 min;95℃15 s,55 ℃ 20 s,72 ℃ 30 s,循环30 次;72 ℃ 10 min。PCR产物分别连接入pMD-18T,测序;引物序列为5′-TTCCACGCGTTGTGGCTCGCTTCTTCAGTG-3′和 5′-AAGGAGATCTCGACCCCTGGATTACCTCAC-3′。
2.4 pGL3-3N Insertion和pGL3-3N Deletion重组表达载体的构建 用Mlu I和Bgl II双酶切获得测序正确的3N Insertion/T和3N Deletion/T序列,与萤光素酶表达载体pGL3-Basic经T4 DNA连接酶4℃过夜连接,连接产物转化DH5α感受态细菌。挑选阳性菌落过夜培养,提取质粒、酶切鉴定并测序。重组质粒命名为pGL3-3N Insertion和pGL3-3N Deletion。
2.5 细胞的瞬时转染与萤光素酶的检测 方法如文献[5]所述。转染前1 d将细胞接种于24孔板,密度为1×105,无抗生素培养基培养,至次日进行转染。转染试剂使用Fugene 6.0(操作按照说明书进行)。每种质粒转染设3个复孔,将pGL3-3N Insertion和pGL3-3N Deletion质粒各1 μg分别与内参质粒 pRL-TK 0.1 μg共转染各孔。转染24 h后吸去孔中的培养基,PBS洗涤培养孔,每孔中加入100 μL被动裂解液(passive lysis buffer,PLB),室温摇动孵育15 min,充分溶解转染细胞,吸取细胞裂解液转移至1.5 mL离心管中,13 000×g离心5 min,吸取上清液,上机检测(操作按双萤光素酶报告分析系统说明书),分别检测得到萤火虫萤光素酶Luc和海肾萤光素酶RL的活性,二者的比值即为相对萤光素酶活性。
2.6 Real-time PCR 方法如文献[6]所述。引物序列如下:IPO8 为 5′-TGTTCAGCTCCTTCCTGATTC-3′和 5′-CTTCTTACACTTCCACCATAC-3′;GAPDH 为 5′-AGAAGGCTGGGGCTCATTTG-3′和 5′-AGGGGCCATCCACAGTCTTC-3′。
3 统计学处理
数据以均数±标准差(mean±SD)表示。组间均数比较采用单因素方差分析,使用统计学软件SPSS 12.0分析,以P<0.05为差异有统计学意义。
结 果
1 IPO8基因启动子区rs35100176多态位点的测序
对49例随机取得的DNA样本进行测序分析,发现rs35100176多态位点在普通人群基因组中有3种基因型存在,分别是纯合插入CCT/CCT,纯合缺失-/-,杂合型CCT/-。同时我们还发现,在CCT多态性位点上游,还存在一个重复的CCT序列,见图2。
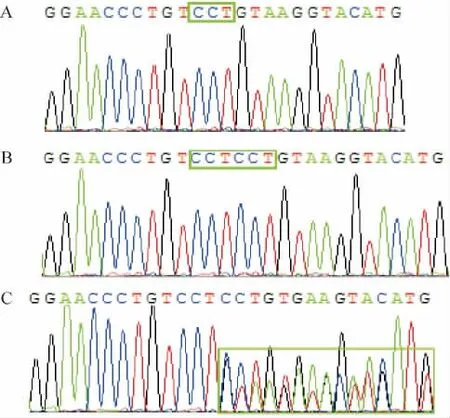
Figure 2.The sequencing results of rs35100176 polymorphism in the promoter region of IPO8 gene.A:CCT deletion homozygote;B:CCT insertion homozygote;C:CCT insertion/deletion heterozygote.图2 IPO8基因启动子区rs35100176多态位点的测序结果
2 测序样本中IPO8基因启动子区rs35100176多态位点的基因分布频率
通过对随机取得的DNA样本进行测序分析,发现在49例样本中CCT/CCT纯合型插入有9例,分布频率为18.37%,-/-纯合缺失型的有13例,分布频率为26.53%,杂合型CCT/-有27例,分布频率为55.10%。
3 pGL3-3N Insertion和pGL3-3N Deletion重组表达载体重组质粒的鉴定
Mlu I与Bgl II双酶切各IPO8启动子片段,插入质粒pGL3-Basic多克隆位点,转化DH5α,构建重组萤光素酶报告基因质粒。重组质粒经酶切鉴定,结果表明亚克隆片段与目标序列的理论序列完全一致,质粒构建正确,见图3。
4 不同质粒中萤光素酶报告基因的相对活性
双萤光素酶报告基因活性检测结果显示,在He-La和HepG2细胞中,pGL3-3N Insertion启动下游报告基因表达的相对活性与pGL3-3N Deletion相比显著减弱,两者存在显著差异(P<0.05),见图4。

Figure 3.Identification of recombinant pGL3-IPO8 promoter by restriction enzyme digestion.1:pGL3-3N Insertion digested by Mlu I and Bgl II;M:DL10000 DNA marker;2:pGL3-3N Deletion digested by Mlu I and Bgl II.图3 重组质粒pGL3-IPO8 promoter的酶切鉴定

Figure 4.The relative luciferase activity of transfected plasmids in HeLa and HepG2 cells.Mean±SD.n=6.*P<0.05 vs pGL-3N Deletion.图4 不同转染质粒中报告基因在HeLa和HepG2细胞中的相对活性
5 不同表型细胞株中IPO8 mRNA的表达
根据测序结果,选择3种不同基因型细胞株HEK293(CCT/CCT)、HeLa(CCT/-)和 Saos-2(-/-),对其中IPO8 mRNA的表达量进行检测,结果发现,与萤光素酶检测结果相对应的是,在CCT纯合插入的HEK293细胞,其IPO8 mRNA表达量显著低于CCT纯合缺失的人骨肉瘤细胞Saos-2(P<0.05),CCT杂合的HeLa细胞的IPO8 mRNA表达量则介于两者之间,见图5。
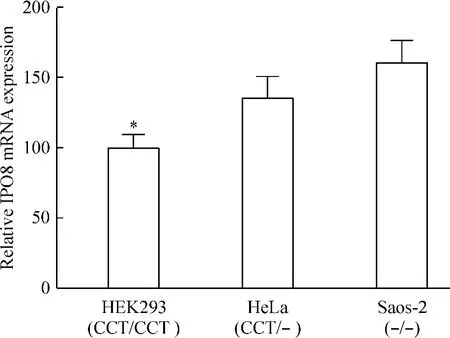
Figure 5. The relative mRNA expression of IPO8 among HEK293,HeLa,and Saos-2 cell lines and corresponding genotypes of rs35100176 polymorphisms.Mean±SD.n=6.*P<0.05 vs Saos-2.图5 rs35100176位点不同基因型细胞株中IPO8 mRNA的相对表达量
讨 论
核转运受体包括importin α和importin β 2个家族,在蛋白的主动运输过程中发挥了决定性作用。Importin α、β分别识别不同的蛋白核定位信号,介导不同类型核蛋白入核[7]。本项研究中的IPO8即是importin β家族成员之一,其基因定位于人类常染色体的12p11.21。
有研究报道,IPO8是一个稳定表达的基因,在多种肿瘤细胞中作为内参照基因用于PCR检测[2-3,8]。但是另一些研究显示IPO8的功能并不局限于核质转运。研究发现,IPO8与胞质内miRNA介导的基因沉默有内在联系,抑制IPO8表达导致部分miRNA靶基因的上调,其原因在于IPO8是argonaute(Ago)蛋白重要的调节因素[4]。Ago蛋白在所有已知的小RNA沉默通路中发挥关键作用,其选择性地与miRNA和siRNA结合,并与Dicer酶相互作用,介导靶mRNA的降解[9]。在这一过程中,IPO8蛋白与Ago蛋白相互作用是介导后者与靶miRNA结合的必经环节。这一结果说明IPO8的表达对于细胞具有重要的意义。
在研究IPO8的转录调控机制中,我们将克隆的IPO8启动子片段与PubMed公布的序列比对,发现获取的IPO8基因5′端启动子区-386 bp处存在一个CCT的插入/缺失多态性位点。通过随机抽取的49份人DNA样本测序,发现该位点的基因分布频率分别为:CCT/CCT(18.37%)、-/-(26.53%)和CCT/-(55.10%)。尽管该位点已被 PubMed的SNP库收录,编号rs35100176,但是其功能研究尚未见报道。
基因调控区的多态性不同于蛋白编码区的碱基变异,并非引起相关蛋白分子功能的改变,但却引起受调控基因表达量的改变[10]。通过双萤光素酶检测,我们发现CCT插入的IPO8启动子片段活性要明显弱于CCT缺失的片段,表明该位点在基因转录过程中起负性调控作用。进一步,我们通过分析该多态性位点两端序列,发现CCT多态性位点上游存在CCT重复序列,由此构成的重复序列可能是影响IPO8基因转录活性的原因之一。随后,我们利用real-time PCR检测3种不同基因表型细胞株中IPO8 mRNA相对表达量。与萤光素酶检测结果相对应的是,在CCT纯合插入的HEK293细胞,其IPO8 mRNA表达量显著低于CCT纯合缺失的人骨肉瘤细胞Saos-2。一系列结果表明,rs35100176位点的CCT碱基插入变异能显著抑制启动子活性,从而影响IPO8基因的转录。
早在1999年,CCTCCT序列就被发现是一个转录抑制元件,在骨细胞中,CCTCCT序列是osteocalcin基因负性调控元件[11];而在小鼠的免疫细胞,CCTCCT序列则导致IL-10转录下调,其中涉及的机制较为复杂。一些研究表明,CCTCCT是一个非典型的Sp1结合序列,Sp1与该序列结合抑制下游基因表达[12]。然而Sp1并非是CCTCCT元件唯一的反式作用因子,转录因子δEF1也被认为可以与CCTCCT结合,调控基因的转录过程[13]。但是与IPO8基因启动子区CCTCCT序列结合的反式作用因子尚不清楚。
尽管本文未能就CCTCCT元件参与调控IPO8转录的机制进行详尽揭示,但是对传统的认为IPO8是一个稳定表达的内参照基因的观点提出不同见解,认为其启动子区的多态性与基因转录密切相关,并且可能与某些疾病具有内在的联系。
[1] Gorlich D,Dabrowski M,Bischoff FR,et al.A novel class of RanGTP binding proteins[J].J Cell Biol,1997,138(1):65-80.
[2] Hurtado del Pozo C,Calvo RM,Vesperinas-Garcia G,et al.IPO8 and FBXL10:new reference genes for gene expression studies in human adipose tissue[J].Obesity(Silver Spring),2010,18(5):897-903.
[3] Kreth S,Heyn J,Grau S,et al.Identification of valid endogenous control genes for determining gene expression in human glioma[J].Neuro Oncol,2010,12(6):570-579.
[4] Weinmann L,Hock J,Ivacevic T,et al.Importin 8 is a gene silencing factor that targets argonaute proteins to distinct mRNAs[J].Cell,2009,136(3):496-507.
[5] 史雪梅,张惠兰,熊盛道,等.SPA基因启动子的克隆及转录靶向活性分析[J].中国病理生理杂志,2008,24(10):2002-2007.
[6] Xiong J,Che X,Li X,et al.Cloning and characterization of the human USP22 gene promoter[J].PLoS One,2012,7(12):e52716.
[7] Cook A,Bono F,Jinek M,et al.Structural biology of nucleocytoplasmic transport[J].Annu Rev Biochem,2007,76:647-671.
[8] Nguewa PA,Agorreta J,Blanco D,et al.Identification of importin 8(IPO8)as the most accurate reference gene for the clinicopathological analysis of lung specimens[J].BMC Mol Biol,2008,9:103.
[9] Liu J,Carmell MA,Rivas FV,et al.Argonaute2 is the catalytic engine of mammalian RNAi[J].Science,2004,305(5689):1437-1441.
[10]夏小慧,胡 扬,张腾国,等.SLC2A4基因启动子区rs5418位点变异对基因表达的影响[J].中国病理生理杂志,2012,28(12):1791-1795.
[11]Kearns AE,Goto K,Gianakakos G,et al.Transcriptional repression of the rat osteocalcin gene:role of two intronic CCTCCT motifs[J].Endocrinology,1999,140(9):4120-4126.
[12]Tone M,Tone Y,Babik JM,et al.The role of Sp1 and NF-κB in regulating CD40 gene expression[J].J Biol Chem,2002,277(11):8890-8897.
[13] Sooy K,Demay MB.Transcriptional repression of the rat osteocalcin gene by δEF1[J].Endocrinology,2002,143(9):3370-3375.

