新型Rho激酶抑制剂WAR5治疗EAE的初步研究*
丁智斌, 张 辉, 杨兴旺, 张海飞, 尉杰忠, 李艳花,刘春云, 杨婉芳, 李俊莲, 冯前进, 赵永飞, 肖保国,, 马存根,△
多发性硬化(multiple sclerosis,MS)是中枢神经系统(central nervous system,CNS)炎性脱髓鞘性自身免疫性疾病,其病理特征是CD4+T细胞介导的自身免疫攻击导致髓鞘脱失和轴突损害。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)与MS临床症状和病理过程较为相似,是目前国际公认的研究 MS的动物模型[1]。Rho/Rho激酶(Rho kinase,ROCK)信号通路是机体内普遍存在的一种信号通路,主要参与血管收缩、炎症反应、细胞凋亡等多种生命活动。近年的研究发现在神经系统炎症变性疾病如MS、阿尔兹海默病(Alzheimer disease,AD)、帕金森病(Parkinson disease,PD)及肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)等病理过程中,ROCK的异常激活发挥着重要的作用[2]。
盐酸法舒地尔(fasudil)是临床和科研上常用的ROCK抑制剂,目前已有众多研究报道 fasudil在EAE方面的疗效及作用机制[3]。但是,临床应用中发现,fasudil尽管有效,但也存在着治疗的安全窗比较小(小鼠40 mg/kg给药后出现明显的血管扩张,部分动物死亡)、给药途径单一、药物使用的持续时间不能太长等缺点,特别不易长期使用,限制其长期用于治疗MS的临床应用。因此,本研究的重点在于探索发现新型、可以有效治疗EAE的ROCK抑制剂,为后期比较不同异构体的量效学、药代动力学及药理学、毒理学实验奠定基础。本研究组筛选到一个fasudil异构体WAR5化合物,发现其可以有效地抑制EAE的起病,减轻其临床症状,减少CNS炎症细胞的浸润及抑制髓鞘的脱失,其可能的机制是诱导M1型致炎症细胞转换为M2型抗炎巨噬细胞。
材料和方法
1 动物和材料
雌性C57BL/6小鼠16只,8~10周龄,体重18~20 g,购自北京维通利华公司。小鼠髓鞘少突胶质细胞糖蛋白35-55多肽(myelin oligodendrocyte glycoprotein 35 -55 peptide,MOG35-55)由西安联美生物科技有限公司合成;百日咳毒素(pertussis toxin,PTX)购自Alexis;完全弗氏佐剂(complete Freund’s adjuvant,CFA)购自 Sigma;结核分枝杆菌(Tuberculosis bacili,TB)购自Becton Dickinson(BD);流式细胞仪为BD FACS Calibur产品。Flour-488-F4/80、PE-CD16/32和PE-CD206抗体等购自BD。凝胶成像分析仪购自Bio-Rad;BCA蛋白定量试剂盒购自碧云天生物技术有限公司;ECL化学发光试剂盒购自Millipore;WAR5化合物由天津红日药业股份有限公司馈赠。
2 方法
2.1 动物分组、模型制备及给药处理 C57BL/6雌性小鼠实验前在无特殊病原菌实验室经正常喂养1周后,按平均体重随机均分为EAE组(n=8)和WAR5组(n=8)。将 MOG35-55肽段4 mg溶于0.8 mL生理盐水中,4.8 mg TB溶于0.8 mL完全弗氏佐剂;采用针管混合器将等体积2种溶液体充分混合为油包水样乳白色混悬液,乳剂静置后无分层即为合格。乙醚麻醉小鼠后,按每只0.1 mL给予各组小鼠脊柱背侧中线两侧,分4点皮下注射。在免疫当天和48 h后,各组小鼠分别腹腔注射百日咳毒素每只每次750 ng。
WAR5组于免疫后第3天起隔天腹腔注射WAR5化合物(40 mg/kg)。EAE组以等量的生理盐水腹腔注射作为对照。各组腹腔注射持续至免疫后第27天。临床评分采用国际通用的5分评分制进行:无任何临床症状计为0分;尾部张力消失,可见轻度步态笨拙计为1分;一侧后下肢无力,被动翻身后可以恢复计为2分;双后肢瘫痪,被动翻身后不能恢复,但给予刺激后可以挪动计为3分;双侧后肢瘫痪伴前肢瘫痪计为4分;濒死状态或死亡计为5分。症状介于两个标准之间者以±0.5分计。累积临床评分[4]为每组每只小鼠自发病当天起(疾病评分≥1)至实验结束评分的总和。
2.2 标本采集 免疫后28 d,采用0.3%戊巴比妥钠每只0.2 mL腹腔麻醉后取脾脏,制备成单个核细胞悬液。同时,动物用生理盐水心脏灌注,各组50%动物(4只)快速冰上解剖脑和脊髓组织,匀浆后提取蛋白,定量后采用Western blotting技术检测诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS);各组其余50%动物(4只)用4%多聚甲醛灌流进行体内组织固定,然后分离脊髓,OCT(optimum cutting temperature)包埋剂包埋,于液氮中冷冻,做厚度为10 μm的冰冻切片,进行髓鞘和HE染色。2.3 HE染色 将脊髓冰冻切片水中浸泡2 min,苏木精染色4 min,快速水洗,0.5%盐酸乙醇分化15 s,0.5%伊红30 s,快速水洗,梯度乙醇脱水各2 min,二甲苯透明2次,各5 min,中性树胶封片,光镜下观察炎症细胞浸润情况。
2.4 髓鞘染色 取冰冻切片于70%乙醇中浸泡15 min,浸于固蓝液中,57℃孵育24 h,于95%乙醇溶液浸洗10 min,去离子水浸洗5 min,0.05%碳酸锂快速浸洗10 s,70%乙醇分化至灰质与白质能够清晰辨别,去离子水浸洗5 min,梯度乙醇脱水各2 min,二甲苯透明2次,各5 min,中性树胶封片,光镜下观察髓鞘脱失情况。
2.5 流式细胞术检测 小鼠脾细胞悬于50 μL 0.1%皂苷(saponin)/1%BSA-PBS破膜剂或1%BSA-PBS 缓冲液中,分别加 1 μL Flour-488-F4/80、PE-CD16/32和 PE-CD206抗体,室温避光20 min。PBS洗2次各加500 μL PBS,流式细胞术检测。
2.6 Western blotting 称量脑和脊髓组织后置玻璃匀浆管,用组织裂解液在4℃条件下抽提组织蛋白。按需配制适量BCA工作液(试剂A与试剂B按体积50∶1,充分混匀)。用BAS标准蛋白作曲线,通过标准曲线回归公式,计算待测样品的蛋白浓度。然后置-80℃保存,应避免反复冻融。取定量蛋白样品(约30 μg)与等体积的 Laemnli上样缓冲液混匀,100℃水浴5 min,用10%SDS-PAGE不连续凝胶电泳分离蛋白。电泳完毕后,用转移缓冲液平衡凝胶和硝酸纤维膜15~30 min,40 V室温湿式电转移2 h。膜置于5%脱脂牛奶封闭液,摇床上缓慢摇动,室温封闭1 h。用5%脱脂牛奶分别稀释抗 iNOS(1∶500)和抗 GAPDH(1∶50 000),分别加至膜上,4℃孵育过夜。次日1∶1 000稀释相应荧光偶联的抗兔Ⅱ抗,室温孵育45 min。洗膜后使用Bio-Rad凝胶成像分析仪检测染色条带强度,以检测蛋白条带吸光度与内参照GAPDH的吸光度比值表示。
3 统计学处理
数据用均数±标准差(mean±SD)来表示,采用GraphPad Prism 5.0统计软件处理。组间比较采用单因素方差分析,两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
结 果
1 WAR5化合物推迟EAE起病时间和严重程度
EAE小鼠从免疫后第8天开始相继发病。首先出现精神萎靡、皮毛不滑、食欲及体重下降、尾部及四肢肌力下降甚至消失,临床评分最高可达4.5分。EAE对照组8只小鼠全部发病(100%),没有死亡,平均起病时间为(12.17±2.40)d,平均最高评分为2.83±1.25,累计临床评分为31.50±15.32;WAR5组小鼠平均起病时间为(16.33±2.08)d(P<0.05),平均最高临床评分为 0.13±0.25(P<0.01),WAR5组累计临床评分为0.25±0.5,见图1。WAR5组在推迟起病时间和减轻临床症状的同时减少体重的减轻,与EAE组比较P<0.01,见图1。

Figure 1.WAR5 delayed the onset of EAE and attenuated the severity of EAE.Mean±SD.n=8.*P <0.05,**P <0.01 vs WAR5.图1 临床评分和体重变化的比较
2 WAR5化合物减少CNS炎症细胞浸润和髓鞘脱失
HE染色显示临床症状较重的EAE对照小鼠脊髓呈现大量炎症细胞浸润,尤以腰膨大处炎症细胞浸润更为明显,HE染色统计结果显示EAE对照组脊髓白质区炎症浸润细胞计数为480.00±96.39,WAR5组为64.00±45.22,2组差异有统计学意义(P<0.05),见图2A。髓鞘染色显示EAE对照组脊髓白质出现大量髓鞘脱失,而WAR5组则有效抑制髓鞘的脱失。EAE对照组髓鞘脱失与白质面积比值为(20.43±4.55)%,WAR5组为(2.10±1.32)%,2组比较差异有统计学意义(P<0.05),见图2B。
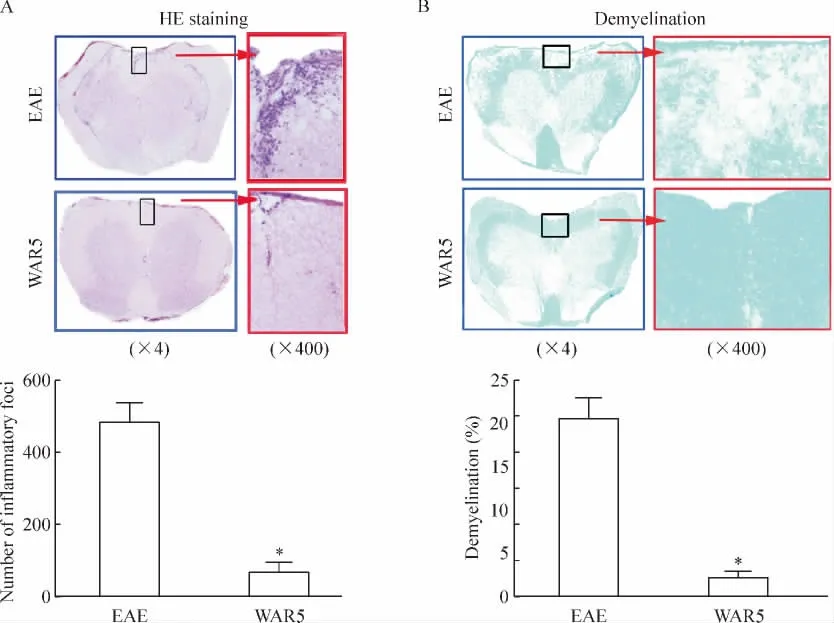
Figure 2.WAR5 inhibited inflammation and demyelination in the spinal cord of EAE mice.A:HE staining,a number of inflammatory cells in whole spinal cord were calculated by Image-Pro Plus software;B:Luxol fast blue staining,pixel area(%)of demyelination in total white matter was calculated by Image-Pro Plus software.Mean±SD.n=8.*P<0.05 vs EAE group.图2 EAE组和WAR5组小鼠的脊髓HE染色和髓鞘染色
3W AR5化合物促使M1型巨噬细胞向M2型转化
流式细胞术检测M1型巨噬细胞的标志CD16/32和M2型巨噬细胞的标志CD206。结果发现,与EAE组相比,WAR5化合物可抑制M1型细胞CD16/32的表达(P<0.01)。我们还发现WAR5治疗可使M2型细胞的CD206表达呈增高趋势。WAR5组表达比值明显低于EAE对照组,差异显著(P<0.01),见图3。结果提示WAR5化合物腹腔给药可以诱导炎症M1型巨噬细胞向抗炎M2型转化。

Figure 3.The effects of WAR5 compound on the splenic macrophages.The cells were stained with macrophage marker F4/80 and M1/M2 markers,and the polarization of M1/M2 was analyzed using flow cytometry.Representative dot plots from 1 of 3 experiments with the similar results are showed.The results are expressed as the percentage of double positive cells in four-quadrant diagram.Mean±SD.n=8.**P<0.01 vs EAE group.图3 WAR5对脾巨噬细胞的影响
4W AR5化合物抑制EAE脊髓iNOS的表达
Western blotting显示,EAE组小鼠脊髓中iNOS表达明显高于脑。WAR5化合物治疗显著抑制脊髓内iNOS的表达(P<0.05)。脑内iNOS的表达相对较低,WAR5化合物治疗明显抑制脑内iNOS的表达(P<0.05),见图4。结果提示WAR5抑制EAE小鼠脑和脊髓的iNOS水平,从而减轻脊髓炎症反应导致的脱髓鞘病变和临床症状。

Figure 4.WAR5 compound inhibited the expression of iNOS in the tissues of brains and spinal cords.Mean±SD.n=8.*P <0.05 vs EAE group.图4 WAR5抑制脑和脊髓iNOS的表达
讨 论
MS病因和发病机制较为复杂,仍缺乏特异性和有效性的治疗手段。目前临床应用的治疗药物包括疾病修饰药物(disease-modifying agents,DMA)、干扰素IFN-β和醋酸格拉默(glatiramer acetate,GA)等。这些药物通过减少发作次数和发作的严重程度进而改善疾病病程。IFN-β长期使用会产生相应的抗体,导致药物的有效性降低。另外,由于这类药物价格贵等经济原因,因此极大地限制了在中国MS患者中的推广使用。抗肿瘤药物米托蒽醌(mitoxantrone)等免疫调节药物也可用于治疗MS,作用机制与干扰DNA合成及免疫调节作用、抑制体液免疫、减少T细胞激活等有关。但其骨髓抑制和剂量相关心脏毒性等严重副作用限制了它的临床应用。利妥昔单抗(美罗华)也可用于MS的治疗,但其发生进行性多灶性白质脑病(progressive multifocal leukoencephalopathy,PML)的风险较高,只限于复发-缓解型、治疗失败、疾病活动持续不断、其它药物不能耐受及病初急剧恶化的患者[5]。其它药物如氨甲蝶呤、环孢菌素A和环磷酰胺可对进展型MS治疗有效,但仍存在骨髓抑制等严重的毒副作用。干细胞移植为基因介导修复损害的CNS组织提供了一种新的治疗方法,但仍存在一些理论和技术方面的问题,有待进一步完善和规范。因此,从中国MS患者的实际出发,寻找和研发新的有效而且副作用小的MS治疗药物就显得越来越迫切。
越来越多的证据表明,炎症机制在EAE发病中起着至关重要的作用[6]。Feske 等[7]指出,fasudil作为一种ROCK抑制剂可以促进神经轴突生长、减少炎症细胞和炎症介质的聚集和释放、保护受损神经元、减轻Rho激酶源性微血管通透性增加。同时,Takeda等[8]发现,ROCK抑制剂还可减少炎症细胞跨内皮细胞的迁徙、聚集,进而对血脑屏障(bloodbrain barrier,BBB)起到保护作用。此外,还可抑制免疫细胞的活化,减少炎症细胞向CNS迁移和聚集。Phares等[9]发现在中枢免疫过程中,CD4+T细胞参与了BBB通透性的破坏,而CD8+T细胞和B细胞并未参与。Sun等[10]应用fasudil治疗EAE,发现IL-17和IFN-γ等促炎症细胞因子表达明显下调,炎症反应显著减轻。我们前期研究也发现,fasudil可明显改善EAE小鼠临床症状,抑制occludin的表达[11],还可下调NF-κB[12],减少CNS炎症浸润和髓鞘脱失。
目前发现fasudil竞争性与ROCK催化结构域的ATP结合位点结合,对ROCK I和ROCK II具有相同的阻断作用。还发现蛋白激酶ATP结合位点区域氨基酸序列有高度的同源性,因此它对ROCK选择性有限和拮抗PKA、PKG、PKC等蛋白激酶,有可能会造成其它不良反应。通过对fasudil的结构优化寻找新的化合物,以便得到一些作用更强、选择性更高的药物成为目前亟待解决的问题。因此,我们在fasudil的基础上,选择性地合成新衍生物——WAR5化合物。采用成熟的MOG35-55诱导EAE模型,通过观察临床症状,发现WAR5化合物治疗可延迟EAE小鼠起病时间,降低发病率,缓解EAE的症状,减少体重丢失;病理学检查发现病灶处浸润细胞数量明显减少,抑制髓鞘脱失;降低脑和脊髓iNOS的表达,减轻细胞损伤、组织坏死及炎症反应。通过与前人的研究结果比较,发现WAR5与fasudil一样,也对EAE有良好的治疗作用。更重要的是,我们在近期的药物量效实验中发现WAR5化合物具有安全窗大、扩血管作用弱、给药后动物的存活率高等优点(未发表数据)。
已有研究发现,巨噬细胞可分为M1型和M2型,在EAE的发生发展中具有关键作用[13]。Fasudil体外实验的结果证实,其可直接促进M1炎症型巨噬细胞向M2型转化[14],并且体内实验也证实了fasudil可使表达高氧化应激产物和促炎症因子的M1型巨噬细胞向抑制免疫炎症反应和促进组织修复作用的M2型巨噬细胞转化[15]。我们对WAR5的研究也发现,WAR5化合物治疗可明显降低M1型表面标志CD16/32的表达,增加M2型表面标志CD206的表达,表现为M1型与M2型巨噬细胞比值降低,其平衡明显偏向M2表型。说明WAR5化合物与fasudil的作用机制也具有相似性,即可诱导M1炎症型巨噬细胞向M2抗炎型巨噬细胞分化。
综上所述,WAR5化合物与fasudil均可有效改善EAE的临床症状,抑制CNS炎症病灶并改善髓鞘脱失,其作用机制也均与调节巨噬细胞的极性、抑制系统免疫炎症反应有关。这一结果为我们今后比较fasudil与WAR5化合物的量效学、药代动力学以及药理学、毒理学实验奠定了基础。
[1] 李 勇,郑荣远,李剑敏,等.实验性变态反应性脑脊髓炎大鼠模型的复制[J].中国病理生理杂志,2005,21(2):414-416.
[2] Takata M,Tanaka H,Kimura M,et al.Fasudil,a rho kinase inhibitor,limits motor neuron loss in experimental models of amyotrophic lateral sclerosis[J].Br J Pharmacol,2013,170(2):341-351.
[3] Hou SW,Liu CY,Li YH,et al.Fasudil ameliorates disease progression in experimental autoimmune encephalomyelitis,acting possibly through antiinflammatory effect[J].CNS Neurosci Ther,2012,18(11):909-917.
[4] Fagone P,Mangano K,Quattrocchi C,et al.Prevention of clinical and histological signs of proteolipid protein(PLP)-induced experimental allergic encephalomyelitis(EAE)in mice by the water-soluble carbon monoxide-releasing molecule(CORM)-A1[J].Clin Exp Immunol,2011,163(3):368-374.
[5] 李 新,王纪佐.那他珠单抗治疗多发性硬化的循证医学回顾[J].中华神经科杂志,2009,42(6):364.
[6] Petry KG,Brochet B,Dousset V,et al.Inflammation induced neurological handicap processes in multiple sclerosis:new insights from preclinical studies[J].J Neural Transm,2010,117(8):907-917.
[7] Feske SK,Sorond FA,Henderson GV,et al.Increased leukocyte ROCK activity in patients after acute ischemic stroke[J].Brain Res,2009,1257:89-93.
[8] Takeda K,Jin MB,Fujita M,et al.A novel inhibitor of Rho-associated protein kinase,Y-27632,ameliorates hepatic ischemia and reperfusion injury in rats[J].Surgery,2003,133(2):197-206.
[9] Phares TW,Fabis MJ,Brimer CM,et al.A peroxynitritedependent pathway is responsible for blood-brain barrier permeability changes during a central nervous system inflammatory response:TNF-alpha is neither necessary nor sufficient[J].J Immunol,2007,178(11):7334-7343.
[10] Sun X,Minohara M,Kikuchi H,et al.The selective Rho-kinase inhibitor Fasudil is protective and therapeutic in experimental autoimmune cephalomyelitis[J].J Neuroimmunol,2006,180(1-2):126-134.
[11]刘岳婷,侯绍蔚,刘春云,等.法舒地尔通过诱导EAE小鼠Occludin表达抑制其炎性细胞浸润[J].中国神经免疫学和神经病学杂志,2012,19(3):206-210.
[12]侯绍蔚,刘岳婷,郭敏芳,等.盐酸法舒地尔治疗实验性自身免疫性脑脊髓炎的潜能与抗炎作用[J].中国临床神经科学,2012,20(2):126-134.
[13] Mensah-Brown EP,Shahin A,Al Shamisi M,et al.Early influx of macrophages determines susceptibility to experimental allergic encephalomyelitis in Dark Agouti(DA)rats[J].J Neuroimmunol,2011,232(1-2):68-74.
[14]张海飞,郭敏芳,孟 健,等.法舒地尔对LPS刺激小胶质细胞表型演变的影响[J].细胞与分子免疫学杂志,2012,28(8):818-821.
[15] Liu CY,Li YH,Yu JZ,et al.Targeting the shift from M1 to M2 macrophages in experimental autoimmune encephalomyelitis mice treated with fasudil[J].PLoS One,2013,8(2):e54841.

