低氧预处理及AMPK过表达对过氧化氢抑制牙髓细胞增殖影响的研究
张 萍,李 诚,余 波
(1.安康市中心医院口腔科,陕西安康 725000;2.神木县医院口腔科,陕西榆林 719300)
人牙髓细胞是一种从牙髓组织中分离得到的细胞群,具有繁殖分裂和多分化的潜能,能分化为成牙质样细胞并形成牙本质/牙髓样的结构[1-2]。由于牙髓组织被坚硬的牙体组织所包裹,氧气只能通过狭窄根管中的脉管系统才能到达牙髓细胞[3]。因此,牙髓组织中的氧含量比外围组织更少,更容易因病理变化而导致低氧。同时牙齿所处的环境也使牙髓容易受到外界因素如细菌感染、过氧化物损伤等的影响[4]。
腺苷单磷酸激活蛋白激酶[Adenosine 5’-monophosphate(AMP)- activated protein kinase,AMPK]是一种参与细胞能量调节的应激蛋白酶[5]。AMPK在结构上是一种由催化亚基(α1和α2)、调节亚基(β1 和 β2)以及 γ 亚基(γ1,γ2 和γ3)组成的异源三聚体蛋白[6]。AMPK可由细胞中增高的AMP/ATP水平所激活,并通过上游激酶的催化将其催化亚基的Thr172位点磷酸化。磷酸化后的AMPK即被激活,并可通过调节细胞中的能量水平而使细胞适应低氧、低糖等周围环境的胁迫[7]。已有研究证明,AMPK参与调控细胞在氧化环境中的生长能力[8]。本实验通过体外培养人牙髓细胞,观察低氧预处理后细胞中AMPK基因的表达及其在细胞抵抗氧化环境中的作用,以期为进一步研究牙髓细胞氧化应激机制提供参考。
1 材料和方法
1.1 主要材料、试剂和仪器
MEM培养基、胎牛血清、胰酶、脂质体LipofectamineTM2000(Invitrogen公司,美国);噻唑蓝(北京精华耀邦医药);Trizol试剂盒、质粒提取试剂盒、DyNAmo SYBR Green qPCR试剂盒、细胞培养板(大连宝生物);Sanyo MCO-15AC细胞培养箱(Sanyo公司,日本),VIIA 7实时定量 PCR仪(Applied Biosystems公司,美国)。
1.2 方法
1.2.1 细胞培养
取19~29岁志愿者(知情同意)因阻生而拔除的健康第三磨牙,用PBS冲洗干净后,于超净工作台上劈开,小心取出牙髓组织并用眼科剪剪碎,加入3 g/L I型胶原酶37℃下消化30~60 min。然后将消化后的组织块平铺于培养瓶底,加入适量含200 mL/L胎牛血清的MEM培养基,瓶底向上置于37℃、50 mL/L CO2培养箱中进行培养;待组织块贴壁后翻转培养瓶继续培养,每隔3 d换液1次。待细胞生长达80%融合时用2.5 g/L胰酶消化,按1∶2比例传代。取第3代牙髓细胞用于以下实验。
1.2.2 观察低氧预处理对人牙髓细胞AMPK基因表达的影响
取第3代人牙髓细胞,以1×104/孔的密度接种于24孔板,并将细胞随机分为常氧组和低氧组。常氧组细胞置于37℃培养箱中,在常氧(950 mL/L空气,50 mL/L CO2)条件下培养;低氧组细胞置于37℃培养箱中,在低氧(10 mL/L O2,940 mL/L N2,50 mL/L CO2)条件下培养。培养12 h后取各组细胞,用Trizol试剂盒提取细胞总RNA,并反转录成cDNA。根据Genbank中AMPK基因序列设计并合成引物(上海生工合成),引物序列为:上游:5’-GGGTGAAGATCGGACACTACGT-3;下游:5'- TTGATGTTCAATCTTCACTTTG -3';然后以cDNA为模板,以β-actin为内参(其上游引物:5’-CTCCATCCTGGCCTCGCTGT-3’;下游引物:5’-GCTGTCACCTTCACCGTTCC-3’)用qRT-PCR仪检测各组细胞中AMPK mRNA的表达水平。反应体系共25 μL,分别为 DyNAmo SYBR Green qPCR mix 12.5 μL,上 下 游 引 物 各 0.5 μL;cDNA 模 板(<10 ng/μL)2 μL;无 RNA 酶水 9.5 μL。反应条件为:UNG酶50℃孵育2 min,94℃预变性10 min;94℃ DNA变性20 sec,引物在50℃退火30 sec,72℃延伸30 sec,共36个循环;72℃后延伸10 min。熔解曲线的制作条件为65~95℃,每0.2℃停留1 sec。基因表达的定量分析采用相对标准曲线法:将克隆的DNA片段按10~104倍比稀释后,由Opticon Monitor 2软件产生最佳荧光基线和标准曲线;目的基因和β-actin基因的拷贝数分别根据产生的Ct值从各自的标准曲线中获得。然后以目的基因的拷贝数除以 β-actin的拷贝数的比值作为靶基因的表达量。实验重复3次,取均值。
1.2.3 观察低氧预处理对H2O2抑制牙髓细胞增殖的影响
取第3代人牙髓细胞,以1×104/孔的密度接种于24孔板,并将细胞随机分为4组,即常氧组、低氧组、常氧 +H2O2组、低氧 +H2O2组;然后按1.2.2的方法分别在常氧和低氧条件下进行培养,其中常氧+H2O2组和低氧+H2O2组细胞于相应条件下培养12 h后,分别于各孔中加入10 μL 0.1 mmol/L H2O2液处理4 h;然后各组细胞均更换常规培养液,并在正常条件下(37℃,950 mL/L空气,50 mL/L CO2)继续培养。分别于培养24、48、72、96 h各时间点取各组细胞,每孔加入 20 μL MTT(5 mg/mL)继续培养4 h;然后吸去上清,每孔加入150 μL二甲基亚砜(DMSO),震荡混匀后用酶标仪测量各孔490 nm波长的吸光度值(OD值)。
1.2.4 观察AMPK基因过表达或沉默后牙髓细胞表达AMPK的变化
1.2.4.1 AMPK过表达重组质粒的构建和鉴定
利用Trizol试剂盒提取人牙髓组织的总RNA,并利用反转录试剂盒合成cDNA。以cDNA为模板,用含有 HindⅢ 和BamHⅠ 酶切位点的引物(上游引物:5'- CAAGCTTGCATAGATTAGCAGCATTGAAAGC-3';下游引物:5'- CGGATCCGAATACACCCACCAGAATAGCACA -3')对AMPK基因进行扩增;然后将扩增产物克隆到p3XFlag-CMV中构建AMPK过表达重组质粒。取1 μL重组质粒转染大肠杆菌,并将其置于LB液体培养基中,37℃振荡培养过夜;次日4000 r/min离心10 min收集菌体,用质粒提取试剂盒提取质粒后以HindⅢ 和BamH I进行双酶切;酶切产物通过琼脂糖凝胶电泳,对重组质粒进行鉴定。
1.2.4.2 AMPK siRNA 的合成
根据Genbank中AMPK基因序列设计并合成siRNA,其具体序列为 5’ -GATCCGGTTGTATGCTGGTCC-3’(上海捷瑞合成)。
1.2.4.3 细胞转染和 AMPK mRNA 检测
将第3代人牙髓细胞接种于24孔板,常规培养至细胞生长达80%融合时,弃原培养液,并将细胞随机分为正常对照组、AMPK过表达组、AMPK沉默(RNA干扰)组。其中正常对照组加入常规MEM(500 μL/孔)继续培养;过表达组加入含50 μL AMPK过表达重组质粒(重组质粒-LipofectamineTM2000复合物,质粒浓度 4 μg/mL)的MEM(500 μL/孔)进行转染;沉默组加入含 50 μL siRNA(SiRNA-LipofectamineTM2000复合物,siRNA浓度120 Pmol/L的 MEM(500 μL/孔)进行转染。转染6 h后,用qRT-PCR仪按1.2.2相同的方法分别检测各组细胞中AMPK mRNA的表达水平。
1.2.5 观察AMPK过表达对H2O2移植牙髓细胞增殖的影响
取第3代人牙髓细胞接种于24孔板,并将细胞随机分为4组,即:正常对照组、正常细胞 +H2O2处理组、AMPK过表达+H2O2处理组、AMPK沉默+H2O2处理组。其中正常对照组用常规MEM在正常条件下进行培养;H2O2处理组细胞加入 10 μL 0.1 mmol/L H2O2处理 4 h 后,然后换用常规MEM继续培养;AMPK过表达+H2O2处理组和AMPK沉默+H2O2处理组先按1.2.4.3的方法分别转染AMPK过表达质粒或AMPK siRNA后,再加入10 μL 0.1 mmol/L H2O2处理 4 h,然后换用常规MEM继续培养。分别于培养后24、48、72、96 h各时间点取各组细胞,用MTT法检测细胞的增殖情况,具体方法同 1.2.3。
1.3 统计学分析
2 结果
2.1 低氧预处理对牙髓细胞中AMPK基因表达的影响
为观察低氧环境对细胞AMPK基因表达的影响,将牙髓细胞分别在常氧和低氧环境下进行培养。12 h后RT-PCR检测结果显示,低氧组牙髓细胞中AMPK mRNA的表达水平显著高于常氧组(P<0.05)(图1)。表明低氧环境能够上调牙髓细胞中AMPK基因的表达。
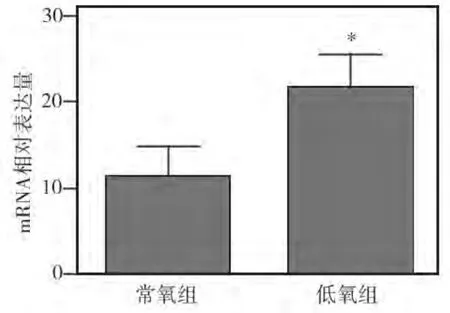
图1 低氧和常氧环境下牙髓细胞AMPK mRNA表达水平的比较(* 与常氧组相比P<0.05)
2.2 低氧预处理对H2O2抑制牙髓细胞增殖的影响
将牙髓细胞分别置于常氧、低氧环境下培养12 h后,再用0.1 mmol/L H2O2处理细胞4 h;然后在常规条件下进行培养,并分别于培养24、48、72、96 h各时间点用MTT法检测各组细胞增殖情况。结果显示:不用H2O2处理时,常氧和低氧预处理的两组细胞的增殖能力基本一致(P>0.05),均随培养时间而逐渐增加;用H2O2处理后的常氧组和低氧组细胞的增殖能力均较其对照组显著降低(P<0.05);其中常氧+H2O2组细胞的增殖能力最低,与低氧+H2O2组相比,各时间点的差异均有统计学意义(P<0.05)(图2)。提示,低氧预处理能减轻氧化环境对牙髓细胞生长的抑制。
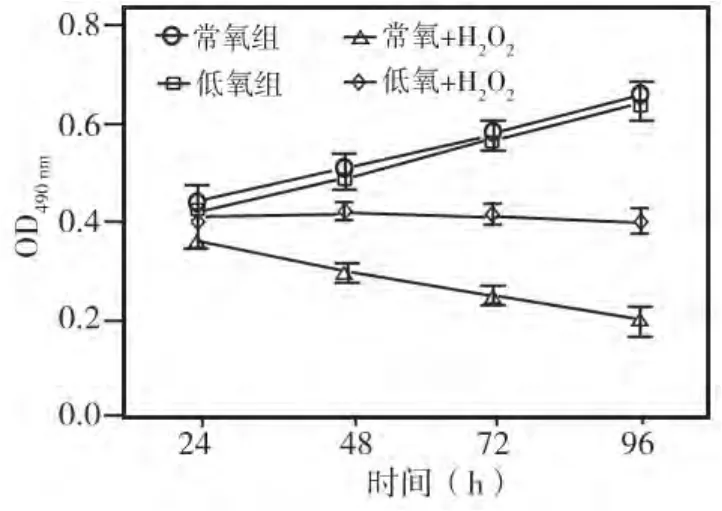
图2 各组牙髓细胞增殖能力比较
2.3 AMPK基因过表达或沉默后牙髓细胞表达AMPK mRNA的变化
分别将AMPK基因过表达质粒或siRNA转染牙髓细胞6 h后,RT-PCR检测结果显示:与对照组相比,转染过表达质粒的细胞中AMPK mRNA表达显著升高(P<0.05),而转染siRNA的细胞中AMPK mRNA的表达明显受到抑制(P<0.05)(图3)。
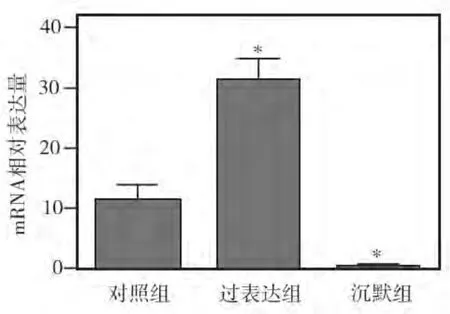
图3 AMPK基因过表达和沉默后牙髓细胞表达AMPK的变化(* 与对照组相比P<0.05)
2.4 AMPK基因过表达对H2O2抑制牙髓细胞增殖的影响
为观察AMPK基因在牙髓细胞抵抗氧化环境中的作用,以0.1 mmol/L H2O2分别对正常牙髓细胞以及转染AMPK过表达质粒或siRNA的牙髓细胞处理4 h;然后换用常规MEM继续培养,并用MTT法分别检测各组细胞在培养24、48、72、96 h的增殖情况。结果显示:与正常对照组相比,经H2O2处理的各组细胞在培养48 h后各时间点的增殖能力均明显降低(P<0.05);但AMPK基因过表达组受H2O2的影响最小,培养48 h后各时间点的细胞增殖能力均明显高于正常细胞+H2O2组(P<0.05);而 AMPK基因沉默(siRNA)组受H2O2的影响最明显,培养24~96 h各时间点的细胞增殖能力均明显低于其他各组(P<0.05)(图4)。以上结果表明,AMPK基因过表达有助于牙髓细胞抵抗氧化环境,可减轻氧化环境对细胞增殖的抑制作用。
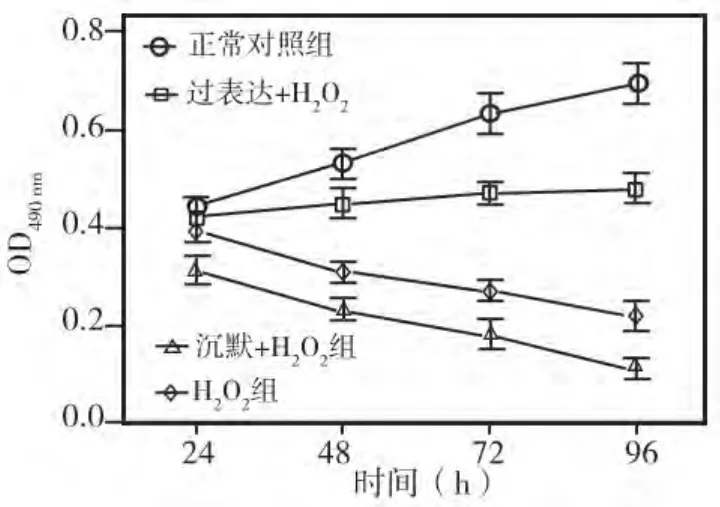
图4 AMPK过表达对H2O2抑制牙髓细胞增殖的影响
3 讨论
牙髓细胞是指牙髓组织中的一种处于未(低)分化状态,且可塑性强,并保持有分裂、增殖和分化能力的细胞群[9]。牙髓细胞对于牙本质的形成和损伤修复均具有重要作用,但由于其在口腔环境容易受各种外界因素的影响而导致损伤,因此研究牙髓细胞抵御环境损伤的相关机制具有重要意义。
近年来关于不同细胞在低氧环境中的反应,已有较多研究报道。Dippolito等[10]发现,人骨髓细胞在30 mL/L O2环境中培养时,其分裂活性增高,并且维持不分化的状态。Packer等[11]报道,人成纤维细胞在20 mL/L的O2环境下进行培养时,不仅可使其分裂活性增高,同时还能延长其生命周期。此外,关于低氧环境对大鼠、猪、犬、人等不同来源牙髓细胞的影响也有较多研究[12-13]。Wang等[14]报道,通过低氧环境培养能增强牙髓细胞的分裂活性,并使其STRO-1阳性细胞的比例增高。Iida等[13]发现与常氧条件相比,低氧环境培养不仅能使人牙髓细胞的增殖能力明显增高,并且可使源于老年患者的牙髓细胞恢复分裂和分化的能力。AMPK是一种应激调节蛋白酶,多种细胞环境如低氧、H2O2、缺糖、炎症细胞因子刺激等均能影响其在牙髓细胞中的表达。Fkuyama等[15]发现,RPCC2A牙髓细胞在低氧浓度(20 mL/L)条件下培养24 h后,细胞增殖率与正常氧浓度组(200 mL/L)相比无明显区别,但低氧条件可上调牙髓细胞中AMPK蛋白的表达;同时,将细胞中的AMPK基因沉默72 h后,无论在低氧条件下还是在常氧条件下进行培养,细胞的增殖均明显下降。Zhou等在研究牙髓细胞的自噬现象时发现,AMPK/mTOR信号通路可介导细胞在低氧应激中的自我吞噬;同时还发现,若利用复合体C抑制AMPK活性,则能导致牙髓细胞的凋亡[16]。本结果显示,低氧预处理不仅能上调人牙髓细胞中AMPK基因的表达,同时还能增强细胞在氧化环境中的增殖能力,从而减轻H2O2对细胞增殖的抑制作用。
超氧负离子、H2O2、游离羟基以及氧负离子等均为细胞内活性氧簇(reactive oxygen species,ROS)的主要成分,并且能在细胞中互相转化。在上述这些分子中,H2O2最为稳定,也是细胞中ROS的主要存在形式。H2O2作为一种强氧化剂,能在牙齿漂白过程中形成自由基,并能穿过釉质和牙本质进入髓室中。有研究发现,牙齿漂白后其髓室中的 H2O2含量可达到 450 mmol/L[17]。目前已证实,H2O2能够诱导牙髓组织坏死和细胞凋亡。Wu TT等发现,H2O2处理可导致人牙髓细胞的增殖能力降低,并可诱导细胞中caspase 3和caspase 9基因的表达水平显著上升[18]。另有研究发现,AMPK的激活能够抑制H2O2诱导的细胞死亡。Hwang JT等[19]在H9c2肌肉细胞中加入H2O2进行培养时发现,利用白藜芦醇激活细胞中的AMPK活性能使细胞获得对H2O2诱导凋亡的抗性。本结果也发现,AMPK基因过表达能增强牙髓细胞在氧化环境中的增殖能力,并减轻H2O2对细胞增殖的抑制作用;而通过RNA干扰使AMPK基因沉默后,则可导致细胞的增殖能力显著下降。
综合上述,低氧处理可上调牙髓细胞中AMPK mRNA的表达水平,并能减轻因H2O2对细胞增殖的抑制作用;通过AMPK基因过表达可使牙髓细胞获得对H2O2氧化的抗性,亦能减轻H2O2对细胞增殖的抑制作用。然而,关于AMPK在牙髓细胞氧化应激中的具体作用机制尚需进一步研究。
[1]Gronthos S,Brahim J,Li W,et al.Stem cell properties of human dental pulp stem cells[J].J Dent Res,2002,81(8):531-535.
[2]Morito A,Kida Y,Suzuki K,et al.Effects of basic fibroblast growth factor on the development of the stem cell properties of human dental pulp cells[J].Arch Histol Cytol,2009,72(1):51-64.
[3]Yu CY,Boyd NM,Cringle SJ,et al.Oxygen distribution and consumption in rat lower incisor pulp[J].Arch Oral Biol,2002,47(7):529-536.
[4]Wang Y,Zhao Y,Jia W,et al.Preliminary study on dental pulp stem cell-mediated pulp regeneration in canine immature permanent teeth[J].J Endod,2013,39(2):195 -201.
[5]Beauloye C,Marsin AS,Bertrand L,et al.Insulin antagonizes AMP-activated protein kinase activation by ischemia or anoxia in rat hearts,without affecting total adenine nucleotides[J].FEBS Lett,2001,505(3):348 -352.
[6]Hardie DG.AMP-activated/SNF1 protein kinases:Conserved guardians of cellular energy[J].Nat Rev Mol Cell Biol,2007,8(10):774-785
[7]Kim JE,Ahn MW,Baek SH,et al.AMPK activator,AICAR,inhibits palmitate-induced apoptosis in osteoblast[J].Bone,2008,43(2):394-404.
[8]Davies SP,Helps NR,Cohen PT,et al.5'- AMP inhibits dephosphorylation,as well as promoting phosphorylation,of the AMP-activated protein kinase.Studies using bacterially expressed human protein phosphatase-2C alpha and native bovine protein phosphatase-2AC[J].FEBS Lett,1995,377(3):421-425.
[9]Ruch JV.Odontoblast commitment and differentiation[J].Biochem Cell Biol,1998,76(6):923-938.
[10]Dlppolito G,Diabira S,Howard GA,et al.Low oxygen tension inhibits osteogenic differentiation and enhances stemness of human MIAMI cells[J].Bone,2006,39(3):513 - 522.
[11]Packer L,Fuehr K.Low oxygen concentration extends the lifespan of cultured human diploid cells[J].Nature,1977,267(5610):423-425.
[12]Agata H,Kagami H,Watanabe N,et al.Effect of ischemic culture conditions on the survival and differentiation of porcine dental pulp-derived cells[J].Differentiation,2008,76(9):981 -993.
[13]Iida K,Takeda-Kawaguchi T,Tezuka Y,et al.Hypoxia enhances colony formation and proliferation but inhibits differentiation of human dental pulp cells[J].Arch Oral Biol,2010,55(9):648-654.
[14]Wang J,Wei X,Ling J,et al.Side population increase after simulated transient ischemia in human dental pulp cell[J].J Endod,2010,36(3):453-458.
[15]Fukuyama Y,Ohta K,Okoshi R,et al.Hypoxia induces expression and activation ofAMPK in rat dental pulp cells[J].J Dent Res,2007,86(9):903-907.
[16]Zhou Q,Liu H,Sun Q,et al.Adenosine monophosphate-activated protein kinase/mammalian target of rapamycin-dependent autophagy protects human dental pulp cells against hypoxia[J].J Endod,2013,39(6):768-773.
[17]Benetti AR,Valera MC,Mancini MN,et al.In vitro penetration of bleaching agents into the pulp chamber[J].Int Endod J,2004,37(2):120-124.
[18]Wu TT,Li LF,Du R,et al.Hydrogen peroxide induces apoptosis in human dental pulp cells via caspase-9 dependent pathway[J].J Endod,2013,39(9):1151 -1155.
[19]Hwang JT,Kwon DY,Park OJ,et al.Resveratrol protects ROS-induced cell death by activating AMPK in H9c2 cardiac muscle cells[J].Genes Nutr,2008,2(4):323 -326.

