自体富血小板血浆凝胶析出液对骨髓间充质干细胞迁移影响的体外研究
谢蔓菁,陈文霞,黄 杨,李康婧
(广西医科大学口腔医学院,广西南宁 530021)
牙髓组织对于维持牙齿作为一个有活力组织器官的内部稳态起着关键性作用。临床上对不可逆性牙髓炎的治疗通常采用根管治疗术,但根管治疗后的牙齿由于失去牙髓的营养来源,常存在脆性变大、容易折裂等问题[1-2]。近年来,关于牙髓再生的研究已成为国内外学者关注的焦点,并利用干细胞移植技术在体内外成功构建出牙髓牙本质复合体样结构。然而,干细胞移植存在一定的风险,有研究发现体外扩增的间充质干细胞在动物移植模型中可引起肿瘤的发生[3-4]。细胞迁移是损伤修复的前提,而生长因子则在干细胞的迁移、增殖、分化过程中起到重要作用。
BMSCs是存在于骨髓中的一类成体干细胞,具有多向分化的潜能,且细胞生物学特性与牙源性干细胞有诸多相似之处[5]。有研究证实,BMSCs在适宜的微环境中可被诱导分化为成牙本质样细胞[6]。有文献报道,在富血小板血浆中加入激活剂后可形成一种胶冻状的半固体,即富血小板血浆凝胶(Platelet richplasmagel,PRG),其主要结构为纤维蛋白网和血小板[7]。另有研究发现,在PRP形成PRG过程中,血小板可通过脱颗粒作用,释放出多种对细胞趋化、增殖、多向分化起促进作用的生长因子[8]。本实验通过观察不同浓度PRG析出液作用不同时间对BMSCs迁移的促进作用,以期为后续研究中利用PRG析出液趋化种子细胞进入根管介导牙髓再生奠定基础。
1 材料和方法
1.1 主要仪器和试剂
CO2孵育箱(Thermo,美国);相差显微镜及其照相系统 (Olympus,日本);高温低速离心机(Sigma,美国);全自动血细胞分析仪(深圳);细胞培养皿、板(Corning,美国);Transwell培养小室(Millipore,美国);DMEM培养基、胎牛血清(Hyclone,美国);2.5g/L EDTA-胰蛋白酶(北京索莱宝);牛凝血酶(Sigma,美国)。
1.2 犬BMSCs的分离培养及其成骨分化鉴定
1.2.1 犬BMSCs分离培养
取6个月家犬1只(体质量约为4 kg),在戊巴比妥钠腹腔注射(30 mg/kg)麻醉下,自胫骨上端穿刺抽取骨髓置于含肝素的试管中,加入等体积PBS并充分混合后,室温下离心(1000 r/min)15 min;沉淀部分用DMEM完全培养液重悬后接种于25 mL培养瓶,置于37℃培养箱中在50 mL/L CO2饱和湿度下培养。当细胞生长接近80%融合时,按1∶3进行首次传代,隔日换液;待细胞生长达80% ~90%融合时再次传代。
1.2.2 犬BMSCs成骨分化鉴定
取第3代BMSCs按1×106/mL的细胞浓度接种于成骨诱导条件培养基(1 mmol/L地塞米松、1 mol/L β-甘油磷酸钠、50 mmol/L抗坏血酸),37℃,50 mL/L CO2饱和湿度下进行培养。连续培养3周后,分别进行碱性磷酸酶、茜素红、Von kossa染色,倒置显微镜下观察BMSCs经过成骨诱导后碱性磷酸酶的表达以及钙结节形成情况。
1.3 PRG析出液的制备
1.3.1 PRP 提取
取上述同一只实验犬并以相同的方法麻醉后,无菌条件下采集静脉血,用低温高速离心机在控温20℃条件下两次离心:第1次离心(2400 r/min,10 min)后,在超净工作台内分别吸取全部血浆层、白膜层及其下2~3 mm的红细胞层,并移入另一无菌离心管内进行第2次离心(3600 r/min,15 min),吸弃上层3/4贫血小板血浆,将余下的1/4血浆层、白膜层以及红细胞层混匀后即为PRP。然后立即对全血及PRP进行血小板计数。
1.3.2 制备PRG析出液
将PRP与激活剂(牛血酶及10%CaCl2混合物)按体积比为9∶1的比例混合,震荡混匀后室温下静置1 h,再置于4℃冰箱过夜。待PRP凝胶大部分收缩后,以5000 r/min速度离心10 min,并吸取富含复合生长因子的PRG析出液分装于1.5 mL EP管内,-80℃冻存备用。
1.4 BMSCs迁移实验
1.4.1 观察PRG析出液对BMSCs迁移影响的浓度效应
取第3代BMSCs接种于无血清培养基进行饥饿培养8 h后,用DMEM培养液制备细胞密度为1×106/mL的单细胞悬液。取带有Transwell小室的24孔板,并于每个小室的上室内各加入100 mL BMSCs单细胞悬液,然后将其随机分为6组(5个实验组和1个对照组)(每组复3孔);然后在5个实验组的下室内分别加入含PRG析出液体积分数为1%、5%、10%、20%、50%的DMEM培养液(含1%血清)600 μL,对照组加入等量仅含1%血清的DMEM培养液标准环境下继续培养。培养24 h后,取出各组所有Transwell小室,弃去上室培养液并用PBS浸洗2 min;棉签轻柔拭去小室滤膜内表面未迁移的细胞后,将外表面迁移有细胞的滤膜置于40 g/L多聚甲醛溶液条件下固定10 min;然后蒸馏水洗涤3 min×2次,10 g/L结晶紫染色10 min;蒸馏水漂洗5 min后自然晾干,显微镜下观察穿膜细胞,并于每张滤膜上各随机选取5个视野(100×)计算穿膜细胞数,取其平均值[9]。重复3次。
1.4.2 观察PRG析出液对BMSCs迁移影响的时间效应
取3块带有Transwell小室的24孔板,并于每个Transwell小室的上室内各加入100 μL第3代BMSCs单细胞悬液(制备方法和细胞密度同1.4.1),并将其随机分为两组:实验组下室内加入含PRG析出液浓度为5%的DMEM培养液(含1%血清)600 μL;对照组下室内加入等量仅含1%血清的DMEM培养液。标准环境内继续培养,分别于培养后12、24、36 h各时间点,每组各取出3个Transwell小室,按1.4.1相同的方法进行细胞固定、染色和显微镜下观察,并对穿膜细胞进行计数。
1.5 统计学分析
2 结果
2.1 BMSCs形态学观察
BMSCs原代培养第5天时,贴壁细胞散在分布于培养瓶底部,并呈圆形、多角形、梭形外观(图1a);培养10~12 d后,细胞融合成片,基本贴满培养瓶底部。传代培养后,细胞形态逐渐趋于一致,排列规律有序,呈放射状或漩涡样生长,增殖速度较原代细胞快(图1b)。
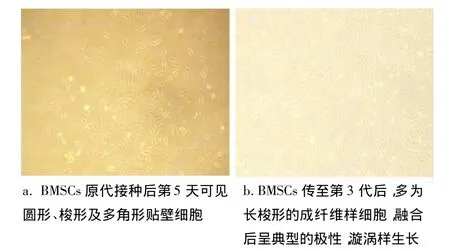
图1 骨髓间充质干细胞形态学观察(×40)
2.2 BMSCs成骨分化鉴定结果
BMSCs成骨诱导3周后碱性磷酸酶染色可见细胞膜及胞浆内均有阳性反应,染色呈蓝黑色颗粒或块状深染颗粒(图2a);茜素红染色可见染色阳性的桔红色钙结节(图2b);Von kossa染色可见染色阳性的黑色钙结节(图2c)。
2.3 PRP中血小板含量及PRG析出液的含量
二次离心所得PRP中血小板的含量为(953.33±64.53)×109/L,全血中血小板的含量为(208.66±13.57)×109/L,与全血相比,PRP 中血小板浓度明显升高(P<0.05)。10 mL静脉全血制备的 PRP约可制备出0.7 mL的 PRG析出液(图3)。
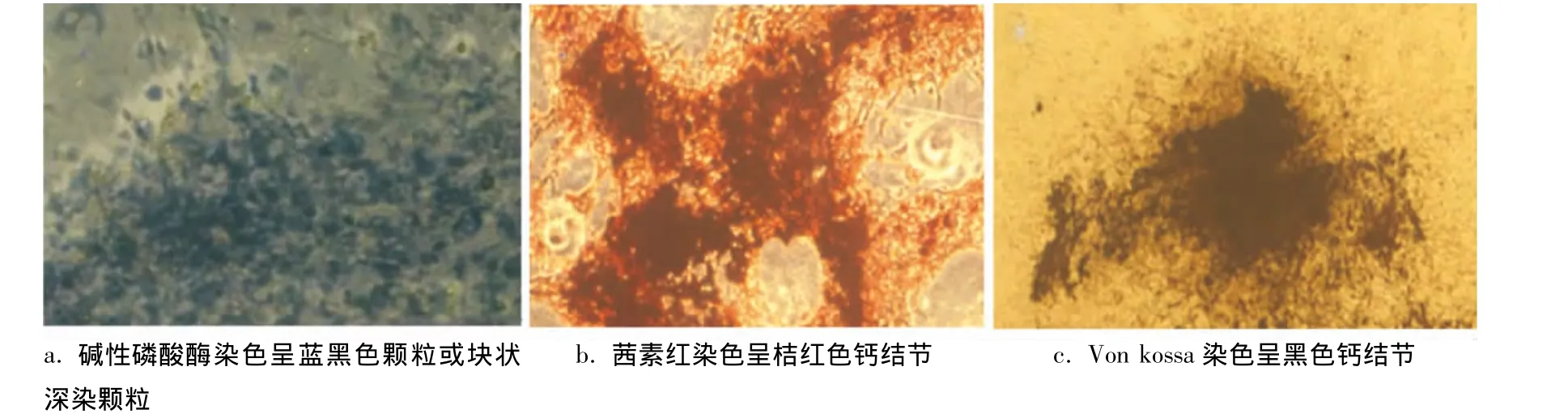
图2 BMSCs成骨分化鉴定结果(×40)
2.4 不同浓度PRG析出液对BMSCs迁移的影响
与对照组相比,1%、5%、10%、20%不同浓度PRG析出液均能明显促进BMSCs的迁移(P<0.05);其中以5%浓度组的促进作用最强;此后随着PRG析出液浓度的升高,对BMSCs迁移的促进作用逐渐降低,当其浓度达50%时,小室滤膜外表面已观察不到穿膜细胞;不同浓度PRG析出液组迁移细胞数量两两相比,差异均有统计学意义(P <0.05)(表1,图 4)。
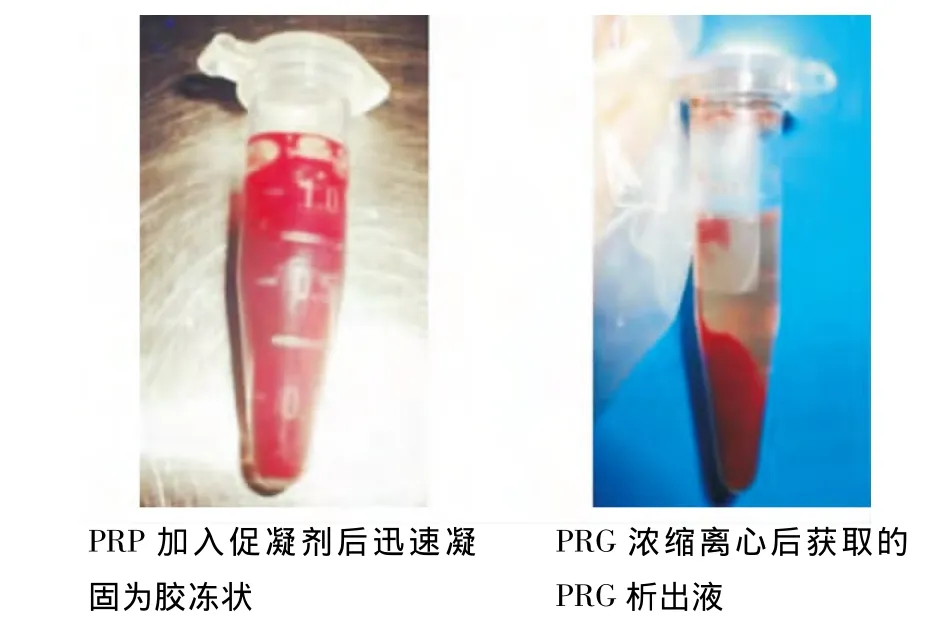
图3 富血小板血浆凝胶析出液的制备
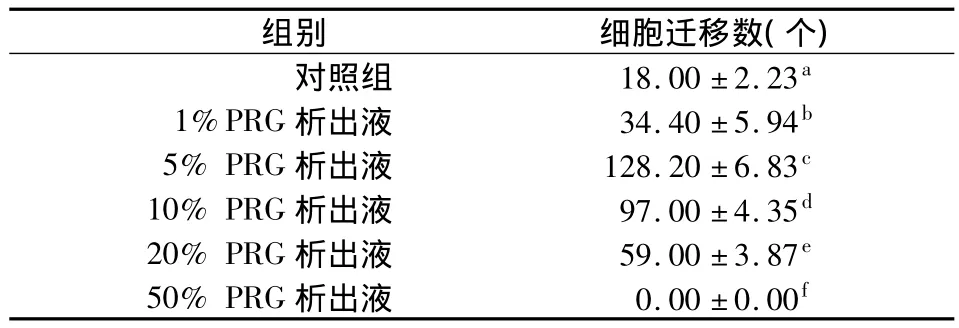
表1 各组BMSCs的迁移数比较 (n=3)
2.5 5%PRG析出液促进BMSCs迁移的时间效应
与对照组相比,5%PRG析出液作用于BMSCs 12、24、36 h不同时间均能明显促进其迁移(P<0.05);实验组不同时间点的迁移细胞数以12 h最低,与24、36 h组相比差异均有统计学意义(P<0.05);作用24 h的迁移细胞数最高,但与36 h相比差异无统计学意义(P>0.05)(图5,表2)。

图4 不同浓度PRG析出液组的BMSCs迁移情况(×100)
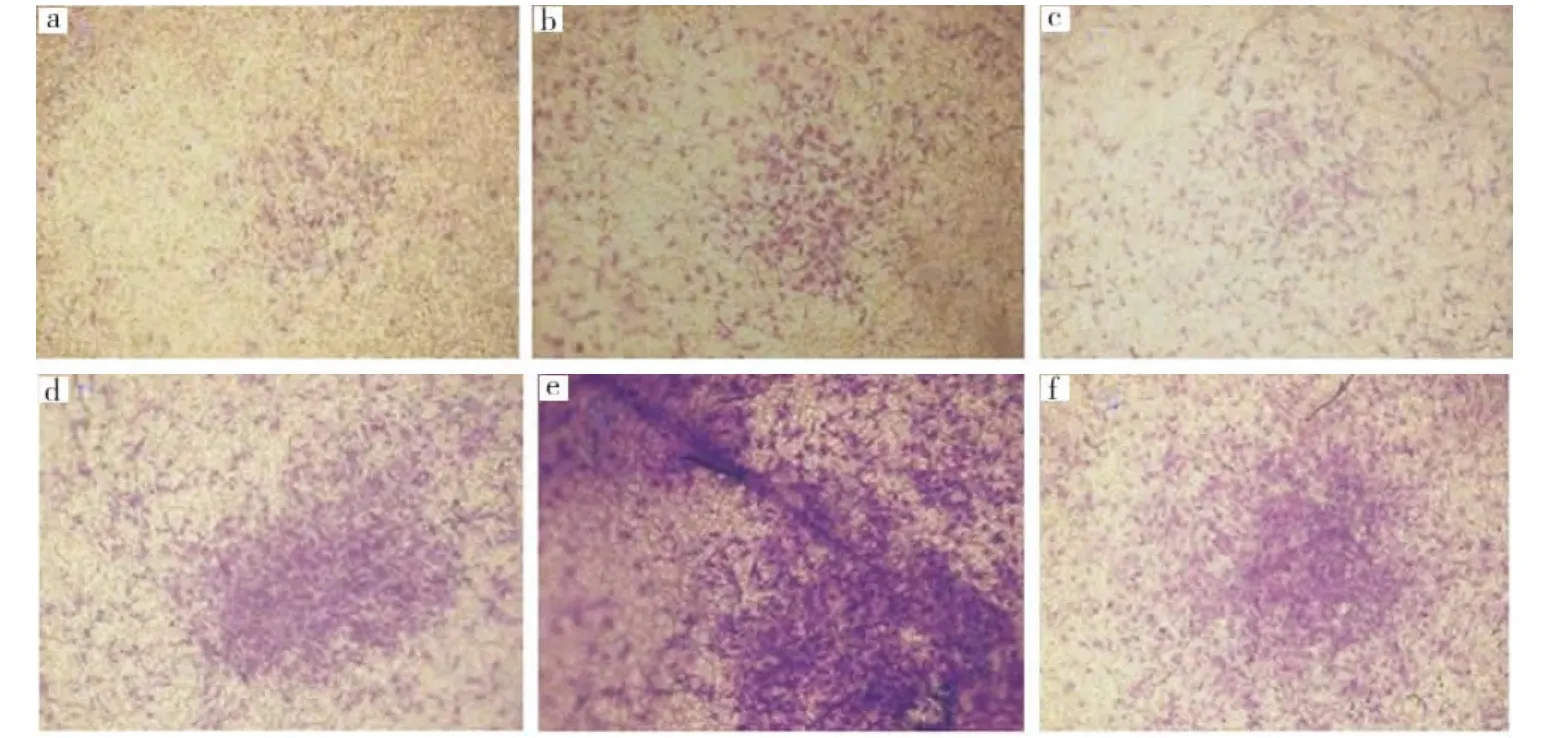
图5 5%PRG析出液作用于BMSCs不同时间后的细胞迁移情况(×40)
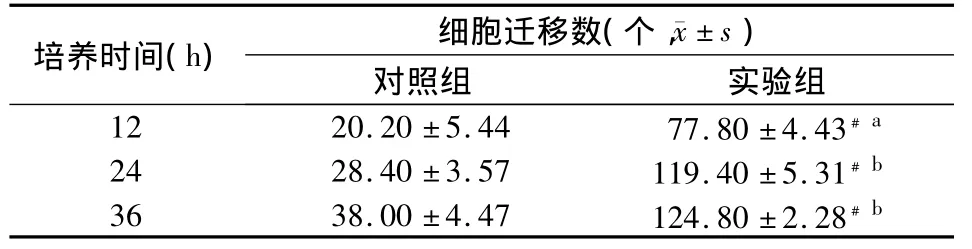
表2 5%PRG析出液促进BMSCs迁移的时间效应
3 讨论
Dimitris等(1984)发现血浆中提取的PRP经激活后可使其中的血小板释放出多种生长因子以来,学者们对PRP的成分、生物学作用以及临床应用等均进行了大量研究;并发现其含有机体损伤修复所需的多种生长因子,如血小板衍生生长因子(PDGF)、转化生长因子(TGF-β)、血管内皮生长因子(VEGF)、成纤维细胞生长因子(FGF)等[10]。Garg等[11]报道,在 PRP中加入促凝剂后,不仅可激活血小板使之释放生长因子,同时还能激活纤维蛋白使其形成具有三维网状结构的凝胶,该凝胶的特殊结构有利于细胞黏附、增殖、分化,更能充分发挥其生物学作用。
本研究通过Transwell实验观察了PRP激活后形成的凝胶析出液对BMSCs迁移的促进作用,结果显示:培养基中的PRG析出液浓度在1%~20%时,可明显促进BMSCs的迁移,其中以5%浓度组的促进迁移作用最佳;此后随着PRG析出液浓度的增加促进迁移作用越来越低,当浓度达到50%时,已观察不到迁移的细胞。本结果与相关研究类似,Marx等[12]认为,PRP内的血小板浓度为全血血小板浓度的4~5倍时,才会有明显的生物学作用,低于此范围,其作用不显著;高于此范围,其作用也不会得到增强,甚至会起到抑制迁移的作用。Weibrich等[13]在研究PRP中的血小板浓度对种植体周围骨再生的作用时发现,当PRP内血小板的浓度为全血血小板浓度的2~6倍时,才会对种植体周围骨再生起到明显的促进作用,而当其浓度为6~11倍时,则会对成骨细胞的活性起抑制作用;作者在分析引起这一现象的原因时认为,当其浓度过高时细胞因子可能会表现出细胞毒性所致。此外,Marden[14]也报道了高剂量的 PDGF-BB 能抑制骨生成。分析其原因:①细胞迁移运动的发生是由析出液中生长因子配体与细胞膜上相应受体结合后所启动,但细胞膜上的受体数量有限,当生长因子浓度升高到一定程度时,受体与配体数量恰好匹配,即能发挥最佳促迁移效果,若超过该浓度阈值时,则会出现受体饱和反馈抑制,从而导致迁移细胞数逐渐降低甚至观察不到细胞的迁移;②当PRG析出液的浓度过大时,其中所含有的高浓度生长因子会表现出细胞中毒,从而导致细胞凋亡,使之无法迁移小室的滤膜外表面。此外,本实验中还发现,PRG析出液对BMSCs的迁移作用具有时间依赖性,即5%的 PRG析出液作用于 BMSCs 24 h组的促迁移作用最佳,但其具体机制尚有待于进一步研究。
[1]Dammaschke T,Steven D,Kaup M,et al.Longterm survival of root- canal- treated teeth:a retrospective study over 10 years[J].J Endod,2003,29(10):638-643.
[2]Andreasen JO,Farik B,Munksgaard EC.Long-term calcium hydroxide as a root canal dressing may increase risk of root fracture[J].Dent Traumatol,2002,18,134 -137.
[3]So R,Augello A,Carida M,et al.Developmentof sarcomasin mice implanted with mesenchymal stem cells seeded onto bioscaffolds[J].Carcinogenesis,2009,30(1):150 -157.
[4]Olar J,Nauta AJ,Osborn MJ,et al.Sarcoma derived from cultured mesenchymal stem cells[J].Stem Cells,2007,25(2):371-379.
[5]Huang GT,Gronthos S,Shi S.Mesenchymal stem cells derived from dental tissues vs.those from other sources:their biology and role in regenerative medicine[J].J Dent Res,2009,88(9):792 -806.
[6]董金山,段晴月,文军,等.骨髓间充质干细胞向成牙本质样细胞分化的体外实验研究[J].牙体牙髓牙周病学杂志,2010,20(4):192 -195.
[7]马健,李放,任大江,等.富含血小板血浆凝胶的超微结构[J].中国康复理论与实践,2011,17(3):223-225.
[8]Ennis JPM,Stoelinga PJW,Jansen JA.Mandibular reconstruction:a clinical and radiographic animal study on the use of autogenous scaffolds and platelet-rich plasma[J].International J Oral Maxillo Facial Rgery,2002,31(3):281 -286.
[9]Lee JJ,Kwak HJ,Lee YM,et al.Acute radio frequency irradiation does not affect cell cycle,cellular migration,and invasion[J].Bioelectromagnetics,2008,29(8):615 -625.
[10]Nikolidakis D,Jansen JA.The biology of platelet-rich plasma and its application in oral surgery:literature review[J].Tissue Engineering Part B:Reviews,2008,14(3):249 -258.
[11]Garg AK,Gargenese D,Peace I.Using platelet-rich plasma to develop an autologous membrane for growth factor delivery in dentalimplant therapy[J].Dent Implantol Update,2000,11(6):41-44.
[12]Marx RE.Platelet-rich plasma:evidence to support its use[J].J Oral Maxillofac Surg,2004,62(4):489-496.
[13]Weibrich G,Hansen T,Kleis W,et al.Effect of platelet concentration in platelet-rich plasma on peri-implant bone regeneration[J].Bone,2004,34(4):665 - 671.
[14]Marden LJ,Fan RS,Pierce GF,et al.Platelet-derived growth factor inhibits bone regeneration induced by osteogenin,a bone morphogenetic protein,in rat craniotomy defects[J].J Clin Investigation,1993,92(6):2897.

