经皮肝穿刺胆道腔内射频消融联合支架植入治疗恶性梗阻性黄疸(附2例报告)
鲁 东, 吕维富, 肖景坤, 周春泽
恶性梗阻性黄疸可由胰腺癌、胆管癌、胆囊癌、肝癌、转移癌等恶性肿瘤直接侵犯或压迫肝外胆道致胆汁排出受阻而引起[1]。患者对手术的耐受力降低,术后并发症的发生率和病死率较高。对不能手术的患者行姑息性的胆汁引流可迅速缓解黄疸,改善肝功能,临床疗效显著[1-2]。对于预期寿命大于3个月的恶性梗阻性黄疸患者标准治疗为放置自膨式金属支架,然而50%以上患者在支架植入术后6~8个月可因肿瘤生长、上皮增生和胆泥形成等因素致支架阻塞[3-6]。肿瘤通过支架网眼生长或超过支架边缘是造成支架堵塞、黄疸复发的主要原因[7]。对于胆道支架再狭窄可通过在狭窄的支架内行球囊扩张,或再次行支架置入来解决,但同样的问题仍然存在。射频消融(RFA)用于实体肿瘤的治疗已逐渐趋于成熟[8],针对恶性胆道梗阻的双极RFA导管可望成为延长支架通畅时间的有力手段。目前的报道多为内镜下操作[4,8-10],我们通过经皮肝穿刺胆道的途径对2例恶性梗阻性黄疸患者进行了此种新的姑息性治疗手段,现报道如下。
1 材料与方法
1.1 材料
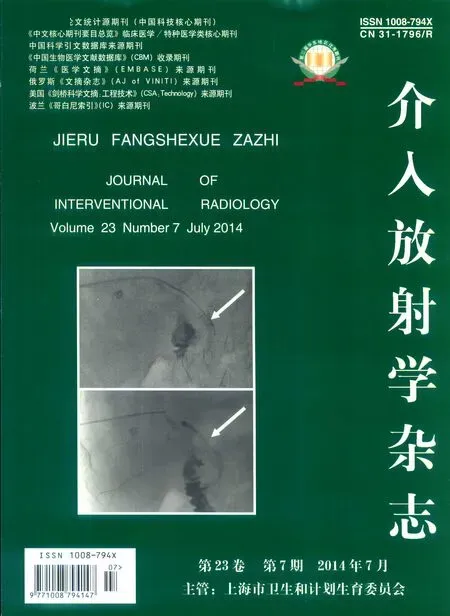
1.1.1 病例概要 例1,患者女,68岁。因“眼黄、尿黄伴皮肤瘙痒1个月”入院,14个月前因肝脏占位行 “左半肝切除+胆管内癌栓取出术”,术后病理“中分化腺癌,考虑胆管源性”。CT扫描提示“肝内复发灶及肝门部淋巴结转移,胆道梗阻”,肝功能:ALT 31 u/L,AST 126 u/L,TBIL 128.4 μmol/L,DBIL 108.0 μmol/L, 癌 抗 原 CA19-9 35.33 u/ml,CEA 1.13 ng/ml。遂给予经皮肝穿刺胆道内引流术,术中胆道造影见“胆总管上段狭窄,肝内胆管及右肝管扩张”,术后1个月患者临床症状消失,复查肝功能:ALT 53 u/L,AST 66 u/L,TBIL 24.3 μmol/L,DBIL 18.5 μmol/L。经胆道引流管行胆道造影示胆总管上段狭窄,给予经皮胆道腔内RFA联合胆道内支架植入治疗(图 1),术后 50 d 肝功能:ALT 26 u/L,AST 38 u/L,TBIL 17.6 μmol/L,DBIL 10.2 μmol/L。

图1 胆道恶性梗阻,RFA联合支架成形治疗前后
例2,患者男,46岁。因“右上腹不适伴眼黄、尿黄半月”入院,上腹部CT增强扫描提示“肝内多发病灶考虑胆管细胞癌,伴门脉右支癌栓,高位胆道梗阻”,MRCP提示“左右肝管明显扩张,肝门区肝总管及胆总管内见团块状稍长T2信号”,腹部B超提示“肝癌伴门脉癌栓,胆总管内实性占位”,肝功能:ALT 128 u/L,AST 78 u/L,TBIL 76.1 μmol/L,DBIL 56.1 μmol/L, 癌 抗 原 CA19-9 61.97 u/ml,CEA 4.98 ng/ml。遂给予经皮肝穿刺胆道内引流术,术中胆道造影见“胆总管中上段及右肝管扩张,其内见充盈缺损”。术后1周给予经皮胆道腔内RFA联合胆道内支架植入治疗 (图2),术后50 d肝功能:ALT 25 u/L,AST 45 u/L,TBIL 20.3 μmol/L,DBIL 10.7 μmol/L。
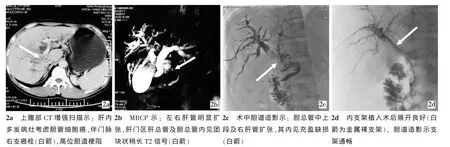
图2 胆管细胞癌胆道阻塞治疗过程
1.1.2 设备器械 影像引导应用GE Innova 3100 DSA机。射频发生器为美国AngioDynamics公司生产的RITA 1500X型射频治疗仪。射频电极为英国EMcision公司生产的HabibTMVesOpen 2800型双极RFA导管,直径5 F(1.6 mm),可通过 0.014英寸导丝,输出功率5~10 W,局部消融温度可达60~100℃。该双极RFA导管长110 cm,头端两个电极长度为6 mm,间隔6 mm,可消融范围2 cm。胆道支架为南京微创医学科技有限公司生产的MTN-DA型镍钛记忆合金裸支架,直径8 mm。
1.2 方法
1.2.1 操作方法 肝右叶胆管穿刺选用右侧腋中线入路,选取右腋中线第8~9肋间作为进针点。在DSA透视引导下,用21 G千叶针穿刺入肝脏,距第11胸椎右缘2 cm处停止,用5 ml注射器抽稀释的对比剂,边注入边后撤穿刺针,直至胆管显影。见树枝状肝内胆管形态,回抽见胆汁即可确认穿刺成功,沿千叶针送入微导丝后沿微导丝送入扩张鞘。经扩张鞘向胆管内注入适量对比剂,以使狭窄部位上端显示。送入0.035英寸超滑导丝后,交换5 F MPA导管。调整导丝通过狭窄段后,将导管沿导丝越过狭窄段并造影使狭窄部位下端显示,以准确判断狭窄段的长度。撤出导管后沿导丝送入胆道内引流管。行胆道腔内RFA时,先撤出胆道内引流管,更换0.014英寸导丝,沿导丝送入6 F导管鞘,经鞘内送入双极RFA导管至胆道狭窄段远端,接射频发生器,功率5 W,消融时间90 s,后撤2 cm后重复上述操作,消融范围覆盖狭窄段全长。撤出导管鞘及RFA导管后交换送入0.035英寸超滑导丝,准确定位后植入胆道内支架。2例患者支架植入后展开良好,均未行球囊扩张。
1.2.2 疗效评价指标 分析比较患者术前及术后定期(术后第3、30、50天)血清胆红素水平、胆道狭窄段的长度及胆道直径;观察介入治疗术后早期及晚期的并发症;术后50 d支架通畅情况。
2 结果
2例患者均在行经皮肝穿刺胆道内引流术后成功接受胆道腔内RFA及内支架植入治疗,技术均获成功。根据胆道狭窄段长度,均行分段RFA(部分消融区域有重叠),例1患者狭窄段长6 cm,消融4次,例2患者狭窄段长8 cm,消融7次。术后3 d黄疸明显消退,血清总胆红素水平显著下降;术后50 d复查血清胆红素水平均正常。2例患者均无胆道出血、胆管穿孔、胆漏等严重并发症发生,术后50 d超声检查均示胆道内支架通畅。
3 讨论
3.1 腔内双极RFA导管及其治疗原理
胆道腔内RFA是新兴的治疗恶性梗阻性黄疸的方法。双极RFA导管可通过经皮肝穿刺胆道及内镜下进行腔内RFA治疗,可造成肿瘤组织的凝固性坏死[11]。研究显示坏死组织作为抗原还能够产生持续性局部炎性反应,活化抗原递呈细胞,诱导肿瘤特异性T淋巴细胞反应,改善机体抗肿瘤免疫耐受状态[12]。在胆道支架植入前通过射频导管对胆道内的肿瘤行腔内消融治疗,可有效减缓腔道周围癌细胞生长,达到长期疏通胆道的目的。
3.2 腔内RFA治疗的疗效和安全性
在猪模型中应用胆道腔内射频导管的实验表明,使胆总管加热和组织凝固的理想功率为5~10 W,消融时间 2 min[13]。 Takao 等[2]采用新鲜离体猪肝研究了不同功率、不同消融时间条件下的效果,功率设置7~10 W,消融时间2 min最合适。较高的功率和更长的消融时间可能使发生并发症的风险增加,最终消融功率和时间应根据肿瘤的大小适当调整。Steel等[5]首先报道了内镜下胆道腔内RFA在人类的应用研究报告。Figueroa-Barojas等[9]对20例患者的25处胆道狭窄行内镜下腔内RFA术,治疗前平均狭窄直径为1.7 mm,治疗后平均直径为5.2 mm。5例患者术后疼痛,只有1例发生轻微的胰腺炎、胆囊炎。Mizandari等[6]的一项多中心回顾性分析表明,在对39例不能手术切除的恶性梗阻性黄疸患者行经皮肝穿刺胆道引流1周后行腔内RFA,无出血、胆管穿孔、胆漏或胰腺炎等并发症发生,中位生存期为89.5 d(14~260 d),中位支架通畅时间为 84.5 d(14~260 d)。何国林等[14]采用经皮肝穿刺胆道内RFA后置入金属内支架治疗胆道梗阻,指出该技术较经内镜下RFA的优点在于:并发症相对较少,不易引起胰腺炎、消化道出血或穿孔等并发症;穿刺较为安全及容易,且可经B超引导,避免了损伤到重要组织及血管;对于高位梗阻来说经皮肝穿刺RFA更为容易。我们应用此新技术治疗的2例患者,消融功率5 W,消融时间90 s,均无腔内RFA相关的严重并发症出现,术后50 d胆道支架均保持通畅,亦验证了其安全性,为患者能够得到进一步针对肿瘤的后续治疗提供了保证。
3.3 胆道腔内RFA治疗的前景
胆道腔内RFA作为治疗不可切除恶性梗阻性黄疸的一种新型微创技术方兴未艾,在恢复胆道通畅及延长胆道金属裸支架的通畅时间方面取得了一定的效果。临床治疗目的主要是看能否解决恶性胆道狭窄以及对延长支架通畅性的影响,目前尚缺乏有效的随机对照试验,以确定胆道腔内的RFA是否比放置塑料或自膨式金属支架的标准治疗更有效。Law等[10]报道了2例可手术切除的继发于胰腺癌的胆道梗阻患者在接受了胆道减压、胆道腔内RFA及金属裸支架植入,随后均接受了胰十二指肠切除术,组织病理学结果表明圆形坏死区域深度仅1.0~1.5 mm,相较于公布的动物实验数据,坏死区明显降低。因此仍需进一步深入研究以确定人体胆道内行腔内RFA的渗透深度。
总体来说,作为恶性梗阻性黄疸介入治疗的一种新方法,该技术的出现和应用,结合了传统胆道支架植入与RFA的特点,发挥了两者的优势,有望成为恶性梗阻性黄疸崭新的治疗手段。
[1] Krokidis M, Hatzidakis A.Percutaneous minimally invasive treatment of malignant biliary strictures: current status [J].Cardiovasc Intervent Radiol, 2014, 37: 316-323.
[2] Itoi T,Isayama H,Sofuni A,et al.Evaluation of effects of a novel endoscopically applied radiofrequency ablation biliary catheter using an ex-vivo pig liver [J].J Hepatobiliary Pancreat Sci, 2012, 19: 543-547.
[3] 夏 宁,程永德,王忠敏.胆道支架再狭窄的介入治疗进展[J].介入放射学杂志, 2014, 23: 82-85.
[4] Monga A, Gupta R, Ramchandani M, et al.Endoscopic radiofrequency ablation of cholangiocarcinoma:new palliative treatment modality (with videos) [J].Gastrointest Endosc,2011, 74:935-937.
[5] Steel AW, Postgate AJ, Khorsandi S, et al.Endoscopically applied radiofrequency ablation appears to be safe in the treatment of malignant biliary obstruction [J].Gastrointest Endosc, 2011, 73: 149-153.
[6] Mizandari M, Pai M, Xi F, et al.Percutaneous intraductal radiofrequency ablation is a safe treatment for malignant biliary obstruction: feasibility and early results[J].Cardiovasc Intervent Radiol, 2013, 36: 814-819.
[7] Eschelman DJ, Shapiro MJ, Bonn J, et al.Malignant biliary duct obstruction:long-term experience with Gianturco stents and combined-modality radiation therapy[J].Radiology, 1996, 200:717-724.
[8] Alis H,Sengoz C,Gonenc M,et al.Endobiliary radiofrequency ablation for malignant biliary obstruction [J].Hepatobiliary Pancreat Dis Int, 2013, 12: 423-427.
[9] Figueroa-Barojas P,Bakhru MR,Habib NA,et al.Safety and efficacy ofradiofrequency ablation in the managementof unresectable bile duct and pancreatic Cancer:a novel palliation technique[J].J Oncol, 2013, 73 : AB127.
[10] Law R, Pai M, Baron TH, et al.The effects of endobiliary radiofrequency ablation in two patients with pancreatic Cancer:Gross and microscopic findings[J].Gastrointestinal Intervention,2013,2:124-126.
[11] Parisi A, Desiderio J, Trastulli S, et al.Liver resection versus radiofrequency ablation in the treatment of cirrhotic patients with hepatocellular carcinoma [J].Hepatobiliary Pancreat Dis Int,2013,12:270-277.
[12] Zerbini A, Pilli M, Fagnoni F, et al.Increased immunostimulatory activity conferred to antigen-presenting cells by exposure to antigen extract from hepatocellular carcinoma after radiofrequency thermal ablation [J].J Immunother, 2008, 31:271-282.
[13] Khorsandi SE,Zacharoulis D,Vavra P,et al.The modern use of radiofrequency energy in surgery, endoscopy and interventional radiology[J].Eur Surg, 2008, 40: 204-210.
[14]何国林,徐小平,周陈杰,等.一种恶性梗阻性黄疸介入治疗的新方法-经皮肝穿刺胆道内射频消融内支架置入术 [J].南方医科大学学报,2011,31:721-723.