表面活性剂脂肪醇聚氧乙烯醚对盐藻的毒性研究
耿庆华,姜 莉,张 侃,丁建峰
(1.沈阳出入境检验检疫局,沈阳 110016;2.大连海洋大学 水产与生命学院,辽宁 大连 116023)
0 引 言
脂肪醇聚氧乙烯醚(AE),又称为聚乙氧基化脂肪醇,是非离子表面活性剂中发展最快、用量最大的品种,广泛用于日常生活中,如在洗涤行业作为洗手液、洗衣液、金属清洗剂等的主要活性成分;在纺织印染行业作为纺织印染助剂起乳化作用;在造纸行业可作为脱墨剂,另外在农药中可作为乳化剂等。随着表面活性剂在人们生活中的大量应用,愈来愈多的表面活性剂会随着废水排放进入水环境中。由于人们环保意识的不断加强,表面活性剂使用的安全性,以及对水环境的污染情况越来越受到关注和重视,人们开始担心含有大量表明活性剂的生活和工业污水是否会对水生动植物造成危害,是否会通过食物链进入到人体而对健康造成危害。因而开展表面活性剂的安全性评价和毒性研究具有很重要的意义。
盐藻(Dunaliellasalina)属绿藻门,绿藻纲,团藻目,盐藻科,盐藻属,是一种单细胞真核藻类。单胞藻具有利用太阳能效率高,营养丰富,生长繁殖迅速等重要特征,因而受到重视。在海洋环境中作为初级生产者,它们光合作用放出大量氧气,是地球上生物圈中的氧气循环的关键环节,并且吸收水中的富营养化成分作为碳源,是水体自净的重要保障,在海洋环境中的地位尤其重要。又因为本研究所选用的盐藻为饵料藻,它作为海洋食物链的低层基石,其受污染的程度直接影响海洋其他动植物的生存环境和健康状况,研究表面活性剂对盐藻的毒性,可以在一定程度反应出表面活性剂对海洋水环境的影响,其意义不言而喻。
因此,本实验利用盐藻作为试验对象,研究不同浓度脂肪醇聚氧乙烯醚对盐藻的毒性作用,为深入了解脂肪醇聚氧乙烯醚对盐藻的毒性作用机制,以及开展对其安全性评价方法的研究提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 实验藻种
实验所用盐藻藻种取自大连海洋大学辽宁省水生生物学重点实验室。培养海水取自大连市黑石礁近岸海域,沉淀后经0.45μm筛网过滤,煮沸消毒,冷却曝气后配制培养液,培养液选用f/2营养盐配方,由大连海洋大学辽宁省水生生物学重点实验室提供。脂肪醇聚氧乙烯醚,使用滤菌海水配制成浓度为1g/100mL的原液。
1.1.2 实验仪器
光照培养箱(GXZ,宁波江南)、超声波细胞破碎仪(scientz,宁波新芝)、低温高速冷冻离心机(三洋,日本)、酶标仪(Bio-Tek,美国)。
1.2 实验方法
1.2.1 盐藻预培养
用于培养盐藻5L三角烧瓶先用次氯酸浸泡24h,冲洗干净后加入过滤海水4L,煮沸10min后自然冷却,加入f/2培养液,接种处于指数生长期的原始盐藻,放入光照培养箱进行培养。设定培养温度为24℃,光照强度2 500~3 500Lux,光照周期:光期/暗期=14hr/10hr,每天上下午各摇瓶1次。试验期间,每天用血球计数板计数,观察盐藻的生长情况。盐藻密度达到时进行分装。
1.2.2 实验盐藻分装
用于实验培养的250mL三角烧瓶先用高压灭菌锅灭菌20min,烘干后分别加入100mL预培养的密度为106个/mL盐藻。分别加入脂肪醇聚氧乙烯醚原液,使其的终浓度分别为0、2.5、5.0、10.0、20.0、40.0mg/L,每组设3组重复。按2.2.1方法进行培养。
1.2.3 藻类细胞计数
实验期间,每天各个培养瓶摇匀后分别吸取藻液1mL,加入5μL鲁哥氏碘液固定后,使用血球计数板,显微镜下进行细胞计数并计算细胞密度。
1.2.4 测定样品前处理
在实验的第9d,每个培养瓶吸取15mL藻液,使用0.45μm的纤维素酯微孔滤膜过滤后用于叶绿素的测定。每组各另取50mL藻液,3 000r/min离心5min后,加入PBS缓冲液2mL,使用超声波细胞破碎仪破碎藻细胞,8 000r/min离心5min,将上清液转移到一个新的EP管中用于后续指标的测定。
1.2.5 叶绿素a含量的测定
叶绿素a的测定参照《海洋检测规范 第七部分:近海污染生态调查和生物监测》(中华人民共和国国家标准[GB 17378.7—2007],由中华人民共和国国家质量监督检验检疫总局和中国国家标准化管理委员会2007-10-18发布,2008-05-01实行)中的分光光度法。将过滤样品的滤膜放入具塞离心管中,加入10mL丙酮溶液(丙酮∶水=900∶100),摇荡,放置于冰箱储存室中24h后,取出,4 000r/min离心10min,将上清液注入比色杯中。用丙酮做参比,分别在630、647、664、750nm波长处测定吸光值,并分别将波长630、647、664nm下测得的吸光值减去750nm下的吸光值,得到校正后的吸光值E630nm、
按下式计算叶绿素a的含量ρ:

式中:V0为样品提取液的体积(mL);V为藻液样品实际用量(L);L为测定池光程(cm)。
1.2.6 可溶性蛋白含量、总谷胱甘肽(T-GSH)含量、丙二醛(MDA)含量、过氧化氢(H2O2)含量和铜-锌超氧化物歧化酶(CuZn-SOD)等含量测定
盐藻可溶性蛋白含量采用考马斯亮蓝法,测定使用南京建成生物工程研究所的蛋白测定试剂盒进行。总谷胱甘肽(T-GSH)含量采用微量酶标法,测定使用南京建成生物工程研究所的谷胱甘肽测试盒(A061-1)进行。丙二醛(MDA)含量使用南京建成生物工程研究所的植物丙二醛(MDA)测定试剂盒进行测定。过氧化氢(H2O2)含量使用分光光度法进行测定,使用南京建成生物工程研究所的过氧化氢(H2O2)测试盒(A064-1)进行测定。铜-锌超氧化物歧化酶(CuZn-SOD)含量使用南京建成生物工程研究所的铜-锌超氧化物歧化酶测定试剂盒进行测定。测定样品使用上述1.2.4中处理后的藻类上清液,具体测定方法参照试剂盒提供的说明书进行。
1.2.7 数据统计
实验数据使用SPASS 20.0软件分析,结果用平均值±标准差(means±SD)表示,均采用单因素方差分析。
2 实验结果
2.1 不同浓度AE对盐藻生长的影响
不同浓度AE对盐藻生长的影响结果如图1所示。在实验的0~192h内,含有浓度为2.0mg/L和4.0mg/L AE组的盐藻生长受到了抑制,其他3个浓度组与对照组比未表现出较强的抑制作用。由以上实验结果得出:较高浓度的AE在短期内对藻类的生长具有一定的抑制作用。
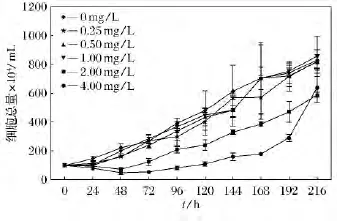
图1 不同浓度AE对盐藻细胞总数影响

图2 不同浓度AE对盐藻叶绿素a含量影响
2.2 不同浓度AE培养下盐藻叶绿素a含量比较
不同浓度AE对盐藻叶绿素a含量影响比较如图2所示。在不同浓度的AE中培养9d后,各组盐藻叶绿素a的含量未表现出显著差异。
2.3 不同浓度AE培养下盐藻可溶性蛋白含量比较
不同浓度AE对盐藻可溶性蛋白含量比较如图3所示。在不同浓度的AE中培养9d后,4.0mg/L AE组盐藻可溶性蛋白含量显著低于对照组和低浓度(0.25mg/L)组(p<0.05)。

图3 不同浓度AE对盐藻可溶性蛋白含量影响
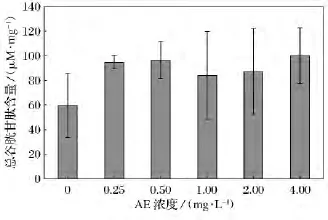
图4 不同浓度AE对盐藻总谷胱甘肽(T-GSH)含量影响
2.4 不同浓度AE培养下盐藻总谷胱甘肽(T-GSH)含量比较
不同浓度AE对盐藻T-GSH含量比较如图4所示。在培养9d后,不同浓度的AE中盐藻T-GSH的含量较对照组都有所升高,但各组与对照组比较差异不显著。
2.5 不同浓度AE培养下盐藻丙二醛(MDA)含量比较
经不同浓度AE处理的盐藻 MDA含量比较如图5所示。0.25mg/L组和4.0mg/L组与1.0mg/L组相比差异较大,且差异显著(p<0.05);其他各组之间差异不显著。
2.6 不同浓度AE培养下盐藻过氧化氢(H2O2)含量比较
经不同浓度AE处理的盐藻H2O2含量比较如图6所示。2.0mg/L组和4.0mg/L组与0.25mg/L组和0.5mg/L相比差异显著(p<0.05);其他各组之间差异不显著。

图5 不同浓度AE对盐藻丙二醛(MDA)含量影响

图6 不同浓度AE对盐藻过氧化氢(H2O2)含量影响
2.7 不同浓度AE培养下盐藻铜-锌超氧化物歧化酶(CuZn-SOD)含量比较
经不同浓度处理后,盐藻中CuZn-SOD含量的比较如图7所示。浓度为0.25mg/L和1.0 mg/L组显著低于对照组和0.25mg/L组(p<0.05);浓度4.0mg/L组显著高于与0.25、0.5和1.0mg/L组(p<0.05)。

图7 不同浓度AE对盐藻铜-锌超氧化物歧化酶(CuZn-SOD)含量影响
3 讨 论
表面活性剂(又称界面活性剂)是指能使目标溶液表面张力显著下降的物质,以及降低两种液体之间表面张力的物质。根据其在水中的电离性状,合成表面活性剂可分为:阴离子型、阳离子型、非离子型和两性电解质型4大类。非离子表面活性剂在水中不会解离,是中性化合物,其亲水部分都含有羟基及多个醚键[1]。不与金属离子或硬水作用,对酸碱也较稳定,是一类在表面活性剂的开发研究的进程中属于新兴的类别,本实验所采用的脂肪醇聚氧乙烯醚就是属于此类,广泛用于洗涤行业、纺织印染行业、造纸行业和农药中等日常生活的方方面面[2]。近年来,随着人们环保意识的日益提高,同时由于生活工业污水等导致的环境灾害事件频发,对包括表面活性剂在内的化学制剂的安全问题为越来越多的研究人员所重视,人们担心含有大量活性剂的生活和工业污水是否会对水生动植物造成危害,并通过食物链进入到人体而对健康造成危害。有研究表明:虽然聚氧乙烯类非离子型表面活性剂本身的毒性较低,但是某些种类聚氧乙烯类非离子型表面活性剂代谢产物的毒性很高,能够对水生生物造成危害,如壬基酚聚氧乙烯醚的降解产物NP(烷基酚)是美国环境保护局出的70种环境激素的化学物质之一,具有致癌性、致畸性和致突变性,对水生生物具有一定的毒性作用[3]。
此前研究认为,脂肪醇聚氧乙烯醚(AE)结构稳定,是毒性最低的一类,对水生生物没有表现出毒性[5]。但本研究中发现,较高浓度的AE(2.0mg/L和4.0mg/L)对盐藻的生长表现出了一定的抑制作用。同时,4.0mg/L AE组盐藻可溶性蛋白含量显著低于对照组和0.25mg/L浓度组。表明高浓度AE抑制藻类生长和细胞内蛋白质的合成。其作用机理可能是由于AE具有强表面活性,容易吸附在具有膜层结构的藻细胞器表面,而影响和破坏其正常功能,导致整个细胞死亡[6]。另外,亦可能由于本研究使用的脂肪醇聚氧乙烯醚为工业用原料,可能含有其他对藻类生长具有抑制作用的成分导致。
藻类细胞3种色素包括叶绿素a、b和c 3种,其中尤以叶绿素a变化较为敏感,因此一般作为生理毒性指标。研究已经证实:水环境中的重金属和有机污染物可以通过高浓度胁迫引起叶绿体膨胀破裂,类囊体膜解体和抑制叶绿素酸酯还原酶活性和影响氨基-γ-戊酮酸的合成两条途径而导致藻类叶绿素含量减少[7]。但在本研究中,虽然各浓度AE处理组盐藻的生长速度不同,但叶绿素a的含量并未表现出显著差异。这与周晓见的研究结果相一致,其原因可能是由于高浓度的AE导致脱镁叶绿素a的含量显著增加,说明表面活性剂胁迫下的藻类产生大量的脱镁叶绿素,其游离于细胞之外,所以虽然细胞密度低,但叶绿素a含量却很高[8]。
本研究中,盐藻AE处理组中的CuZn-SOD活性的表现出不同的变化,其中AE浓度为0.25mg/L和1.0mg/L组盐藻CuZn-SOD活性显著低于对照组(p<0.05),而AE浓度4.0mg/L组盐藻CuZn-SOD活性显著高于与0.25、0.5和1.0mg/L组(p<0.05)。有研究表明:长时间较低浓度的污染物或者毒性较低的污染物对藻类相关酶活性会产生先诱导激活而后抑制的过程[9-10]。本研究0.25 mg/L和1.0mg/L组盐藻CuZn-SOD活性显著低于对照组,其原因可能是由于实验周期较长而导致CuZn-SOD活性被抑制的结果。而4.0mg/L组盐藻CuZn-SOD活性表现出较强的活性,可能是由于高浓度胁迫导致盐藻细胞内产生过多的氧离子自由基诱导的结果。李睿等研究发现双酚A对微藻SOD具有低浓度和高浓度诱导两种现象[11],这与本研究所使用AE对盐藻CuZn-SOD活性影响的结果相一致。
GSH作为一种抗氧化剂,是抗氧化系统的重要成分,谷胱甘肽系统中的各种抗氧化酶酶均以其为中心起作用。在本研究中,虽然各浓度AE处理组盐藻T-GSH未表现出显著差异,但是与对照组相比都有一定程度增加的趋势。姜爽等相关研究发现,两种多溴联苯醚BDE-47和BDE-209胁迫下米氏凯伦藻GPx、GST、GR的活性出现先诱导激活而后抑制的过程[12]。表明GSH活性变化与胁迫时间有关,本研究出现的GSH升高现象应该与AE的胁迫有关。
H2O2作为藻类抗氧化系统中的一个中间产物,其变化可以反映机体抗氧化酶系统和非酶系统性能的状态,从总体上反映机体防御体系抗氧化能力的高低[13]。而田丹等使用重金属镉胁迫小球藻和湛江等鞭金藻时发现,这两中微藻内H2O2含量均出现了增加的过程[22]。而本研究中盐藻H2O2含量在2个较低浓度处理组(0.25mg/L组和0.5mg/L)出现了增加的过程,这与上述研究的结果一致。而经2个较高浓度(2.0mg/L和4.0mg/L)AE处理的盐藻H2O2含量却出现了减少的现象,其原因可能是由于处理时间较长一部分藻细胞死亡所致,本研究中对盐藻的计数结果也证实了这一可能。
活性氧能够将脂肪酸转化为有毒的过氧化物,破坏生物膜,造成MDA累积,因此MDA作为脂质过氧化的产物,可作为植物脂质过氧化的指标[14]。本研究中各处理组盐藻MDA与对照组相比并未表现出显著的差异,但0.25、0.5和1.0mg/L浓度组 MDA表现出随处理浓度升高的过程,且1.0mg/L处理组盐藻MDA浓度显著高于0.25mg/L浓度处理组,这与田丹等使用重金属镉胁迫小球藻和湛江等鞭金藻MDA的变化趋势相一致[13]。而2.0mg/L浓度组和4.0mg/L浓度处理盐藻 MDA测定含量较低也可能与藻细胞数量较少有一定的关系。
本研究证实了不同浓度活化剂脂肪醇聚氧乙烯醚对盐藻的生长具有抑制作用,导致体内活性氧含量、抗氧化酶CuZn-SOD活性、以及GSH和MDA等含量发生变化,初步证实AE对盐藻具有一定的毒性作用,为活化剂AE的合理使用和安全评价提供了理论依据。
[1]王学川,邱白玉.表面活性剂的毒性问题[J].日用化学品科学,2005,28(6):22-26.
[2]牛金平,王军.新型表面活性剂的结构特点与物化性能[J].日用化学品科学,2000,23(2):1-4.
[3]陈小泉,古国榜.烷基酚聚氧乙烯醚的环境行为和环境风险评价[J].日用化学工业,2001,12(6):30-33.
[4]秦松,林光恒.化学诱变剂在实验海洋食物链中的流动以及遗传毒性的检测Ⅰ.无机诱变剂镉(Ι)镉在褐指藻中的吸着与积累[J].癌变· 畸变· 突变,1992,4(4):1-5.
[5]袁平夫,廖柏寒,卢明.表面活性剂 (LAS&NIS)的环境安全性评价[J].安全与环境工程,2004,11(3):31-34.
[6]陈孝花.除藻剂对黄丝藻藻华叶绿素a含量和抗氧化酶活性的影响[D].上海:上海海洋大学,2011.
[7]向蓓,赵文,王媛,等.Cd(Ⅱ)胁迫对盐藻生长,抗氧化系统及线粒体膜电位的影响[J].大连海洋大学学报,2012,27(1):64-68.
[8]周晓见.表面活性剂对海洋微藻的生理生化影响[D].大连:大连海事大学,2000.
[9]彭金良,严国安,沈国兴,等.a-萘酚对小球藻谷胱甘肽及其还原酶的影响[J].中国环境科学,2001,21(2):140-143.
[10]马剑敏,蔡林林,胡灵卫,等.溴化1-己基-3-甲基咪唑对斜生栅藻谷胱甘肽及其代谢酶的影响[J].水生生物学报,2009,33(4):696-701.
[11]李睿,刘玉,谭凤仪,等.双酚 A对微小小环藻的毒性效应[J].中山大学学报:自然科学版,2006,45(3):110-113.
[12]姜爽.两种多溴联苯醚对四种海洋微藻的毒性效应研究[D].青岛:中国海洋大学,2011.
[13]庞战军,周玫,陈瑗.自由基医学研究方法[M].北京:人民卫生出版社,2000.
[14]何俊瑜,任艳芳,朱诚.镉胁迫对镉敏感水稻突变体活性氧代谢及抗氧化酶活性的影响[J].生态环境,2008,17(3):1004-1008.

