注射用布氏菌活疫苗免疫学评价
陈成,魏东,李恪梅,付丽丽,解晓露,黄长江,王国治
注射用布氏菌活疫苗免疫学评价
陈成,魏东,李恪梅,付丽丽,解晓露,黄长江,王国治
325035 温州医科大学环境与公共卫生学院(陈成、付丽丽、解晓露、黄长江、王国治);100050 北京,中国食品药品检定研究院结核病疫苗室(魏东、李恪梅、王国治)
以小鼠为动物模型,通过检测布氏菌活疫苗免疫小鼠产生的体液免疫、细胞免疫应答及保护力,对其进行免疫学评价。
将 30 只小鼠随机分为 3 组,皮下免疫布氏活疫苗,免疫 4 周后分离血清及脾脏淋巴细胞。ELISA法检测免疫动物血清中总 IgG 抗体,抗体亚类 IgG1 及 IgG2a;ELISPOT 法检测分泌 IFN-γ、IL-4 的脾脏淋巴细胞数目,以及用 ELISA 方法检测体外再刺激后小鼠脾细胞分泌 IFN-γ、IL-4 的细胞因子水平;用羊布氏菌弱毒株 M5 攻击免疫动物,通过脾脏细菌计数评价布氏活疫苗的免疫保护作用。
用ELISA 法检测到免疫布氏活苗的小鼠体内有特异性抗体产生;ELISPOT 可检测到较高的分泌IFN-γ 脾脏淋巴细胞数目,ELISA 方法可检测到较高的 IFN-γ 水平,表明布氏活疫苗主要诱导 Th1 型免疫应答;通过布氏活疫苗保护力分析,表明该疫苗具有较好的免疫保护效果。
布氏疫苗采用注射免疫途径是可行的,免疫后能获得较好的免疫效果。
布氏疫苗; 抗体生成; 免疫活性
布氏菌病(Brucellosis,简称布病)是布氏菌引起的能够在人和动物中传播的一类人兽共患病[1-3]。布氏菌具有侵袭力强、传染途径多、引起多器官损伤的特点。家畜感染后如果得不到良好的治疗可引发母畜流产和不育,人感染则主要引起波浪热和转化为慢性感染[4-5]。据调查,全球已有 170 多个国家和地区有布病发生和流行[6]。而我国 28 个省市区的人、畜有布病存在和流行[7],每年造成近千万元损失。
疫苗接种是防治布病最有效、最经济的手段。布氏疫苗主要包括灭活苗、减毒活疫苗、菌体组分疫苗以及现在热门研究的基因疫苗和重组蛋白疫苗等[8]。目前,我国采用的人用布氏菌活疫苗[9]为牛种弱毒株104M菌株,接种方式为皮上划痕。该方法操作复杂、不能定量接种,人群接种阳转率低,保护效果有限,被接种者因划痕产生疼痛而不易被接受,从而影响疫苗的广泛使用。鉴于布病疫情控制的需要,我们采用具有经济性好和安全性高的皮内注射接种方式替代传统的皮上划痕。本次研究以小鼠为动物模型,采用皮内注射方式免疫,从体液免疫、细胞免疫和保护力试验三个方面的结果全面评价疫苗的免疫原性和免疫保护效果。
1 材料与方法
1.1 主要材料
1.1.1 动物 SPF 级 BALB/c 小鼠,6 ~ 8 周,白色雌性,共 30 只,由中国食品药品检定研究院(简称中检院)实验动物中心提供,实验动物生产许可证号:SCXK(京)2009-0017,饲养于中检院清洁级动物室。
1.1.2 菌种 皮下注射用布氏菌活疫苗及羊布氏菌 M5 弱毒株均由中检院结核病疫苗室提供。
1.1.3 实验仪器 Bio-II-A 生物安全柜购自西班牙 Telstar 公司;Dragon-MK3 酶标仪购自芬兰 Labsystems 公司;DH6000 AB 型恒温培养箱购自天津市泰斯特仪器公司;高速离心机购自德国 Eppendorf 公司;酶联斑点分析仪购于美国 CTL 公司;CO2培养箱购于美国 Napco 公司;加样枪购于 Gilson 公司。
1.1.4 试剂耗材 牛血清白蛋白和 ConA 购自美国 Sigma 公司;小鼠IFN-γ 酶联免疫试剂盒购自美国BD 公司;达优-淋巴细胞分离液、无血清培养基、IFN-γ 及 IL-4 ELISA 预包被试剂盒均购自达科为生物技术公司;碱性磷酸酶标记羊抗小鼠 IgG、IgG1、IgG2a 购自美国 Bethyl 公司;pNPP 底物显色液购自美国 SurModics 公司。
1.2 方法
1.2.1 动物分组及免疫 将 30 只 BALB/c 小鼠随机分成 3 组,每组 10 只,分别为低剂量组(5 × 107/只),高剂量组(2 × 108/只),生理盐水对照组,3 组均为后肢皮下注射,剂量为 0.2 ml/只。
1.2.2 动物血清和脾脏淋巴细胞的制备 免疫4 周后,对每只小鼠进行摘眼球取血,分离血清,–20 ℃保存,用于ELISA 体液免疫检测。将每只动物无菌取出的脾脏放在筛网上,滴加淋巴细胞分离液研磨,研磨液用巴氏管吸入到 15 ml 离心管中,滴加 200 ~ 500 μl 达优无血清培养基进行低速梯度离心,在 25 ℃条件下,800 ×离心 30 min,吸出淋巴细胞层,加入 10 ml 无血清培养基,颠倒洗涤,室温、250 ×离心收集细胞,用于 ELISPOT 细胞免疫的检测。
1.2.3 体液免疫检测
1.2.3.1 抗菌体抗原总 IgG 抗体水平检测 用间接 ELISA 法检测小鼠血清 IgG 的效价。以灭活布氏菌体 5 × 108/ml 的浓度包被 96 孔酶标板,4 ℃过夜;以 TBS-T 300 μl 洗板 5 次,用 1% 的 BSA 封闭(200 μl/孔),37 ℃静置 1 h;每孔加入 100 μl 的 50 × 开始倍比稀释的待检血清,37 ℃静置 1 h;按 1:1000 倍稀释碱性磷酸酶标记山羊抗小鼠 IgG,洗板后 100 μl/孔加入,37 ℃静置1 h;洗板,加入 100 μl/孔的 pNPP 底物显色液,室温避光 30 min 后加入 100 μl/孔终止液(3 mol/L NaOH)终止反应;在波长为 405 nm 处检测吸光值405。
1.2.3.2 抗菌体抗原 IgG 抗体亚类检测 以灭活布氏菌体 5 × 108/ml 的浓度包被 96 孔酶标板,小鼠免疫 4 周后血清为一抗,碱性磷酸酶标记山羊抗小鼠 IgG1、IgG2a 为二抗,其余操作步骤同 1.2.3.1。
1.2.4 细胞免疫检测
1.2.4.1 分泌 IFN-γ、IL-4 的脾脏淋巴细胞的数目检测 小鼠免疫 4 周后,分离小鼠脾脏淋巴细胞,取 96 孔细胞培养板,每孔中加混有 2.0 × 106个/ml 浓度细胞 100 μl,每孔分别加入 100 μl 布氏 PPD 抗原(终浓度为 5 μg/ml 和 10 μg/ml)和灭活菌体抗原(终浓度为 1 × 108/ml 和 1 × 107/ml)。每种抗原刺激物做复孔,另用细胞培养液作阴性对照,一孔加 ConA 作阳性对照(终浓度为 5 μg/ml)。共同孵育 16 h 后,按 ELISPOT 操作依次加入检测抗体等试剂,洗板,显色,计数斑点数。
1.2.4.2 体外再刺激免疫小鼠脾细胞因子产生水平检测 取 48 孔细胞培养板,每孔中加 2.0 ×106个/ml 浓度细胞 400 μl,每孔分别加入 50 μl 布氏 PPD 抗原(终浓度为 5 μg/ml 和 10 μg/ml)和灭活菌体抗原(终浓度为 1 × 108/ml 和 1 × 107/ml)。分别以 ConA(终浓度为 5 μg/ml)和培养基为阳性和阴性对照。37 ℃,5% CO2培养箱中孵育 18 h,孵育完毕对培养物进行离心,取各孔细胞培养液上清,用小鼠 IFN-γ、IL-4 ELISA 试剂盒检测体外不同刺激物刺激小鼠脾细胞分泌 IFN-γ、IL-4 的情况。
1.2.5 布氏菌活苗保护力检测 在小鼠免疫 4 周后,各组取 5 只小鼠,对每只小鼠皮下攻击羊种布氏菌 M5 弱毒株,攻击剂量为 5 × 108cfu/只,4 周后无菌取脾脏,通过脾脏细菌计数评价布氏活苗的免疫保护作用。
1.3 统计学处理
2 结果
2.1 小鼠血清中抗菌体抗原总 IgG 水平测定
小鼠血清用间接 ELISA 方法测抗体水平,结果显示,阴性组小鼠检测不到特异性抗体,低剂量组和高剂量组小鼠均可检测出,但低剂量组抗体水平略高于高剂量组,经统计学分析两者差异无统计学意义(= 1.890,= 0.095 > 0.05,n = 10),结果见图 1。
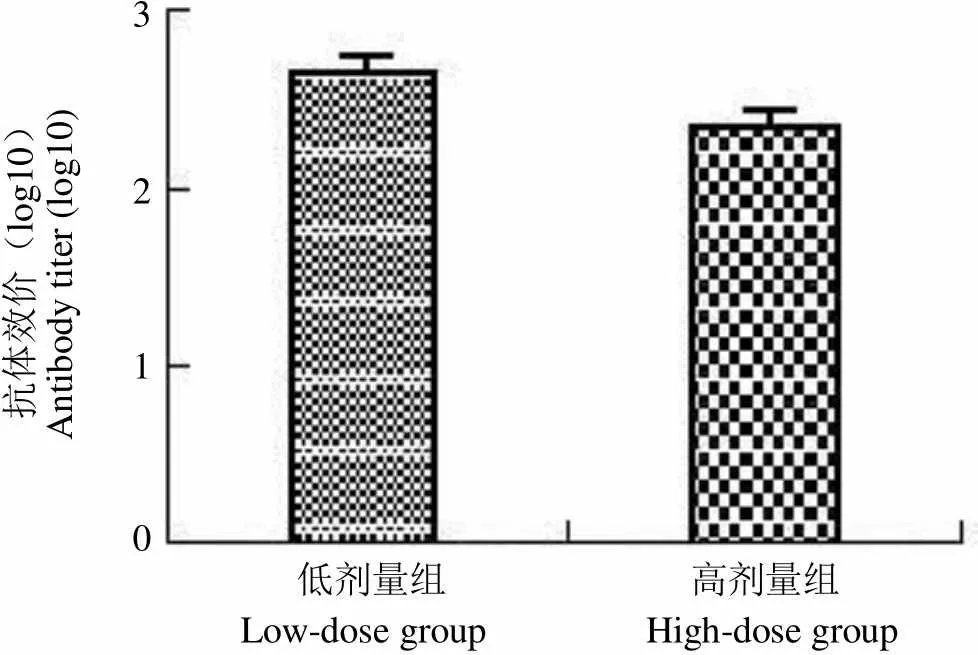
抗体效价(log10)Antibody titer (log10)3 2 1 0 低剂量组 高剂量组 Low-dose group High-dose group
Figure 1 The serum IgG antibody titer
2.2 抗菌体抗原抗体亚类测定
抗体亚类分析结果显示免疫组小鼠均产生特异性 IgG1、IgG2a 抗体,两者的水平相近,结果见图 2。
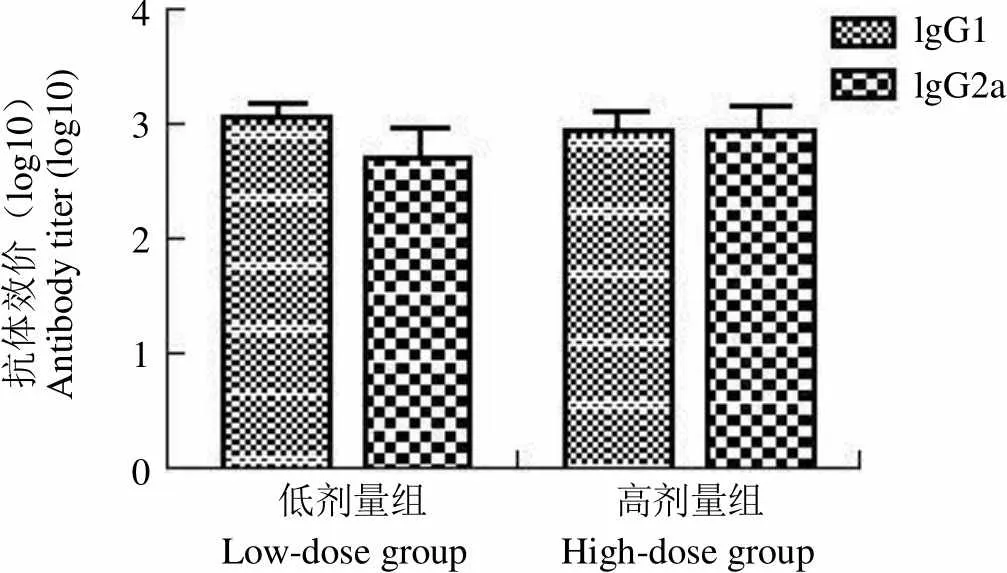
抗体效价(log10)Antibody titer (log10)4 3 2 1 0lgG1lgG2a 低剂量组 高剂量组 Low-dose group High-dose group
Figure 2 Serum IgG1, IgG2a antibody titer
2.3 ELISOPT 结果
将已形成斑点的 96 孔板终止反应,自然风干过夜后上机计数并拍照,对每孔内的斑点进行质控。最终斑点计数显示低剂量组和高剂量组在不同浓度的 PPD 和灭活菌体抗原刺激下分泌 IFN-γ、IL-4 的脾脏淋巴细胞数明显多于阴性对照组,差异有统计学意义(< 0.05),结果见图 3、4。
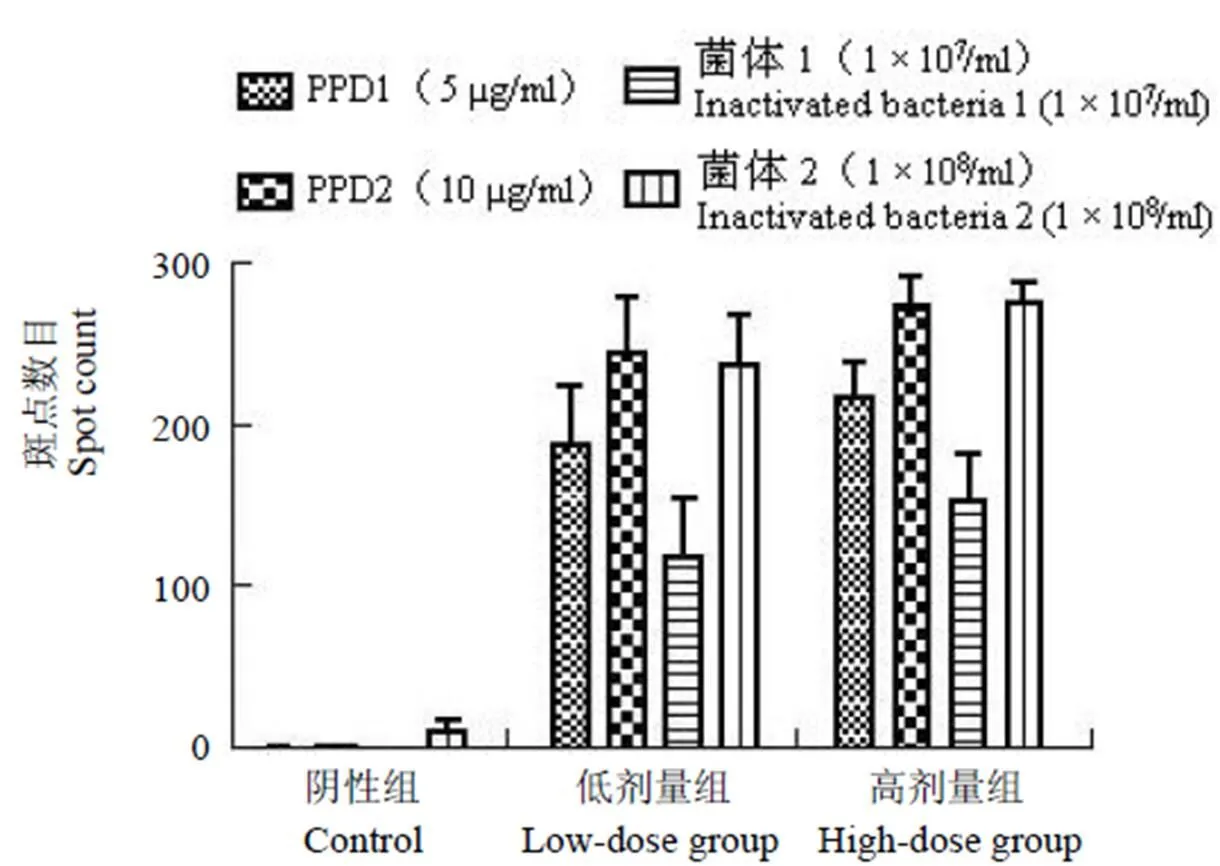
图 3 不同刺激物刺激淋巴细胞分泌 IFN-γ 斑点数目
Figure 3 Different stimulator lymphocytes secreted IFN-γ spot count
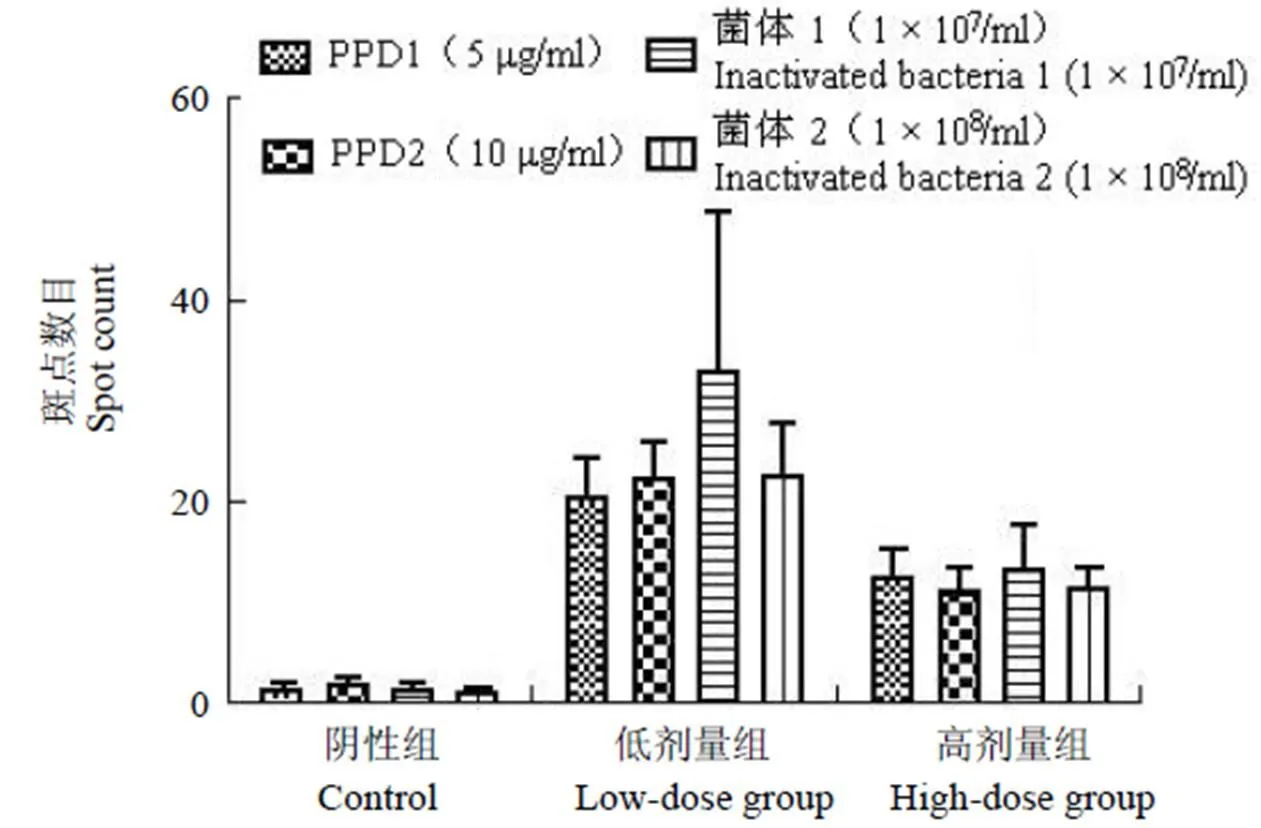
图 4 不同刺激物刺激淋巴细胞分泌 IL-4 斑点数目
Figure 4 Different stimulator lymphocytes secreted IL-4 spot count
2.4 体外再刺激免疫小鼠脾细胞因子检测结果
利用 ELISA 方法检测以 PPD 抗原(5 μg/ml,10 μg/ml)和灭活菌体抗原(1 × 108/ml,1 × 107/ml)体外刺激小鼠脾细胞分泌 IFN-γ、IL-4 水平。结果显示,在不同浓度 PPD 和灭活菌体抗原刺激下分泌的 IFN-γ 的含量明显高于阴性组,差异有统计学意义(< 0.05),结果见图 5。IL-4 含量很低,达不到标准曲线的检测限,结果没有统计学意义。
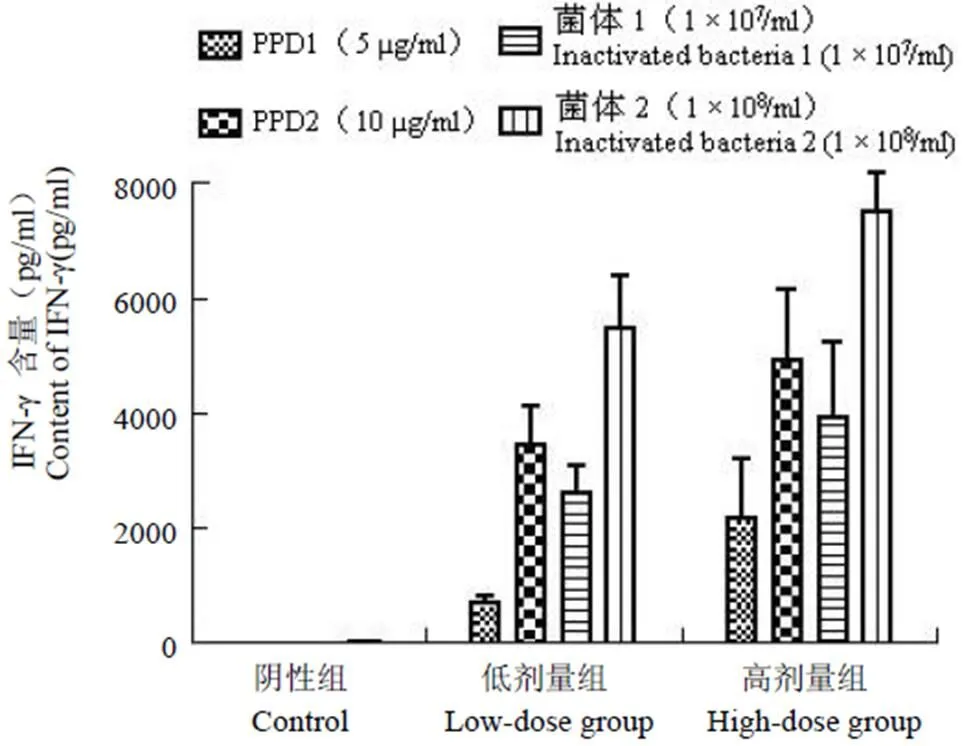
图 5 不同刺激物体外再刺激小鼠脾细胞分泌 IFN-γ 的含量
Figure 5 Different stimulator stimulated mouse spleen cells of IFN-γ secretion
2.5 布氏菌活苗免疫保护力结果
为评价布氏菌活疫苗的保护力,用羊布氏菌M5 弱毒株皮下攻击免疫动物,以脾脏布氏菌分离数为指标,评价保护力,结果见图 6。低剂量免疫组小鼠脾脏的细菌载量与阴性对照组比较有显著性差异(= 4.406,< 0.05,n = 9),高剂量免疫组小鼠脾脏的细菌载量与阴性对照组比较有显著性差异(= 3.842,< 0.05,n = 8)。说明小鼠免疫布氏菌活苗获得很好的免疫保护。
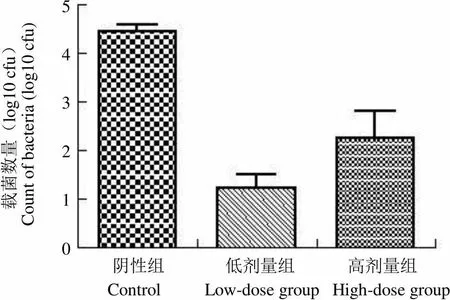
载菌数量(log10 cfu)Count of bacteria (log10 cfu)5 4 3 2 1 0 阴性组 低剂量组 高剂量组 Control Low-dose group High-dose group
3 讨论
机体对布氏菌的清除依赖于体液免疫和细胞免疫的联合作用。体液免疫产生的抗体在细胞外能够阻断布氏菌与宿主细胞间相互作用,并将其包裹起来抑制菌体释放内毒素[10];在胞内阻止细菌在宿主细胞内的复制繁殖。本试验以低、高剂量免疫布氏活疫苗,检测免疫 4 周后血清抗体,结果显示,低剂量组和高剂量组小鼠可检测到高滴度特异性抗体,低、高剂量组 IgG 效价几何均数分别为 459、229。由此可见,产生特异性抗体滴度比较低,说明体液免疫水平相对较弱。抗体亚类分析结果显示免疫组小鼠均产生特异性 IgG1、IgG2a 抗体,两者抗体水平相近。
布氏菌是胞内寄生菌,细胞免疫对杀灭布氏菌起关键作用。布氏菌感染宿主后被 APC 提呈给吞噬细胞,同时激发 APC 分泌 IL-12、IL-4 细胞因子,引起 Th0 细胞(CD4+)分别分化 Th1 和 Th2 细胞[11-12]。Th1 细胞分泌 IFN-γ 激活吞噬细胞的吞噬功能,参与细胞免疫;Th2 细胞分泌 IL-4 细胞因子主要参与体液免疫。本研究,分别用 ELISOPT 和 ELISA 方法对不同浓度的 PPD 和灭活菌体抗原刺激下分泌 IFN-γ 和 IL-4 脾淋巴细胞数目和含量进行检测。ELISOPT 结果显示,与阴性组比较,实验组在不同浓度的两种刺激物下分泌 IFN-γ、IL-4 脾淋巴细胞数目均有统计学差异;ELISA 结果显示,与阴性组比较,实验组在不同浓度的两种刺激物体外刺激分泌 IFN-γ 含量有显著差异,IL-4 含量很低。实验结果充分说明布氏菌疫苗免疫小鼠诱导(CD4+)向 Th1 细胞的分化,机体主要以细胞免疫为主。
疫苗的效力测定实验是评价疫苗免疫保护性最可靠指标。传统对布氏疫苗的研究主要是使用豚鼠,效力实验用强毒株攻击,本次研究参照《中国药典》效力测定的方法[13],以小鼠为动物模型,羊布氏菌 M5 弱毒株攻击,大大提高了实验的经济性和安全性。试验结果显示,免疫组小鼠脾脏的细菌载量与阴性对照组比较有显著性差异,说明小鼠皮下免疫布氏菌活疫苗获得很好的保护效果。另外,由于小鼠皮上划痕不易操作,无法加入传统的划痕疫苗对照,该比较研究将进一步以豚鼠为模型进行探索。
本次试验是对皮下免疫效果的初步研究,试验表明,布氏疫苗采用皮下免疫途径是可行的,免疫后能获得很好的免疫原性,注射用布氏活苗有希望代替皮上划痕用疫苗,不但接种方式简单,而且接种剂量更低,但能否真正取代传统划痕疫苗,还有待强毒布氏菌攻击保护试验和临床试验进一步研究。
[1] Cutler SJ, Whatmore AM, Commander NJ. Brucellosis--new aspects of an old disease. J Appl Microbiol, 2005, 98(6):1270-1281.
[2] Godfroid J, Cloeckaert A, Liautard JP, et al. From the discovery of the Malta fever's agent to the discovery of a marine mammal reservoir, brucellosis has continuously been a re-emerging zoonosis. Vet Res, 2005, 36(3):313-326.
[3] Pappas G, Akritidis N, Bosilkovski M, et al. Brucellosis. N Engl J Med, 2005, 352(22):2325-2336.
[4] Franco MP, Mulder M, Gilman RH, et al. Human brucellosis. Lancet Infect Dis, 2007, 7(12):775-786.
[5] Greenfield RA, Drevets DA, Machado LJ, et al. Bacterial pathogens as biological weapons and agents of bioterrorism. Am J Med Sci, 2002, 323(6):299-315.
[6] Schurig GG, Sriranganathan N, Corbel MJ. Brucellosis vaccines: past, present and future. Vet Microbiol, 2002, 90(1-4):479-496.
[7] Mense MG, Van De Verg LL, Bhattacharjee AK, et al. Bacteriologic and histologic features in mice after intranasal inoculation of Brucella melitensis. Am J Vet Res, 2001, 62(3):398-405.
[8] Olsen SC, Waters WR, Stoffregen WS. An aerosolized Brucella spp. challenge model for laboratory animals. Zoonoses Public Health, 2007, 54(8):281-285.
[9] Cheville NF, Olsen SC, Jensen AE, et al. Effects of age at vaccination on efficacy of Brucella abortus strain RB51 to protect cattle against brucellosis. Am J Vet Res, 1996, 57(8):1153-1156.
[10] Clavareau C, Wellemans V, Walravens K, et al. Phenotypic and molecular characterization of a Brucella strain isolated from a minke whale (Balaenoptera acutorostrata). Microbiology, 1998, 144(Pt 12): 3267-3273.
[11] Murphy EA, Sathiyaseelan J, Parent MA, et al. Interferon-gamma is crucial for surviving a Brucella abortus infection in both resistant C57BL/6 and susceptible BALB/c mice. Immunology, 2001, 103(4): 511-518.
[12] Sriranganathan N, Boyle SM, Schurig G, et al. Superoxide dismutases of virulent and avirulent strains of Brucella abortus. Vet Microbiol, 1991, 26(4):359-366.
[13] Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China. Volume 3, 2005. Beijing: Chemical Industry Press, 2005:77-79. (in Chinese)
国家药典委员会. 中华人民共和国药典. 2005年版三部. 北京: 化学工业出版社, 2005:77-79.
Evalution of immunogical response of livevaccine for injection
Chen Cheng, Wei Dong, LI Ke-mei, FU Li-li, XIE Xiao-lu, HUANG Chang-jiang, Wang guo-zhi
To evaluate the immune response of livevaccine for intradermal injection, which detect humoral immunity and cellular immune responses in mice.
Mice were randomly divided into 3 groups with intradermal immune livevaccine, After 4 weeks, blood was sampled and spleen lymphocytes were separated. Then serum ELISA was used to detect the immune animal total IgG antibody, IgG1, IgG2a The number of spleen lymphocytes with secretion of IFN-γ, IL-4 was examined by ELISPOT. ELISA method was adopted to detect the level of cytokines IFN-γ, IL-4 from spleen cells after restimulation. AfterM5 infected animals, the spleen were isolated in sterile. The acquired immune protection of immunevaccine was evaluated through the bacteria count of spleen.
The ELISA results showed that there exerted specific antibodies in mice infected by immune livevaccine. The number of spleen lymphocytes with secretion of INF-gwas increased through ELISPOT assay. The level of IFN-γ was higher than the control after detection of ELISA method. From this, livevaccine for intradermal injection mainly induced type TH1 immune response. The results from analysis of protection force of livevaccine demonstrated that the vaccine produced strong immune protection.
The method of livevaccine for intradermal injection is feasible, which can get intensively immunogenicity.
Brucella vaccine; Antibody formation; Immunocompetence
WANG Guo-zhi, Email: tbtestlab@vip.tom.com
10.3969/cmba.j.issn.1673-713X.2014.03.006
“重大新药创制”国家科技重大专项(2014ZX09304311-002)
王国治,Email:tbtestlab@vip.tom.com
2013-11-13
Author Affiliations: Department of Enviromental and Public Health Biology, Wenzhou Medical College, Wenzhou 325035, China (Chen Cheng, FU Li-li, XIE Xiao-lu, HUANG Chang-jiang, WANG Guo-zhi); Division of Tuberculosis Vaccines, National Institutes for Food and Drug Control, Beijing 100050, China (Wei Dong, LI Ke-mei, Wang guo-zhi)

