丰肉结海绵相关真菌产黄青霉HLS111菌株活性代谢产物研究
巩婷,孙传英,甄心,邱君志,杨金玲,朱平
丰肉结海绵相关真菌产黄青霉HLS111菌株活性代谢产物研究
巩婷,孙传英,甄心,邱君志,杨金玲,朱平
100050 北京,中国医学科学院北京协和医学院药物研究所天然药物活性物质与功能国家重点实验室/国家卫生和计划生育委员会天然药物生物合成重点实验室(巩婷、甄心、杨金玲、朱平);350002 福州,福建农林大学生命科学学院(孙传英、邱君志)
对我国南海水域丰肉结海绵相关真菌产黄青霉菌HLS111 的活性代谢产物进行研究。
采用 HPLC-DAD 技术与活性筛选相结合的方法,通过硅胶柱、凝胶柱及 HPLC 等色谱方法对HLS111 发酵产物进行分离纯化;通过核磁共振、质谱等波谱分析手段对分离得到的化合物进行结构鉴定;并对单体化合物进行抗肿瘤、抗 HIV、抗炎活性测定。
分离得到 12 个化合物。其中 2 个黑麦酮酸类化合物:黑麦酮酸F(1)和D(2);4 个生物碱类化合物:环(L-色氨酸-L-苯丙氨酸)(3)、citreoindole(4)、meleagrin(5)、脑苷脂B(6);4 个甾体类化合物:麦角甾醇(7)、(22E,24R)-5α,8α-过氧化麦角甾-6,22-烯-3β-醇(8)、globosterol(9)、β-谷甾醇(10);1 个三萜类化合物:24-亚甲基环木菠萝烷醇-反式阿魏酸(11);1 个蒽醌类化合物:大黄素(12)。对化合物 4 的氢谱、碳谱数据进行了归属。初步的药理研究表明,黑麦酮酸类化合物表现出较强的抗肿瘤活性,化合物 citreoindole 表现出一定的抗 HIV 及抗炎活性。
海绵相关真菌产黄青霉 HLS111 菌株体现了次生代谢产物化学结构的多样性;黑麦酮酸类化合物为产黄青霉HLS111 的主要抗肿瘤活性成分。
青霉,产黄; 抗生素类,抗肿瘤; 抗 HIV 药; 海绵相关真菌
“活化石”海绵作为一种最古老的后生动物,近些年来在天然产物研究领域变得炙手可热。由于特殊的管腔结构和独特的滤食性生活方式使其成为了名副其实的“微生物资源库”,其相关微生物可占到海绵总重的 40% ~ 60%,比海水中含量高出约两个数量级[1]。因而在进行海洋微生物次生代谢产物的分离纯化研究时,以海绵作为载体来分离得到微生物具有很明显的优势,同时还有一些研究认为海绵相关微生物才是海绵活性物质的真正生产者[2]。
本课题组前期对从我国南海水域采集的丰肉结海绵()相关真菌的生物多样性[3]及化学多样性[4-6]进行了相关研究。本论文的研究对象为丰肉结海绵中一株真菌HLS111(GenBank accession No. FJ770066),通过16s rRNA 分子生物学方法初步判定该菌株为产黄青霉()[3]。活性筛选发现该菌株的发酵产物显示了较强的抗肿瘤活性。通过对该菌株的大米固体发酵物进行提取分离,目前已从该菌株的发酵产物中分离得到了 12 个化合物,其中黑麦酮酸类化合物被初步认定为该菌株的主要抗肿瘤活性成分。
1 材料与方法
1.1 材料
1.1.1 菌株 产黄青霉菌株HLS111 为本实验室保存。
1.1.2 培养基
⑴斜面培养基(YPD培养基):酵母提取物10 g/L、胰蛋白胨 10 g/L、葡萄糖 20 g/L、天然海水,调 pH 6.0,加 1.5% 琼脂,121 ℃高压蒸汽灭菌 20 min。
⑵种子培养基(YM 培养基):麦芽提取物10 g/L、葡萄糖 4 g/L、酵母提取物 4 g/L、天然海水,调 pH 6.3,121 ℃高压蒸汽灭菌 20 min,冷却后备用。
⑶发酵培养基(大米固体培养基):500 ml 三角瓶中加入 100 g 大米和 100 ml 天然海水,浸泡3 ~ 5 h,121 ℃高压蒸汽灭菌 30 min,冷却后备用。
1.1.3 仪器 Mercury-300、Mercury-400、VNS-600 核磁共振仪为美国 Varian 公司产品,Avance-500 核磁共振仪为瑞士 Bruker 公司产品,均以 TMS 作为内标;1100 LC/MSD Trap SL 型液相质谱联用仪和1200 分析型高效液相为美国 Agilent 公司产品;VGZAB-2F 型质谱仪为英国 Micromass 公司产品;LC-6AD 型半制备液相为日本岛津公司产品;HZQ-Q 恒温振荡摇床由哈尔滨东联科学仪器有限公司生产。
1.1.4 色谱填料 色谱柱分别为 Agilent ZORBAX Eclipse XDB-C18(4.6 mm × 150 mm,5 μm)和 Agilent ZORBAX Eclipse XDB-C18(9.4 mm ×250 mm,5 μm);Sephadex LH-20 购自美国 GE Healthcare 公司;薄层色谱用层析板购自烟台化工研究所;柱色谱用硅胶(200 ~ 300 目、60 ~ 100 目)购自青岛海洋化工厂。
1.1.5 试剂 常用分析纯试剂购自北京化学试剂厂;色谱纯甲醇购自北京宏达欣宇科技有限公司;胰蛋白胨购自英国 Oxoid 公司;葡萄糖和琼脂购自北京拜尔迪生物科技有限公司;酵母提取物购自北京双旋微生物培养基制品厂;大米购自黑龙江青清源公司;海水采自河北秦皇岛海域。
1.2 方法
1.2.1 菌株的发酵培养 将 HLS111 菌株转接至新鲜 YPD斜面,于 28 ℃培养 7 d 后,接种于液体 YM 培养基中,28 ℃、180 r/min 培养 5 d,将培养好的种子培养基按 1:10(ml/g)比例转接于大米固体培养基中,室温下(约 25 ℃)静置培养40 d。
1.2.2 发酵产物的提取与分离 将培养好的 HLS111 发酵物4000 g用 95% 乙醇超声提取,每次超声 30 min,共提取 3 次,得到粗浸膏 150.0 g。粗浸膏分散于蒸馏水中,依次采用石油醚、乙酸乙酯、正丁醇萃取,萃取液浓缩干燥得到石油醚组分 30.0 g、乙酸乙酯组分 24.0 g、正丁醇组分 38.0 g、水组分 50.0 g。
取石油醚组分 5.0 g,采用硅胶柱(200 ~ 300 目)色谱,二氯甲烷-甲醇梯度洗脱,各流分经 TLC 检测合并成 8 个部分(Fr. P1 ~ P8)。Fr. P1 再经硅胶柱(200 ~ 300 目)色谱,二氯甲烷-丙酮(30:1 → 15:1)梯度洗脱,分成 3 个部分(Fr. P1.1 ~ P1.3),Fr. P1.2 经 Sephadex LH-20 凝胶柱,RP-HPLC半制备得到化合物 7(15.0 mg)和 10(5.2 mg)。Fr. P6 部分经甲醇重结晶得化合物 6(20.0 mg)。
乙酸乙酯组分24.0 g,采用硅胶柱(200 ~300目)色谱,二氯甲烷-丙酮(25:1 → 2:1)梯度洗脱,各流分经 TLC 检测合并成 9 个部分(Fr. E1 ~ E9)。Fr. E2 经甲醇重结晶得化合物 11(20.0 mg)。Fr. E3 同样经甲醇重结晶两次得化合物 8(25.2 mg),母液经 Sephadex LH-20 凝胶柱色谱纯化,再经 RP-HPLC 半制备得化合物 12(3.4 mg)。Fr. E5 经硅胶柱(200 ~ 300目)色谱,石油醚-二氯甲烷-甲醇梯度洗脱,其中 Fr. E5.23(石油醚:二氯甲烷:甲醇 = 2:3:0.03)用石油醚和环己烷重结晶得化合物 1(1.0 g);Fr. E5.30(石油醚:二氯甲烷:甲醇 = 2:3:0.05)用 Sephadex LH-20 凝胶柱色谱纯化,再用石油醚和环己烷重结晶得化合物 2(200.0 mg)。Fr. E7 与 Fr. E8 用甲醇重结晶分别得到化合物 3(10.0 mg)和 4(500.0 mg)。Fr. E9 部分经硅胶柱(200 ~ 300 目)色谱,二氯甲烷:甲醇(15:1 ~ 1:1)梯度洗脱,Fr. E9.7(二氯甲烷:甲醇 = 10:1)用 Sephadex LH-20 凝胶柱色谱纯化得化合物 5(9.0 mg);Fr. E 9.11(二氯甲烷:甲醇 = 8:1)用甲醇重结晶得化合物 9(20.0 mg)。
1.2.3 体外抗肿瘤活性测定 具体实验方法参照文献[7]。
1.2.4 抗 HIV 活性测定 将 293 细胞按 2.2´106个/皿接种到 100 mm 培养皿中,24 h 后,用改良的磷酸钙共转染 3 μg VSV-G 质粒和8 μg pNL4-3.luc.R-E-(HIV-1 核心),16 h 后,用 PBS 冲洗细胞并换新鲜的培养基继续培养 32 h,收集上清液并经 0.45 μm 的滤膜过滤,过滤后的上清液中含有 VSV-G/HIV 伪病毒颗粒。感染前一天,按 6´104个/孔接种到 24 孔板上。用 DMSO 溶解阳性对照化合物或待筛选化合物,感染前 15 min 加入细胞培养液中,以 DMSO 溶剂作空白对照。用适宜稀释度的病毒液感染细胞,感染 48 h 后,VSV-G/HIV-luc 感染的细胞每孔加入 50 μl 细胞裂解液,将 30 μl 荧光素酶底物与 20 μl 细胞裂解液混合后用荧光检测器测定细胞荧光素的活性,其活性的强弱反映 HIV-1 复制的水平。抑制率采用下列公式计算:
抑制率(%)=(对照组平均荧光素酶活性单位– 样品组平均荧光素酶活性单位)/对照组平均荧光素酶活性单位× 100%
1.2.5 抗炎活性的测定 实验方法参照文献[5]。
2 结果
2.1 结构鉴定
化合物 1 ~ 12 的质谱(正离子、负离子 ESI-MS,EI-MS)、核磁共振谱(1H-NMR、13C-NMR)数据与相关文献报道数据一致,故确定其为黑麦酮酸 F(1)[8]、黑麦酮酸 D(2)[8]、环(L-色氨酸- L-苯丙氨酸)(3)[9]、citreoindole(4)[10]、meleagrin(5)[11]、脑苷脂 B(6)[12]、麦角甾醇(7)[5]、(22E,24R)-5α,8α-过氧化麦角甾-6,22-烯-3β-醇(8)[13-14]、globosterol(9)[15]、β-谷甾醇(10)[6]、24-亚甲基环木菠萝烷醇-反式阿魏酸(11)[16]、大黄素(12)[17],结构见图 1。通过 HMBC、HSQC、1H-1H COSY 谱对化合物 4 的氢谱、碳谱数据进行了归属。
化合物 4 为白色粉末(甲醇),正离子 ESI-MS: 497.3 [M+H]+、519.2 [M+Na]+,分子式为C29H28O4N4。1H-NMR(DMSO-6,500 MHz):10.31(1H,s,2-CHN),9.11(1H,s,2'-CHN),7.99(1H,d,J = 8.0 Hz,H-8),7.42(2H,d,J = 8.0 Hz,H-5'',H-9''),7.40(1H,m,H-7'),7.39 (2H,dd,J = 8.0,8.0 Hz,H-6',H-8'),7.32(2H,m,H-6'',H-8''),7.30(1H,dd,J = 8.0,8.0 Hz,H-9),7.25(1H,dd,J = 8.0,8.0 Hz,H-7''),7.16(1H,dd,J = 8.0,8.0 Hz,H-10),7.13(2H,m,H-5',H-9'),6.99(1H,d,J = 8.0 Hz,H-11),6.52(1H,s,J = 6.0 Hz,4-OH),4.89(1H,d,J = 9.0 Hz,H-2),4.66(1H,d,J = 13.0 Hz,H-5),4.37(1H,d,J = 4.5 Hz,H-2'),4.32(1H,dd,J = 11.5,5.0 Hz,H-2''),3.17(1H,br d,J = 13.5 Hz,H-3'β),2.88(1H,dd,J = 13.5,4.5 Hz,H-3'α),2.77(1H,d,J = 13.0 Hz,2''-CHN),2.70(1H,dd,J = 17.5,5.0 Hz,H-3''α),2.45(1H,dd,J = 17.5,11.5 Hz,H-3''β),1.53(1H,d,J = 14.5 Hz,H-3β),0.82(1H,dd,J = 14.5,9.0 Hz,H-3α)。13C-NMR(DMSO-6,125 MHz): 168.9(C-1),166.8(C-1''),160.0(C-1'),142.4(C-4''),139.7(C-7),135.3(C-4'),134.4(C-12),130.8(C-5',C-9'),129.5(C-9),128.6(C-6'',C-8''),128.4(C-6',C-8'),127.4(C-7''),127.2(C-7'),126.6(C-5'',C-9''),124.1(C-10),123.6(C-11),116.3(C-8),80.9(C-5),73.7(C-4),57.6(C-2),55.3(C-2'),55.2(C-2''),38.8(C-3'),38.5(C-3''),38.4(C-3)。

Figure 1 Structures of compounds 1 - 12
2.2 体外抗肿瘤活性筛选
采用 MTT 法测定了化合物 1 ~12 对 HCT-8、BEL-7402、BGC823、A549 和 A2780 5 个肿瘤细胞系的抑制活性。结果表明,化合物 1 和 2 对上述 5 种细胞均显示出明显的抑制活性(表 1),其他化合物未表现出细胞增殖的抑制作用。
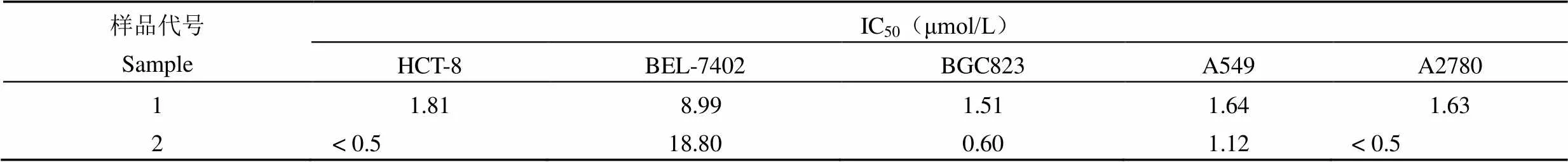
表 1 化合物 1 和 2 对 5 种肿瘤细胞系的体外细胞毒活性
2.3 抗 HIV 活性筛选
通过重组病毒模型测定了化合物 1 ~ 12 对抗HIV 的活性。结果显示,化合物 4 抗HIV 的 IC50值为 13.58 μmol/L,其余化合物均没有明显的抗 HIV 活性。
2.4 抗炎活性筛选
采用 Griess 法对化合物 1 ~ 12 进行了抗炎活性筛选,以 LPS 诱导小鼠腹腔巨噬细胞释放 NO 作为研究指标。在 10 μmol/L 浓度时化合物4 表现出抑制分泌 NO 的能力,抑制率为 58.1%,而阳性对照药地塞米松(DEX)的抑制率为 66.1%。
3 讨论
从我国南海丰肉结海绵产黄青霉菌HLS111 大米固体发酵产物中分离得到 12 个化合物,包括2 个黑麦酮酸类化合物,4 个生物碱类化合物,4 个甾体类化合物,1 个三萜类化合物,1 个蒽醌类化合物,体现出所选菌株次生代谢产物化学结构的多样性。同时首次对化合物citreoindole 的氢谱和碳谱数据进行了归属。在对分离得到的单体化合物进行抗肿瘤、抗 HIV、抗炎等活性筛选中,发现黑麦酮酸类化合物(1 和 2)表现出较强的抗肿瘤活性,citreoindole 表现出一定的抗 HIV 及抗炎活性。初步推断黑麦酮酸类化合物为该菌株的主要抗肿瘤活性成分。
黑麦酮酸是一系列麦角色素类物质,存在于一些生存于粮食作物中的真菌代谢产物中。当这些真菌着生于大米、玉米、黑麦作物上时即产生一种或多种黑麦酮酸,它们是一组氧杂蒽酮二聚物的同分异构体[18]。经文献调研,黑麦酮酸类化合物具有抗菌[19-20]、抗肿瘤[21]、神经保护[22]等活性,研究较多的是黑麦酮酸 D(SAD)及黑麦酮酸 A(SAA)。Ishida[19]研究表明,只有枯草芽孢杆菌和须癣毛癣菌对于 SAD 敏感。Sudhir 等[20]在新菌株 MF 7022 和(或)MF 7023(sp.)中发现4 种具有部分黑麦酮酸结构的化合物,其在植物和哺乳动物体内均显示良好的抗真菌活性。SAD 对埃利希腹水癌、S-180 肉瘤、NIV-MF 和 D3M-16 乳腺癌有极强的抗癌活性,但其具有相当的毒性[21]。因此人们希望通过结构修饰降低其毒性并取得显著成果,二-(2'-四氢呋喃)SAD 和二-(2'-四氢吡喃)SAD 不仅抗肿瘤活性提高,且毒性得到降低,还提高了模型动物的免疫力[22]。通过生物转化或化学修饰等方法继续对黑麦酮酸类化合物的结构优化,有望使其成为抗肿瘤药物而应用于临床。
志谢 化合物波谱数据的测定由本所药物分析室帮助完成;化合物体外抗肿瘤活性筛选由本所药理室陈晓光课题组完成;抗 HIV 活性筛选由本所药理室郭颖课题组完成;抗炎活性筛选由本所药理室侯琦课题组完成。在此深表感谢!
[1] Vacelet J, Donadey C. Electron microscope study of the association between some sponges and bacteria. J Exp Mar Biol Ecol, 1977, 30:301-314.
[2] Proksh P, Putz A, Ortlepp S, et al. Bioactive natural products from marine sponges and fungal endophytes. Phytochem Rev, 2010, 9(4):475-489.
[3] Liu WC, Li CQ, Zhu P, et al. Phylogenetic diversity of culturable fungi associated with two marine sponges: Haliclona simulans and Gelliodes carnosa, collected from the Hainan Island coastal waters of the South China Sea. Fungal Divers, 2010, 42(1):1-15.
[4] Zhu H, Hua XX, Gong T, et al. Hypocreaterpenes A and B, cadinane-type sesquiterpenes from a marine-derived fungus, Hypocreales sp. Phytochem Lett, 2013, 6(3):392-396.
[5] Dong SH, Gong T, Zhu P. The bioactive metabolites of Aspergillus versicolor F62 isolated from Haliclona simulans. Mycosystema, 2011, 30(4):636-643. (in Chinese)
董世豪, 巩婷, 朱平. 相似蜂海绵相关真菌杂色曲霉F62活性代谢产物研究. 菌物学报, 2011, 30(4):636-643.
[6] Wang RS, Gong T, Zhu P, et al. Isolation of metabolic products from the fungus Nectria sp. HLS206 that is associated with the marine sponge Gelliodes carnosa collected from the South China Sea. J Chin Pharma Sci, 2012, 23(2):183-186.
[7] Cui MZ, Gong T, Zhu P. Bioactive metabolites produced by Streptomyces sp. LS298 isolated from the marine sponge Gelliodes carnosa. Chin Med Biotechnol, 2012, 7(6):418-425. (in Chinese)
崔美子, 巩婷, 朱平. 丰肉结海绵相关链霉菌LS298活性代谢产物研究. 中国医药生物技术, 2012, 7(6):418-425.
[8] Andersen R, Büchi G, Kobbe B, et al. Secalonic acids D and F are toxic metabolites of Aspergillus aculeatus. J Org Chem, 1977, 42(2): 352-353.
[9] Kimura Y, Tani K, Kojima A, et al. Cyclo-(l-tryptophyl-l- phenylalanyl), a plant growth regulator produced by the fungus penicillium sp. Phytochemistry, 1996, 41(3):665-669.
[10] Kimihiro M, Shizuri Y, Yamamura S, et al. Isolation and structure of citreoindole, a new metabolite of hybrid strain KO 0052 derived from Penicillium citreo-viride B. IFO 6200 and 4692. Tetrahedron lett, 1991, 32(47):6883-6884.
[11] Nozawa K, Nakajima S. Isolation of radicicol from penicillium luteo-aurantium, and meleagrin, a new metabolite from penicillium meleagrinum. J Nat Prod, 1979, 42(4):374-377.
[12] Qin JC, Bai L, Li XM, et al. Isolation and identification of the metabolites produced by endophytic fungus Chaetomium globosum ZY-22 from Ginkgo biloba. Acta Bot Boreal Occident Sin, 2009, 29(6):1264-1268.
[13] Gunatilaka AAL, Gopichand Y, Schmitz FJ, et al. Minor and trace sterols in marine invertebrates. 26. Isolation and structure elucidation of nine new 5α,8α-epidioxy sterols from four marine organisms. J Org Chem, 1981, 46:3860-3866.
[14] Gao JM, Hu L, Liu JK. A novel sterol from Chinese truffles Tuber indicum. Steroids, 2001, 66(10):771-775.
[15] Qin JC, Gao JM, Zhang YM, et al. Polyhydroxylated steroids from an endophytic fungus, Chaetomium globosum ZY-22 isolated from Ginkgo biloba. Steroids, 2009, 74(9):786-790.
[16] Lee SS, Young LH, Wang KC. Separation of 24-methylenecycloartanol from cycloartenol via a chemical method. J Nat Prod, 1992, 55(5): 644-648.
[17] Liang Y, Tian WX, Ma XF. Chemical constituents of Caulis Polygoni Multiflori (the stem of Polygonum multiflorum Thunb). J Shenyang Pharm Univ, 2009, 26(7):536-538, 546. (in Chinese)
梁妍, 田维熙, 马晓丰. 首乌藤的化学成分. 沈阳药科大学学报, 2009, 26(7):536-538, 546.
[18] Franck B. The biosynthesis of the ergochromes, in the biosynthesis of Mycotoxins: a study in secondary metabolism. PS Steyn ed. New York: Academic Press, 1980:157-191.
[19] Ishida T. Preparation and anti-microbial, anti-tumor properties of substance 25025 (Secalonic acid D). Suzuka Univ Med Sci, 1999, 6:46-60.
[20] Sudhir PV, Ranjan DS, Ganpat AN. Antifungal agents, WO2009025733. Expert Opin Ther Pat, 2010, 20(1):137-143.
[21] Shimizu M, Nakamura M, Kataoka T, et al. Mechanism of the antitumor activity of 5,5′-bis(2′-tetrahydropyranyl) secalonic acid D against Meth-A. Cancer Chemother Pharmacol, 1983, 11(3):144-146.
[22] Lin YC, Chen RZ, She ZG, et al. Method for preparing secalonic acid A used in preparation of protective drug for neuron cells: CN, 101215283. 2008-07-09. (in Chinese)
林永成, 陈汝筑, 佘志刚, 等. 双口山酮化合物 Secalonic acid A 及其制备方法与制备神经元细胞保护药物中的应用: CN, 101215283. 2008-07-09.
[23] Shibukawa M, Shibuya C, Ishii K. Secalonic acid derivatives as antitumor agents: US, 4556651. 1985-12-3.
Bioactive metabolites isolated from the fungusHLS111 associated with the marine sponge
GONG Ting, SUN Chuan-ying, ZHEN Xin, QIU Jun-zhi, YANG Jin-ling, ZHU Ping
To study the active metabolites produced by the fungusHLS111 isolated from the marine spongecollected from the South China Sea.
Based on the technique of high performance liquid chromatography- diode array detector (HPLC-DAD) and the bioactive screening,chemical isolation and purification of the metabolites from the fermentation broth of the strain were conducted by means of silica gel column chromatography, Sephadex LH-20 column chromatography and HPLC, etc. Their structures were elucidated by MS, NMR and other spectroscopic analysis. Their anti-tumor, anti-HIV, anti-inflammatory activitiesalso were detected.
Twelve metabolites were isolated, including two secalonic acids [secalonic acid F (1) and secalonic acid D (2)]; four alkaloids [cyclo (L-Tyr-L-Phe) (3), citreoindole (4), meleagrin (5), cerebroside B (6)]; four steroids [ergosterol (7), (22E,24R)-5α,8α-epidioxyergosta-6,22-dien-3β-ol (8), globosterol (9), β-sitosterol (10)]; one triterpenoid [24-methylenecycloartanol trans-ferulate (11)], and one anthraquinone [emodin (12)]. The1H-NMR and13C-NMR spectral data of compound 4 were assigned for the first time. Preliminary pharmacological studies showed that secalonic acids (1 and 2) exhibited strong antitumor activities, citreoindole (4) possessed moderate anti-HIV and anti-inflammatory activities.
The secondary metabolites isolated from marine fungusHLS111 are rich in structural types. Secalonic acids are the main antitumor components of this fungus.
Penicillium chrysogenum; Antibiotics, antineoplastic; Anti-HIV agents; Marine fungus
ZHU Ping, Email: zhuping@imm.ac.cn
10.3969/cmba.j.issn.1673-713X.2014.03.003
国家“十二五”科技重大专项“综合性新药研究开发技术大平台”(2012ZX09301002-001-005);中央高校基本科研业务费(2012N06);天然药物活性物质与功能国家重点实验室自主课题 C 类课题(GTZC201215)
朱平,Email:zhuping@imm.ac.cn
2013-12-25
Author Affiliations: State Key Laboratory of Bioactive Substance and Function of Natural Medicines & Key Laboratory of Biosynthesis of Natural Products of the National Health and Family Planning Commission, Institute of Materia Medica, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China (GONG Ting, ZHEN Xin, YANG Jin-ling, ZHU Ping); The School of Life Science, Fujian Agriculture and Forestry University, Fuzhou 350002, China (SUN Chuan-ying, QIU Jun-zhi)

