单体分子放射性碳同位素分析在海洋科学及环境科学研究中的应用
赵美训,于蒙,张海龙,陶舒琴
(1.中国海洋大学 海洋化学理论与工程技术教育部重点实验室,山东 青岛266100;2.中国海洋大学 海洋有机地球化学研究所,山东 青岛266100)
1 引言
随着加速质谱仪(Accelerator Mass Spectrometry,AMS)的发展及应用,天然放射性碳(14C)作为一种重要的测年手段及示踪元素已经被广泛应用于考古学、地质学、海洋科学、环境科学等研究领域。在海洋科学研究中,14C常被用于沉积有机质的测年及其沉积速率的推算[1]。总有机质(Total Organic Carbon,TOC)的14C易测定,但其组成和来源复杂导致TOC的14C测定结果不易解析,其14C年龄并不能反映沉积形成的真实年龄[2-3]。生物标志物来源明确、示踪性强,但一般气相色谱的柱容量有限,不能分离富集足够量的生物标志物进行AMS-14C测定。为了解决上述问题,Eglinton等[2]发展了制备毛细管气相色 谱 (Preparative Capillary Gas Chromatography,PCGC)技术,通过多次进样分离富集并测定了海洋沉积物中生物标志物的14C含量[3],开创了单体分子放射性碳同位素分析(Compound-Specific Radiocarbon Analysis,CSRA)在海洋沉积物中的应用。单体分子放射性碳同位素分析技术主要分两步,首先将样品中所需的单体分子分离并富集到微克级,再利用AMS测定其14C含量。这种分子水平的放射性碳同位素分析手段开始被广泛用来揭示有机碳的来源[4-6]、解释有机碳的转换、迁移及保存机制[7-9]、微生物代谢途径的示踪[10-13]、沉积物年代学的改进[14-16]等。同时放射性碳也是研究环境中有毒物质来源(如多环芳烃)的良好示踪剂,在环境科学研究中单体分子放射性碳同位素分析可用来区分它们是自然源还是人为源,为环境评价及环境保护政策的制定提供了科学依据。本文通过多个案例对单体分子放射性碳同位素分析在海洋科学及环境科学研究中的应用进行了归纳总结。
2 海洋科学上的应用
2.1 区分边缘海沉积有机质的来源
全球海洋中,约有90%的沉积有机质埋藏在边缘海中[17],是全球生物地球化学循环过程中一个巨大的碳汇[18]。而这些埋藏在边缘海的有机质来源和组成复杂,既包含上层水体输出的海源有机质,又有河流或风尘输送的大量陆源有机质(如陆地植物碎屑、土壤有机质、成岩作用产物等),以及一些化石源的古老有机质等[19]。其中只有海源有机质来源于浮游植物在真光层内的光合作用,代表了海洋对大气CO2的固定,因此只有明确区分边缘海有机质的来源才能客观判断边缘海吸收大气CO2的潜力。常用来估计海洋沉积物中陆源有机质贡献的指标有总有机质的C/N比和δ13C值[19]以及利用陆源海源生物标志物比值的指标如奇碳数正构烷烃/长链烯酮[20-21]、TAR(Terrigenous/Aquatic Ratio)[22]、TMBR(Terrestrial and Marine Biomarker Ratio)[23]、BIT(Branched and Isoprenoid Tetraether index)[24]等。利用这些指标可以通过二端元或三端元混合模型,在一定程度上区分海源、土壤源和陆地植被源有机质的比例[21],然而仍无法区分出海洋沉积物中化石源有机碳的比例。TOC的Δ14C在一定程度上可以提供有机质的来源信息,结合δ13C值可用于评估边缘海河口地区现代及化石源有机碳的比例[25—30]。对地质构造活跃的大陆边缘地区的山地河流研究,结果显示约有质量分数为0.5%的颗粒有机碳[29]以及一半埋藏在邻近陆架区的沉积有机碳是老碳,由此推测全球每年由流经山地的河流将向海洋输送超过40×1012g的老碳[25—26]。以上研究是将总有机质的贫14C归结于老碳的输入,而有研究显示在输入到海洋沉积物前陆源有机质已经在其他临时的碳储库中发生了预陈化[5—6]。由于发生陈化的陆源有机质的同位素特征常在海源有机质(Δ14C约0‰,δ13C=-14‰ ~-20‰)及老碳(Δ14C约 -1 000‰,δ13C=-24‰~-30‰)之间,因此基于TOC的δ13C及Δ14C分析也很难区分这3种来源[5]。而通过测定来源特定的生物标志物的δ13C及Δ14C值,不仅可以直接反映各端源有机质在边缘海沉积物的碳同位素特征,结合总有机质的δ13C及Δ14C值并利用如下的三元同位素质量平衡方程,还可以更直接地区分边缘海沉积物中海源、陆源有机质及老碳的比例[5-6,31]。
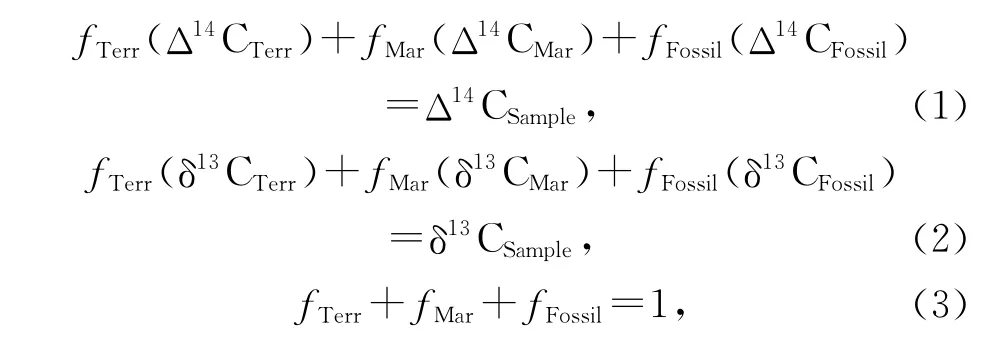
式中,f代表各部分比例,下标Terr,Mar,Fossil,Sample分别代表陆源、海源有机质、老碳及沉积物样品总有机质。
Drenzek等[6]利用该方法对加利福尼亚州Eel River外的陆架沉积物中分离的高等植物蜡质中偶碳数脂肪酸的Δ14C和δ13C以及烷烃的δ13C进行了测定,其中长链脂肪酸的同位素数据证实来自高等植物的陆源有机质在沉积前已经陈化了数千年。同位素质量平衡方程的结果显示该区域沉积有机质以陆源输入为主,老碳的比例(约25%)比之前估计的(约50%[25])少,表明该区域沉积总有机质的贫14C主要由大量预陈化的陆源有机质输入导致而不仅仅是老碳。同样的手段来研究埋藏在北极Beaufort Sea的有机质来源,结果显示约有40%~50%的有机质可能来源于古沉积岩的风化,与前人的估算较一致[5]。Feng等[31]对华盛顿州外陆架区的两个表层沉积物中木质素酚和植物蜡质脂类(包括正构烷烃、正构脂肪酸、正构醇和正构醛)的碳同位素特征进行分析,发现该区域虽然主要以陆源有机质输入为主,而老碳贡献较低(小于10%)。这说明不同河流系统在有机质来源及沉积动力学上有很大差别。结合其他有机地球化学指标,单体分子放射性碳同位素分析技术在边缘海地区的应用能够更好地理解全球海洋沉积物中有机质的年龄组成和埋藏记录,特别是重新评估化石源古老有机质在碳循环中的贡献。通过与人类活动及气候变化记录相比较,可以较定量地比较人类活动及气候变化对边缘海有机质埋藏速率的影响,也可以为建立模型、预测未来海洋在碳循环中的作用提供科学依据。
2.2 指示海洋沉积物的搬运过程
海洋沉积物作为不同时间尺度气候变化记录的载体,通过测定沉积物中的多参数指标可以重建过去的海洋环境及气候变化。但是海洋沉积物易受到海底搬运作用的影响,尤其是高沉积速率站位的细颗粒沉积物,从而影响古环境指标的应用。海洋中有孔虫体积和密度较大,受海洋搬运作用较小,其14C年龄一般认为能用来反映沉积物的真实年龄;而有机质易吸附于细颗粒和低密度物质,容易在沉积后发生再悬浮和水平运输。因此比较海源生物标志物或TOC以及同一沉积层位的浮游有孔虫的14C年龄可以指示是否存在搬运作用引起的外来有机质的输入[7-8]。若它们的沉积过程相同其14C年龄应当基本一致;但若发生了海洋搬运作用它们的14C年龄可能有较大差异。Ohkouchi等[7]对百慕大海隆(the Ber muda Rise)漂移沉积物中长链烯酮与浮游有孔虫进行了放射性碳同位素分析,发现其年龄差异最大可达7 000 a。并且烯酮不饱和指标(UK′37)重建的海水表层温度在过去20 000 a来降低了7℃,远大于其他温度记录[32]。因此研究者推测长链烯酮原本产生在较冷的加拿大边缘,后在深层流作用下夹带着长链烯酮的细颗粒沉积物发生再悬浮、搬运并重新沉积在百慕大海隆。随后在纳米比亚离岸的本格拉上升流区[8]、智利南部边缘海[9]及圣巴巴拉和圣莫妮卡海盆[33]沉积物的研究都发现长链烯酮比浮游有孔虫更贫14C,即14C年龄更老,可能是由于生物扰动、成岩作用、再悬浮、水平输入等沉积后的过程引入的陈化有机质导致[8-9,33]。上述研究结果表明,长链烯酮的14C含量可能受水平输入的预陈化烯酮的比例影响,年龄差异可能受地区特定的流体、海底形态和沉积环境等因素影响。而在非洲西北沿岸[9]、南海[9]、阿根廷海盆[34]及巴拿马海盆[35]的沉积物中却发现长链烯酮与浮游有孔虫的14C年龄有较好的一致性,这可能是由于沉积后的水平搬运不强或搬运过程非常迅速且主要搬运的是当代物质。这说明海底沉积物的搬运过程非常复杂并且有地区特异性,通过比较不同物质的14C年龄能在一定程度上说明沉积物是否存在外来不同年龄物质的混合。因此把单体分子放射性碳同位素分析技术与其他沉积学指标(如指示沉积颗粒物运输机制的230Thxs方法[34-35])结合使用才能更详细地阐明沉积物的搬运机制,也为检验利用多有机地球化学指标来重建古环境的有效性提供证据。
2.3 示踪海洋古菌的代谢途径
20世纪50年代和60年代的核爆炸试验导致大气中14C含量几乎加倍,从而使受大气影响的现代表层海水中溶解无机碳(Dissolved Inorganic Carbon,DIC)的Δ14C>0‰,而几乎不受大气影响的深层海水DIC的Δ14C仍然保持着20世纪50年代前水平(Δ14C<0‰)。因此由核爆炸效应导致的14C可以作为示踪元素,用来指示生物的现代产物以及微生物群落的代谢途径[10-11,36]。Pearson等[11]通过对圣巴巴拉(Santa Barbara)和圣莫妮卡(Santa Monica)海盆的表层沉积物中不同脂类生物标志物的Δ14C测量发现:大部分生物标志物的Δ14C与海水表层DIC的Δ14C一致,尤其是浮游植物的代谢产物甾醇能够准确记录表层海水碳同位素组成的暂时变化,可用来重建表层海水DIC的14C含量[10]。这些结果表明合成这些生物标志物的碳源来自表层海水的DIC或海洋光合自养生物产生的现代有机质,但海洋浮游古菌(主要为奇古菌,Thaumarchaeota)脂类的Δ14C值没有记录核爆炸试验的影响,与表层海水DIC的Δ14C值无关,说明其代谢途径过程中利用的碳源并非来自表层海水。
奇古菌在海洋中分布广泛,可占到海洋超微型浮游生物总量的20%[37]。它产生的一组生物标志物——GDGTs(Glycerol Dialkyl Glycerol Tetraethers)在海水和沉积物中普遍存在[38-39]。由于研究发现GDGTs的δ13C值在一段地质时期内与DIC的值有显著的恒定差异[40-41],研究者推测海洋奇古菌可以利用富δ13C的碳进行自养。Pearson等[11]首次利用PCGC对圣巴巴拉和圣莫妮卡海盆表层沉积物中GDGTs的双植烷进行了14C分析,发现这些有机物的14C年龄与深层水的DIC一致,不受核爆炸效应的影响,为奇古菌的自养提供了证据 。随后的一系列基因分析以及培养实验不仅证实了海洋古菌存在自养行为[42-43],还证实了奇古菌可以利用氨氧化释放的能量进行化能自养[44-46]。然而,也有培养实验发现浮游古菌可以吸收标记过的氨基酸[43,47],表明一些古菌可能是异养或混合营养的。尽管这些研究都证实了海洋浮游古菌自养行为的存在,但是仍不清楚海洋古菌中自养的比例。Ingalls等[48]对太平洋表层及一定深度海水中古菌膜脂的GDGTs进行单体分子放射性碳同位素分析,结果表明表层海水的古菌吸收现代碳,生活在670 m的古菌吸收的碳(平均Δ14C=-77‰)比同等深度的海水DIC(Δ14C=-151‰)略富含14C。利用同位素质量平衡方程计算的结果表明生活在海洋670 m处的奇古菌主要为自养(约83%),而剩余的古菌群落则吸收现代碳进行异养,这表明海洋深层古菌的代谢途径不是单一的,群落中既包括自养型,又有异养型或者是一个进行混合营养行为的单一种群[48]。
因此利用单体分子放射性碳同位素分析对生物标志物的碳来源进行分析可以阐明某些微生物的代谢途径,对生物地球化学的循环及古海洋学指标的发展都有重要指示意义,海洋古菌的代谢途径及系统发育的多样性使得它们在海洋碳和氮循环中都起到了重要的作用。
2.4 沉积物年代学的改进
湖泊沉积物常采用陆地植物巨体化石(如木质碎屑、种子等)、花粉等进行14C测年,深海沉积物岩心通常用有孔虫的介壳进行14C测年[49]。而在海洋和湖泊沉积物中经常难以获得足量的目标化合物而多采用TOC来进行AMS-14C分析。但由于沉积有机质的来源和组成复杂,基于TOC的14C测年结果可能无法指示地层的真实年龄[3]。此外沉积物还可能受到储库效应的影响,在解释14C年龄时需要扣除这部分影响[50-51]。单体分子放射性碳同位素分析技术填补了沉积物测年中的空缺,它的优势之一是样品需求量小[52-53],通过PCGC或高效液相色谱(High Perfor mance Liquid Chromatography,HPLC)等分离手段可以分离富集足够的目标单体化合物用于AMS-14C测定[2,36]。随着分离技术及测量精度的提高,AMS-14C测定由最初需要目标化合物产生约100μg[2]到现在只需5~25μg[54—55]。此外,生物标志物分布广泛,来源明确,保存效率高,已有研究发现多种生物标志物具有重建沉积物年代学的巨大潜力[3,10—11,15]。近年来许多研究通过测定生物标志物的14C年龄成功重建了海洋沉积物的年代学,尤其是高纬度极地地区[14—16,56]。由于南极边缘海沉积物缺乏钙质有孔虫且易受南极大陆侵蚀的残余有机质影响等问题,基于TOC的14C测年结果不太可靠,而Ohkouchi和Eglinton[56]通过对沉积物中的短链脂肪酸进行14C测定解决了上述问题并成功对南极边缘海沉积物的年代学进行了改进,使单体分子放射性碳同位素分析技术作为测年工具在北冰洋或者南大洋等高纬度地区表现出了巨大的应用前景。
除了在海洋沉积物中,Uchikawa等[52]首次将单体分子放射性碳同位素分析技术应用于全新世的湖泊沉积物中,对湖泊沉积物中陆地高等植物产生的奇碳数长链正构烷烃单体进行14C测定,结果与邻近沉积层中植物化石测得的14C年龄有较好的一致性,进一步证实了生物标志物的14C年龄可以作为古环境沉积物测年的可靠手段。由于陆源有机质在输送到在海洋沉积物中前会发生预陈化,导致海洋沉积物中陆源与海源生物标志物会存在巨大的年龄差异[3,15,57],因此陆源生物标志物不适用于海洋沉积物的测年。但陆地与湖泊系统物质交换迅速,有机质的陈化作用影响较小,并且长链正构烷烃的碳来源于植物固定的大气CO2,对其进行14C测定也可以避免湖泊的储库效应[52]。
建立可靠的年代学框架是研究古环境和古气候的基本前提,但由于不同沉积环境的多源性和复杂性会影响常规定年方法的可信度,而当选择能够有效代表地层年龄的生物标志物进行精确的14C测定,不仅可以避免储库效应的影响并且可以增加常规测年数据的分辨度。
3 环境科学上的应用
3.1 大气颗粒物中PAHs的源解析
多环芳烃(Polycyclic Aromatic Hydrocarbons,PAHs)在大气中广泛存在,由于其毒性、生物蓄积性和半挥发性并能在环境中持久存在,而被列入典型持久性有机污染物(POPs)受到国际上科学界的广泛关注。大气颗粒物中的PAHs主要由人类活动如含碳物质的不完全燃烧,即化石燃料(如石油、煤等)和生物质(如木材等)燃烧产生释放到大气中,其中由生物质燃烧释放的PAHs很难区分且易被忽略[58]。为了减少其引起的健康副作用,大气颗粒物中PAHs的源解析对于制定相应的措施来合理控制PAHs的排放显得十分重要。由于燃烧种类和燃烧条件的不同,生成的PAHs组成和相对含量也有所不同,通常利用PAHs特征化合物之间的比值来进行源解析[59],但由于其端元值多变,该方法不能定量确定出主要来源。在一些情况下对单体PAHs的稳定同位素分析可以对来源提供信息,但几种PAHs来源端元值的δ13C值有重合限制了该方法的应用[60]。14C是区分化石燃料和现代生物质燃烧产物的理想示踪剂[61-62],但对样品的总有机质进行14C分析只能区分出化石燃料源的比例,这是由于化石燃料产生的PAHs检测不到14C而生源及生物质燃烧产生的PAHs都具有相对现代的14C特征[63]。现有的源解析多为定性或半定量方法,而对大气PAHs进行CSRA或CCSRA(Compound Class-specific Radiocarbon Analysis)为 PAHs的源解析提供了新的途径,并且利用简单的同位素质量平衡方程还可以定量区分化石燃料和生物质燃烧贡献的比例[58,63-65]。瑞典的吕克瑟勒在冬季经常发生严重的大气污染,Sheesley等[63]首次对该地区大气样品中分离的5个单体或成对的PAH进行14C测定,并估算生物质燃烧的比例是71%~87%,用TOC计算得到的比例是77%。这些数据表明住宅区的木质燃烧是北方地区冬季大气PAHs的主要来源,并对不同单体PAH的贡献不同。由于大气颗粒中PAHs含量低,为了进行14C测定,也可将几种分离的单体PAH合并进行CCSRA。许多研究显示生物质燃烧也是PAHs的一个重要来源[58,63-65],但不同地区其贡献的比例可能有较大差距[64]。
由于PAHs的疏水性,这类半挥发性的有机物可以通过大气沉降到水生环境,在沉积物中累积并长时间保存。已有研究证实将单体分子放射性碳同位素分析技术应用到沉积物中的PAHs还可以定量估算过去化石燃料及生物质燃烧对PAHs输入的相对比例[60,66]。在更复杂的系统,单体分子放射性碳同位素分析与其它能进行源解析的手段及化学表征法相结合可以更加清晰的对环境中的PAHs进行源解析。
3.2 生物体内 MeO-PBDEs的源解析
多溴联苯醚(Polybrominated Diphenyl Ethers,PBDEs)是溴系阻燃剂的一种,经常添加到复合材料中以提高产品的防火性能。而近年来,PBDEs的衍生物之一甲氧基取代的PBDEs(Me O-PBDEs)作为新型的持久性有机污染物引起了广泛关注。研究发现Me O-PBDEs可由生物富集在多种海洋生物体的组织里(如鱼、贝类、海洋哺乳动物、极地熊等),常检测到的两种丰度较大的 Me O-PBDEs是6-Me O-BDE-47(2-(2’,4’-dibromophenoxy)-3,5-dibromoanisole)和2’-Me O-BDE-68(2-(2’,4’-dibromophenoxy)-4,6-dibromoanisole)。从海绵[67]和绿藻[68]中分离出来的 MeOPBDEs是已知的天然产物,但动物体内检测到的MeO-PBDEs来源仍不确定。有研究显示这两种Me O-PBDEs的来源为自然源[69],也有可能是人为源,而单体分子放射性碳同位素分析技术的出现为区分这些卤代有机物的来源提供了直接的证据[70-73]。通过分离测定北大西洋True's beaked whale(Mesoplodonmir us)体 内 的 6-Me O-BDE-47 和 2’-Me OBDE-68的14C含量,结果发现它们具有现代Δ14C值(分别为+103‰和+119‰),证实了由生物富集的MeO-PBDEs是天然产物的积累而不是溴系阻燃剂的代谢产物[72]。并且在1921年获得的鲸脂油样品中也检测到了这两种MeO-PBDEs,说明在工业生产卤代有机物之前的环境中就存在Me O-PBDEs,进一步说明了它们是自然源[74]。单体分子放射性碳同位素分析已经应用到多种卤代有机物来源的研究中,阐明这些卤代有机物质的来源是理解这些物质在环境中发生、迁移和生物富集机制的关键,也为控制其在环境中的排放提供有效的治理措施。
3.3 示踪石油降解中微生物的碳源
石油烃是目前环境中广泛存在的有机污染物之一,在人类活动过程中,越来越多的石油烃进入到土壤环境中从而引起对土壤环境的污染和破坏。在受污染的环境中,能否区分出微生物降解是对自然和人工修复系统能力的一个重要评价。理解微生物利用的碳源为阐明微生物群落在碳循环和有机污染物微生物降解中的作用提供信息。微生物的磷脂脂肪酸(Phospholipid Fatty Acids,PLFAs)是研究微生物群落中碳的来源和代谢途径的理想物质[12,75]。磷脂脂肪酸来自于细胞膜上的磷脂,一旦细胞死亡磷脂将快速降解[76],因此原位微生物的PLFAs同位素特征能够揭示当时存活的生物群落利用的碳源。由于石油烃污染物和自然有机质的δ13C值范围类似,通过对PLFAs的δ13C分析来区分微生物碳源的手段受到限制。而利用石油和自然土壤有机质14C分布的差异,对微生物PLFAs的14C测定是一个能阐明微生物利用的碳源和在复杂系统中识别出原位石油微生物降解的新型手段[13,75,77-78]。Petsch等[12]首次利用该方法在培养实验中证实了微生物可以利用来自风化的页岩这类老碳为碳源,并且研究发现即使有可利用的充足碳源,微生物也可以直接利用化石源老碳为碳源[79]。这个手段还应用到示踪受石油烃污染的盐沼沉积物中微生物利用的碳源,Slater等[13]利用该方法发现微生物PLFAs的Δ14C值与去除石油烃后的沉积总有机质的Δ14C值一致,表明在该盐沼沉积物中没有发生以石油烃为碳源的微生物代谢过程;而Wakeham等[77]则在佐治亚州一个受污染的表层盐沼沉积物中发现细菌的PLFAs与未受污染的沉积物总有机质相比更贫14C,由此估计细菌PLFAs中6%~10%的碳来源于残留的石油烃。这些研究证实了石油烃中不稳定的部分也可以成为沉积物中微生物利用的一个碳源,而上述两个不同的研究结果也表明微生物群落结构的组成以及碳源的生物可利用性等因素能够影响微生物利用的碳源。
4 结语
近年来单体分子放射性碳同位素分析技术发展快速、越来越多地应用于解决生物地球化学、环境科学、沉积学和古气候学等领域的重要问题,尤其是与碳来源有关的问题。它最大的挑战在于,从复杂的环境基质中获得足够量的单体化合物并减少样品处理过程中引入外来碳的污染[53]。虽然不断改进的HPLC技术和PCGC技术使得单体分子放射性碳同位素分析的目标化合物种类增多并提高了目标化合物的纯度和效率[31,36,80],然而自然环境中的许多物质自然丰度非常低,其他物质对某些目标化合物(比如PAHs、PBDEs)的干扰特别严重,从而限制了单体分子放射性碳同位素分析在环境科学中的广泛使用。因此需要发展超微量样品(约1μg)的14C分析技术[81],然而在分析超微量的样品14C时,需要仔细评估分离纯化过程中的背景值,比如在石英试管中的样品燃烧也可以产生多达1μg的背景值,这必然对超微量样品的14C分析增加非常大的风险。针对这一很难消除的背景值,连续流气相色谱-加速器质谱(continuous-flow GC-AMS)技术被期望消除样品处理过程中某些背景值高的问题[82]。另外有研究表明随着样品体积的减小而引发的同位素分馏效应会导致测量精度的下降,发展与样品体积相配的标准品测量将会减小这一效应[53,83]。
我国东部陆架海是一个重要碳汇,受陆海相互作用及人类活动影响严重,其沉积物中有机物的来源组成复杂。许多研究者也利用现有的有机地球化学指标(如C/N、δ13C等)及二元或三元混合模型来研究有机质的来源、组成和迁移过程,但对化石源古老有机质的14C研究相对较少。少数研究利用TOC的14C以及结合其他有机地球化学指标研究了东海的古老有机质[84-85],但能够准确区分出边缘海沉积物海源、陆源有机质及古老有机质的有机物单体分子14C测定技术还未在我国建立及应用。古有机碳的再埋藏过程的变化是气候影响碳的生物地球化学循环的重要组成部分,单体分子放射性碳同位素分析技术在我国的建立将会弥补这一空白,为区分人类活动和气候变化的影响以及定量估算我国边缘海有机物的碳汇格局起到重要作用。
[1]王旭晨,戴民汉.天然放射性碳同位素在海洋有机地球化学中的应用[J].地球科学进展,2002,17(3):348—354.
[2]Eglinton T I,Aluwihare L I,Bauer J E,et al.Gas chromatographic isolation of individual compounds from complex matrices for radiocarbon dating[J].Analytical Chemistry,1996,68(5):904—912.
[3]Eglinton T I,Benitez-Nelson B C,Pearson A,et al.Variability in radiocarbon ages of individual organic compounds from marine sediments[J].Science,1997,277(5327):796—799.
[4]Pearson A,Eglinton T I.The origin of n-alkanes in Santa Monica Basin surface sediment:a model based on compound-specificΔ14C &δ13C data[J].Organic Geochemistry,2000,31(2000):1103—1116.
[5]Drenzek N J,Montluçon D B,Yunker M B,et al.Constraints on the origin of sedi mentary organic carbon in the Beaufort Sea from coupled molecular13C and14C measurements[J].Marine Chemistry,2007,103(1):146—162.
[6]Drenzek N J,Hughen K A,Montluçon D B,et al.A new look at old carbon in active margin sediments[J].Geology,2009,37(3):239—242.
[7]Ohkouchi N,Eglinton T I,Keigwin L D,et al.Spatial and temporal offsets bet ween proxy records in a sediment drift[J].Science,2002,298(5596):1224—1227.
[8]Mollenhauer G,Eglinton T,Ohkouchi N,et al.Asynchronous alkenone and foraminifera records from the Benguela Upwelling System[J].Geochi mica et Cosmochimica Acta,2003,67(12):2157—2171.
[9]Mollenhauer G,Kienast M,Lamy F,et al.An evaluation of14C age relationships bet ween co-occurring foraminifera,alkenones,and total organic carbon in continental margin sedi ments[J].Paleoceanography,2005,20(1):PA1016.
[10]Pearson A,Eglinton T I,Mc Nichol A P.An organic tracer for surface ocean radiocarbon[J].Paleoceanography,2000,15(5):541—550.
[11]Pearson A,Mc Nichol A P,Benitez-Nelson B C,et al.Origins of lipid biomarkers in Santa Monica Basin surface sediment:A case study using Compound-specificΔ14C analysis[J].Geochi mica et Cosmochimica Acta,2001,65(18):3123—3137.
[12]Petsch S,Eglinton T,Edwards K.14C-dead living biomass:evidence for microbial assi milation of ancient organic carbon during shale weathering[J].Science,2001,292(5519):1127—1131.
[13]Slater G F,White H K,Eglinton T I,et al.Deter mination of microbial carbon sources in petroleum contaminated sedi ments using molecular14C analysis[J].Environmental Science &Technology,2005,39(8):2552—2558.
[14]Ohkouchi N,Eglinton T I,Hayes J M.Radiocarbon dating of individual fatty acids as a tool for refining Antarctic margin sedi ment chronologies[J].Radiocarbon,2003,45(1):17—24.
[15]Smittenberg R H,Hop mans E C,Schouten S,et al.Compound-specific radiocar bon dating of the varved Holocene sedi mentary record of Saanich Inlet,Canada[J].Paleoceanography,2004,19(2):PA2012.
[16]Uchida M,Shibata Y,Kawamura K,et al.Compound-specific radiocarbon ages of fatty acids in marine sediments from the western Nort h Pacific[J].Radiocarbon,2006,43(2B):949—956.
[17]Hedges J I,Keil R G.Sedi mentary organic matter preservation:an assessment and speculative synthesis[J].Marine Chemistry,1995,49(2):81—115.
[18]Gordon E S,Goni M A.Sources and distribution of terrigenous organic matter delivered by t he Atchafalaya River to sedi ments in the nort hern Gulf of Mexico[J].Geochi mica et Cosmochi mica Acta,2003,67(13):2359—2375.
[19]Hedges J I,Keil R G,Benner R.What happens to terrestrial organic matter in the ocean?[J].Organic Geochemistry,1997,27(5/6):195—212.
[20]Marret F,Scourse J D,Versteegh G,et al.Integrated marine and terrestrial evidence for abrupt Congo River palaeodischarge fluctuations during the last deglaciation[J].Journal of Quater nary Science,2001,16(8):761—766.
[21]Weijers J W H,Schouten S,SchefußE,et al.Disentangling marine,soil and plant organic carbon contributions to continental margin sediments:A multi-proxy approach in a 20 000 year sediment record from the Congo deep-sea fan[J].Geochi mica et Cosmochimica Acta,2009,73(1):119—132.
[22]Bourbonniere R A,Meyers P A.Sedi mentary geolipid records of historical changes in the watersheds and productivities of Lakes Ontario and Erie[J].Li mnology and Oceanography,1996,41(2):352—359.
[23]Xing L,Zhang H,Yuan Z,et al.Terrestrial and marine biomar ker esti mates of organic matter sources and distributions in surface sediments from the East China Sea shelf[J].Continental Shelf Research,2011,31(10):1106—1115.
[24]Hop mans E C,Weijers J W H,Schef ußE,et al.A novel proxy for terrestrial organic matter in sediments based on branched and isoprenoid tetraether lipids[J].Earth and Planetary Science Letters,2004,224(1):107—116.
[25]Blair N E,Leithold E L,Ford S T,et al.The persistence of memory:The fate of ancient sedimentary organic carbon in a modern sedi mentary system[J].Geochi mica et Cosmochi mica Acta,2003,67(1):63—73.
[26]Blair N E,Leithold E L,Aller R C.From bedrock to burial:the evolution of particulate organic carbon across coupled watershed-continental margin systems[J].Marine Chemistry,2004,92(1):141—156.
[27]Dickens A F,Gélinas Y,Masiello C A,et al.Reburial of fossil organic carbon in marine sedi ments[J].Nature,2004,427(6972):336—339.
[28]Goñi M A,Yunker M B,Macdonald R W,et al.The supply and preservation of ancient and modern components of organic carbon in the Canadian Beaufort Shelf of the Arctic Ocean[J].Marine Chemistry,2005,93(1):53—73.
[29]Komada T,Dr uffel E R M.Tru mbore S E.Oceanic export of relict carbon by small mountainous rivers[J].Geophysical Research Letters,2004,31(7):L07504.
[30]Komada T,Druffel E R M,Hwang J.Sedimentary rocks as sources of ancient organic carbon to t he ocean:An investigation throughΔ14C and δ13C signatures of organic compound classes[J].Global Biogeochemical Cycles,2005,19(2):GB2017.
[31]Feng X,Benitez-Nelson B C,Montluçon D B,et al.14C and13C characteristics of higher plant biomar kers in Washington margin surface sediments[J].Geochimica et Cosmochi mica Acta,2013,105:14—30.
[32]Keigwin L D.The little ice age and medieval war m period in the Sargasso Sea[J].Science,1996,274(5292):1503—1508.
[33]Mollenhauer G,Eglinton T I.Diagenetic and sedi mentological controls on the composition of organic matter preserved in California Borderland Basin sediments[J].Limnology and oceanography,2007,52(2):558—576.
[34]Mollenhauer G,Mc Manus J F,Benthien A,et al.Rapid lateral particle transport in the Argentine Basin:Molecular14C and230Thxsevidence[J].Deep-Sea Research PartⅠ:Oceanographic Research Papers,2006,53(7):1224—1243.
[35]Kusch S,Eglinton T I,Mix A C,et al.Timescales of lateral sedi ment transport in the Panama Basin as revealed by radiocarbon ages of alkenones,total organic car bon and foraminifera[J].Earth and Planetary Science Letters,2010,290(3):340—350.
[36]Ingalls A E,Pearson A.Compound-Specific Radiocarbon Analysis[J].Oceanography,2005,18(3):18—31.
[37]Karner M B,DeLong E F,Karl D M.Archaeal dominance in the mesopelagic zone of the Pacific Ocean[J].Nature,2001,409:507—510.
[38]Schouten S,Hop mans E C,Pancost R D,et al.Widespread occurrence of structurally diverse tetraether membrane lipids:evidence for the ubiquitous presence of low-temperature relatives of hyperther mophiles[J].Proceedings of the National Academy of Sciences,2000,97(26):14421—14426.
[39]Sinninghe D J S,Rijpstra W I C,Hop mans E C,et al.Distribution of membrane lipids of planktonic Crenarchaeota in the Arabian Sea[J].Applied and Environmental Microbiology,2002,68(6):2997—3002.
[40]Hoefs M J L,Schouten S,De Leeuw J W,et al.Ether lipids of planktonic archaea in the marine water column[J].Applied and Environmental Microbiology,1997,63(8):3090—3095.
[41]Kuypers M M M,Blokker P,Erbacher J,et al.Massive expansion of marine archaea during a mid-Cretaceous oceanic anoxic event[J].Science,2001,293(5527):92—95.
[42]Wuchter C,Schouten S,Boschker H T S,et al.Bicarbonate uptake by marine Crenarchaeota[J].FEMS microbiology letters,2003,219(2):203—207.
[43]Herndl G J,Reinthaler T,Teira E,et al.Contribution of Archaea to total prokaryotic production in the deep Atlantic Ocean[J].Applied and Environ mental Microbiology,2005,71(5):2303—2309.
[44]Könneke M,Ber nhard A E,de la Torre J R,et al.Isolation of an autotrophic ammonia-oxidizing marine archaeon[J].Nature,2005,437(7058):543—546.
[45]Francis C A,Roberts K J,Beman J M,et al.Ubiquity and diversity of ammonia-oxidizing archaea in water columns and sedi ments of the ocean[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(41):14683—14688.
[46]Hallam S J,Mincer T J,Schleper C,et al.Pathways of carbon assimilation and ammonia oxidation suggested by environ mental genomic analyses of marine Crenarchaeota[J].PLoS Biology,2006,4(4):520—536.
[47]Ouverney C C,Fuhr man J A.Marine planktonic Archaea take up amino acids[J].Applied and Environmental Microbiology,2000,66(11):4829—4833.
[48]Ingalls A E,Shah S R,Hansman R L,et al.Quantifying archaeal community autotrophy in the mesopelagic ocean using natural radiocarbon[J].Proceedings of the National Academy of Sciences,2006,103(17):6442—6447.
[49]Hajdas I.Applications of Radiocarbon Dating Method[J].Radiocarbon,2009,51(1):79—90.
[50]Olsson I.Accuracy and precision in sedi ment chronology[J].Hydrobiologia,1991,214(1):25—34.
[51]Stuiver M,Polach H A.Discussion:reporting of C-14 data[J].Radiocarbon,1977,19(3):355—363.
[52]Uchikawa J,Popp B N,Schoon maker J E,et al.Direct application of compound-specific radiocarbon analysis of leaf waxes to establish lacustrine sediment chronology[J].Journal of Paleolimnology,2008,39(1):43—60.
[53]Mollenhauer G,Rethemeyer J.Compound-specific radiocarbon analysis—Analytical challenges and applications[J].IOP Confererence Series:Earth and Environmental Science 2009,5(1):012006.
[54]Pearson A,Mc Nichol A P,Schneider R J,et al.Microscale AMS14C measurement at NOSA MS[J].Radiocarbon,1998,40(1):61—75.
[55]Suntia R S,Pearson A.Ultra-microscale(5~25μg C)analysis of individual lipids by14C AMS:assessment and correction for sample processing blanks[J].Radiocar bon,2007,49(1):69—82.
[56]Ohkouchi N,Eglinton T I.Compound-specific radiocarbon dating of Ross Sea sedi ments:A prospect for constructing chronologies in high-latitude oceanic sediments[J].Quaternary Geochronology,2008,3(3):235—243.
[57]Uchida M,Shibata Y,Ohkushi K,et al.Age discrepancy bet ween molecular biomar kers and calcareous foraminifera isolated from t he same horizons of Northwest Pacific sediments[J].Chemical Geology,2005,218(1/2):73—89.
[58]Zencak Z,Klanova J,Holoubek I,et al.Source apportionment of at mospheric PAHs in the western Balkans by natural abundance radiocarbon analysis[J].Environ mental Science &Technology,2007,41(11):3850—3855.
[59]Yunker M B,Macdonald R W,Vingarzan R,et al.PAHs in the Fraser River basin:a critical appraisal of PAH ratios as indicators of PAH source and composition[J].Organic Geochemistry,2002,33(4):489—515.
[60]Mandalakis M,GustafssonÖ,Reddy C M,et al.Radiocarbon apportionment of fossil versus biof uel combustion sources of polycyclic aromatic hydrocarbons in the Stockhol m metropolitan area[J].Environmental Science &Technology,2004,38(20):5344—5349.
[61]Currie L A,Eglinton T I,Benner Jr B A,et al.Radiocarbon“dating”of individual chemical compounds in at mospheric aerosol:First results comparing direct isotopic and multivariate statistical apportionment of specific polycyclic aromatic hydrocarbons[J].Nuclear Instru ments and Methods in Physics Research Section B:Beam Interactions with Materials and Atoms,1997,123(1):475—486.
[62]Reddy C M,Pearson A,Xu L,et al.Radiocarbon as a tool to apportion the sources of Polycyclic Aromatic Hydrocarbons and Black Carbon in environ mental samples[J].Environmental Science &Technology,2002,36(8):1774—1782.
[63]Sheesley R J,KrusåM,Krecl P,et al.Source apportionment of elevated wintertime PAHs by compound-specific radiocar bon analysis[J].Atmospheric Chemistry and Physics,2009,9:3347—3356.
[64]Mandalakis M,GustafssonÖ,Alsberg T,et al.Contribution of biomass burning to at mospheric polycyclic aromatic hydrocarbons at three European background sites[J].Environmental Science &Technology,2005,39(9):2976—2982.
[65]Kumata H,Uchida M,Saku ma E,et al.Compound class specific14C analysis of polycyclic aromatic hydrocarbons associated with PM10and PM1.1aerosols from residential areas of suburban Tokyo[J].Environ mental Science &Technology,2006,40(11):3474—3480.
[66]Kanke H,Uchida M,Okuda T,et al.Compound-specific radiocarbon analysis of polycyclic aromatic hydrocarbons(PAHs)in sedi ments from an urban reservoir[J].Nuclear Instruments and Methods in Physics Research Section B:Beam Interactions with Materials and Atoms,2004,223/224:545—554.
[67]Utkina N K,Denisenko V A,Virovaya M V,et al.Two new minor polybrominated dibenzo-p-dioxins from t he marine spongeDysideadendyi[J].Journal of Natural Products,2002,65(8):1213—1215.
[68]Kuniyoshi M,Yamada K,Higa T.A biologically active diphenyl ether from the green algaCladophor af ascicularis[J].Experientia,1985,41(4):523—524.
[69]Kierkegaard A,Bignert A,Sellström U,et al.Polybrominated diphenyl ethers(PBDEs)and their methoxylated derivatives in pike from Swedish waters with emphasis on temporal trends,1967—2000[J].Environ mental Pollution,2004,130(2):187—198.
[70]Reddy C M,Xu L,Eglinton T I,et al.Radiocarbon content of synthetic and natural semi-volatile halogenated organic compounds[J].Environmental Pollution,2002,120(2):163—168.
[71]Reddy C M,Xu L,O'Neil G W,et al.Radiocarbon evidence for a naturally produced,bioaccumulating halogenated organic compound[J].Environ mental Science &Technology,2004,38(7):1992—1997.
[72]Teuten E L,Xu L,Reddy C M.Two abundant bioaccumulated halogenated compounds are natural products[J].Science,2005,307(5711):917—920.
[73]Guitart C,Slattery M,Ankisetty S,et al.Contemporary14C radiocarbon levels of oxygenated polybrominated diphenyl ethers(O-PBDEs)isolated in sponge-cyanobacteria associations[J].Marine Pollution Bulletin,2011,62(3):631—636.
[74]Teuten E L,Reddy C M.Halogenated organic compounds in archived whale oil:a pre-industrial record[J].Environ mental Pollution,2007,145(3):668—671.
[75]Slater G F,Nelson R K,Kile B M,et al.Intrinsic bacterial biodegradation of petroleu m contamination demonstratedinsituusing natural abundance,molecular-level14C analysis[J].Organic Geochemistry,2006,37(9):981—989.
[76]Harvey H R,Fallon R D,Patton J S.The effect of organic matter and oxygen on the degradation of bacterial membrane lipids in marine sediments[J].Geochi mica et Cosmochi mica Acta,1986,50(5):795—804.
[77]Wakeham S G,Mc Nichol A P,Kostka J E,et al.Natural-abundance radiocarbon as a tracer of assimilation of petroleu m carbon by bacteria in salt marsh sedi ments[J].Geochimica et Cosmochi mica Acta,2006,70(7):1761—1771.
[78]Cowie B R,Greenberg B M,Slater G F.Deter mination of microbial carbon sources and cycling during remediation of petroleu m hydrocarbon impacted soil using natural abundance14C analysis of PLFA[J].Environ mental Science &Technology,2010,44(7):2322—2327.
[79]Pearson A,Seewald J S,Eglinton T I.Bacterial incorporation of relict carbon in the hydrot her mal environment of Guay mas Basin[J].Geochimica et Cosmochi mica Acta,2005,69(23):5477—5486.
[80]Ball G I,Xu L,Mc Nichol A P,et al.A t wo-di mensional,heart-cutting preparative gas chromatograph facilitates highly resolved single-compound isolations with utility towards compound-specific natural abundance radiocarbon(14C)analyses[J].Journal of Chromatography A,2012,1220:122—131.
[81]Santos G M,Sout hon J R,Drenzek N J,et al.Blank assessment for ultra-small radiocarbon samples:chemical extraction and separation versus AMS[J].Radiocar bon,2010,52:1322—1335.
[82]McIntyre C P,Galutschek E,Roberts M L,et al.A continuous-flow gas chromatography14C accelerator mass spectrometry system[J].Radiocarbon,2010,52:295—300.
[83]Uchida M,Shibata Y,Yoneda M,et al.Technical progress in AMS microscale radiocarbon analysis[J].Nuclear Instru ments and Methods in Physics Research Section B:Beam Interactions with Materials and Atoms,2004,223/224:313—317.
[84]Wang X C,Li A C.Preservation of black carbon in the shelf sedi ments of the East China Sea[J].Chinese Science Bulletin,2007,52(22):3155—3161.
[85]Kao S,Dai M,Wei K,et al.Enhanced supply of fossil organic carbon to the Okinawa Trough since the last deglaciation[J].Paleoceanography,2008,23(2):PA2207.

