基于超高效液相色谱-串联质谱的稻田环酰菌胺和噻酰菌胺残留量检测
陈湘燕,张 盈,秦立新,伍贵方,段婷婷*
(1.贵州省植物保护研究所,贵州 贵阳550006,2.黔南州农业委员会,贵州 都匀558000)
环酰菌胺(Fenhexamid)和噻酰菌胺(Tiadinil)是新型酰胺类内吸性杀菌剂,主要用于大田作物、蔬菜、果树等病害的防治[1-2],并且对已产生抗药性的抗性菌亦有防效,由于二者低毒,无致畸形,所以使用范围在逐渐扩大。关于这两种农药在蔬菜、动物源性食品、水果等中的残留检测方法分别有报道,测定的主要方法有酶联免疫法(ELISA)、高效液相色谱法(HPLC)、气相色谱法(NPD)、液相色谱-串联质谱法[3-10]。目前,欧盟制定了环酰菌胺在水稻中的最大残留限量(MRL)是0.05 mg/kg;韩国和日本规定噻酰菌胺在稻米中的MRL值是1 mg/kg,其他国家和组织没有制定环酰菌胺和噻酰菌胺在稻米中的MRL值。在我国,环酰菌胺和噻酰菌胺作为防治水稻稻瘟病的药剂在推广使用,但在水稻生态系统中检测这两种药剂的残留分析方法未见报道。
超高效液相色谱-串联质谱法(UPLCMS/MS)测定,结合基质固相分散萃取技术净化,是一种同时具备高效率、高特异性和高灵敏度的普适性方法,广泛用于农药及环境污染物的残留分析测定[11]。本文建立了采用分散固相萃取-UPLC-MS/MS法同时测定稻田生态系统中环酰菌胺和噻酰菌胺残留分析检测方法,为水稻的安全生产以及稻田生态系统中相应的农药残留量的检测和确证提供依据。
1 材料与方法
1.1 试剂与仪器
环酰菌胺(99.5%)标准品,噻酰菌胺(99%)标准品(北京勤诚亦信科技开发有限公司);乙腈(色谱纯、分析纯);水(Milli-Q超纯水);N-丙基乙二胺(PSA,Agela Technologies公司);石墨化碳黑(GCB,德国CNW Technologies GmbH公司);超高效液相色谱串联质谱(UPLC-MS/MS,TSQVantage,Thermo公司);Hypersil GOLD色谱柱(100 mm×2.1 mm,1.9μm,Thermos公司),HR 1727/06/BC飞利浦粉碎机(珠海飞利浦家庭电器有限公司);SK-1漩涡混合器(江苏中大仪器厂);TG16台式离心机(长沙迈佳森仪器设备有限公司);Filter Unit滤膜(0.22μm,Agela Technologies公司)。
1.2 标样溶液的配制
用电子天平分别准确称取环酰菌胺标准品(99.5%)0.010 0 g和噻酰菌胺标准品(99.0%)0.010 1 g(精确到0.000 1 g),用色谱纯乙腈溶解并定容至100 mL,配制成质量浓度为100 mg/L的储备液,于4℃冰箱中保存。准确移取适量储备液,分别用色谱纯乙腈稀释成2、1、0.5、0.05、0.005 mg/L的系列标准品溶液。
1.3 样品前处理方法
土壤除去根、杂物,稻谷脱壳,稻米、稻壳和稻秆用高速万能粉碎机24 000 r/min打碎,混匀。
1.3.1 提取 稻田土、稻田水:准确称取10.0 g样品于50 mL具塞离心管中;加入10 mL乙腈,涡旋3 min,加入1 g氯化钠和4 g无水硫酸镁,涡旋1 min,以4 000 r/min离心5 min,取上清液待净化。
稻米、稻壳、稻秆:准确称取5.0 g样品于50 mL具塞离心管中,加入5 mL水,涡旋30 s;加入10 mL乙腈,涡旋3 min,加入1 g氯化钠和4 g无水硫酸镁,涡旋1 min,以4000 r/min离心5 min,取上清液待净化。
1.3.2 净化 稻田土、水、稻米:取1.5 mL上清液,加入到盛有150 mg无水硫酸镁、50 mg PSA的2 mL离心管中,涡旋1vmin,以5 000 r/min离心5 min,取上清液,过0.22μm有机膜,待进样。
稻壳、稻秆:取1.5 mL上清液,加入到盛有150 mg无水硫酸镁、50 mg PSA和10 mg GCB的2 mL离心管中,涡旋1 min,以5 000 r/min离心5 min,取上清液,过0.22μm有机膜,待进样。
1.4 检测方法
1.4.1 色谱条件Hypersil GOLD色谱柱;柱温:40℃;流动相A为甲醇,流动相B为水溶液,二元梯度洗脱:0~0.2 min,20%A;0.2~0.5 min,20%~90%A;0.5~2.8 min,90%A;2.8~3.5 min,90%~60%A,3.5~5.0 min,60%~20%A,5.0~6.0 min,20%A;流速:0.25 mL/min;进样量:2μL。
1.4.2 质谱条件 大气压化学电离ESI-方式扫描方式,毛细管温度350℃;电喷雾电压2 800 V;鞘气及辅助气是氮气,鞘气流速30 arb,辅助气流速10 arb;碰撞气为氩气。环酰菌胺S-leans射频电压45 V,定性离子对300.2/249.2,定量离子对300.2/264.2,碰撞能量分别为33 V和22 V。噻酰菌胺S-leans射频电压46 V,定性离子对266.2/239.2,定量离子对266.2/71.0,碰撞能量分别为13 V和15 V。
1.5 方法的线性关系
基质效应(Matrix effects)是LC/MS进行生物样品测定时常常产生的现象。基质效应影响大时会降低方法的灵敏度,影响方法的准确性[12]。本文对目标化合物中存在的基质效应进行了研究。分别准确吸取系列环酰菌胺和噻酰菌胺混合标准溶液(20、10、5、0.5、0.05 mg/kg)100μL,氮吹至干,准确加入1 mL按1.2.3步骤的各种空白溶液,即得基质标准溶液。2、1、0.5、0.05、0.005 mg/L的系列溶剂标准品溶液和基质标准溶液在1.2.4分析条件下进样,以环酰菌胺和噻酰菌胺的质量浓度为横坐标,以它对应的峰面积为纵坐标作图。经最小二乘法拟合得溶剂标准曲线和各基质标准曲线线性方程(表1)。其线性范围在0.005~2 mg/L之间。
1.6 方法的准确度、精密度和灵敏度
方法的准确度、精密度和灵敏度分别用添加回收率、变异系数和最低检出量(LOD)与最低定量限(LOQ)衡量。在稻田土、稻田水、稻米、稻壳和稻秆的空白样品中分别准确加入环酰菌胺和噻酰菌胺的混合标准液,使其分别相当于0.005、0.05、0.5、1.0和2.0 mg/kg的添加水平。按照1.3中所述步骤进行提取、净化,1.4条件下测定,5次重复,计算平均回收率和相对标准偏差。LOD以最低添加水平的色谱图中噪音信号的三倍计算,LOQ以最低添加浓度表示。
2 结果与讨论
2.1 检测方法的选择
目前对于环酰菌胺和噻酰菌胺主要方法有酶联免疫法、高效液相色谱法、气相色谱法、液相色谱-串联质谱法。液相色谱法、气相色谱法的前处理过程复杂,多采用液液分配和固相萃取来净化,使用的有机溶剂多,对环境造成二次污染。液相色谱法杂质干扰严重,灵敏度低,且属非选择性检测,遇到复杂样品可能出现假阳性。气相色谱法因气化和高温易导致农药降解不足,检出限高、检测时间长。酶联免疫法主要用于医学和食品检定。超高效液相色谱-质谱/质谱法现今已广泛地应用于农作物及食品中残留物质的分析检测,它操作简单,灵敏度高,选择性强,定量准确,线性范围宽。
2.2 测试条件优化
为了获得最佳的灵敏度和分离效果,采用直接进样方式,扫描范围m/z为200~600,选择合适的离子源和流动相。实验结果表明,在1.4所示的选择监控离子、S-leans射频电压及碰撞能量下,电喷雾离子化、负离子扫描模式可使环酰菌胺和噻酰菌胺具有较好的电离效果并获得特征离子峰[MH]。在此基础上进一步选择质谱参数,选择最适的监测离子、S-leans射频电压及碰撞能量。采用甲醇和水体系为流动相,在1.4.1条件下梯度洗脱,可得到较高的灵敏度、重现性及峰形。
2.3 净化剂的选择
本实验样品净化过程,主要采用PSA去除基质中的干扰杂质。但水稻植株和稻壳样品含有大量色素,仅使用PSA,其净化效果不佳,因此在PSA净化基础上,加入了适量的石墨化碳黑辅助净化。结果表明,采用PSA和石墨化碳黑混合净化剂在处理水稻植株和稻壳样品,能取得理想的净化效果。且在获得较好回收率的同时,获得了较好的重现性,简化了操作程序,提高了效率。
2.4 方法的线性关系与灵敏度
采用基质匹配标准曲线斜率和溶剂标准曲线斜率之比(K)来评价基质效应:当K在0.9~1.1之间时,基质效应不明显,当K大于1.1时为基质增强效应,小于0.9则是基质减弱效应[13]。由表1可知,环酰菌胺和噻酰菌胺的稻田土、稻米、稻壳和稻杆基质标准曲线与溶剂标准曲线的斜率比(K)小于0.9,属于基质减弱效应,而稻田水基质标准曲线与溶剂标准曲线的斜率比(K)在0.9和1.1之间,则环酰菌胺和噻酰菌胺在稻田水基质中的基质效应不明显。为保证方法的通用性和适用性,本文通过基质匹配标准样液校正消除基质效应影响。
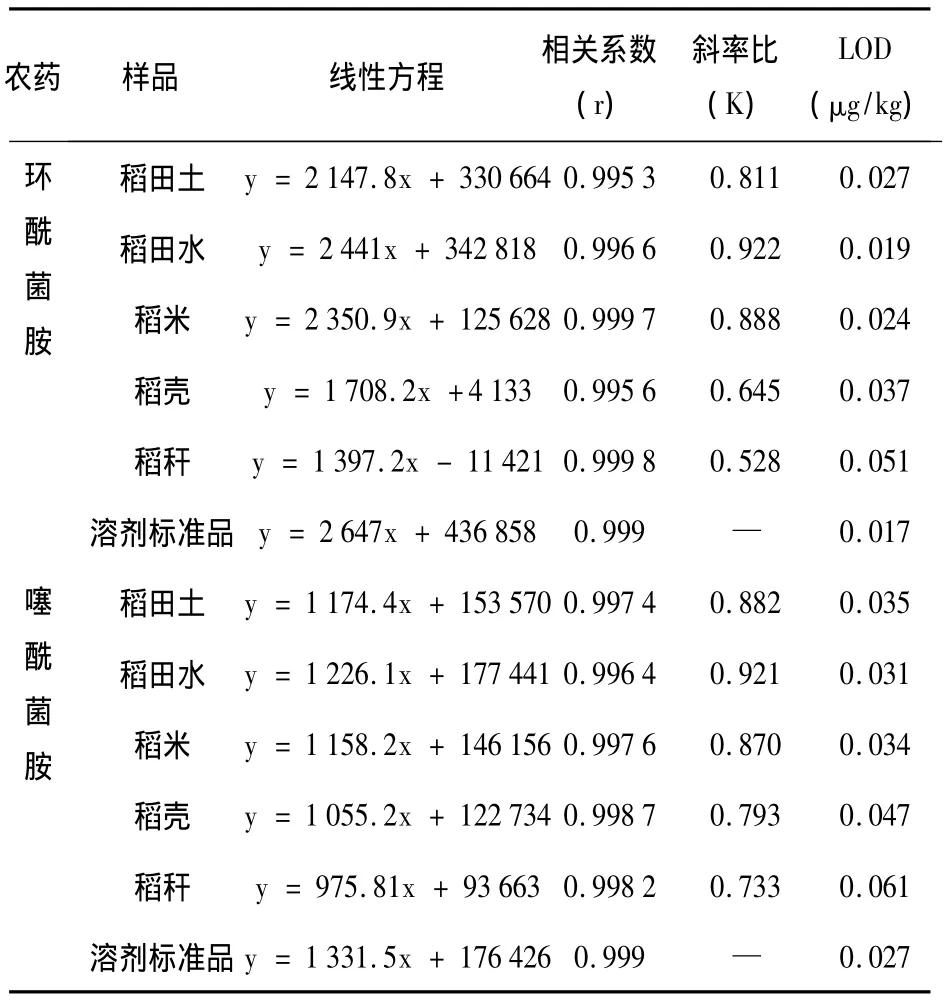
表1 环酰菌胺和噻酰菌胺(0.005~2 mg/L)的线性方程、相关系数和方法检测限Tab.1 The linear equations(0.005~2 mg/L),correlation coefficients and LOD of fenhexamid and tiadinil
2.5 方法的回收率、精密度
由表2可见经基质匹配标准品校正后环酰菌胺和噻酰菌胺在稻田土、稻田水、稻米、稻壳和水稻秆中的平均回收率为81.9%~107.6%,变异系数为1.4%~9.6%,表明本方法有较好的准确度和精密度可以满足残留定量分析的要求。添加色谱图见图1。
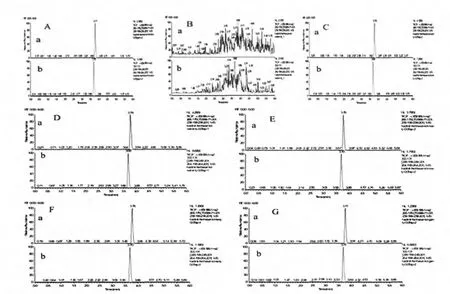
图1 环酰菌胺和噻酰菌胺在样品中的总离子流图(a:噻酰菌胺总离子流图;b:环酰菌胺总离子流图)Fig.1 Total ion Chromatograms of fenhexamid and tiadinil in samples(a:Total ion Chromatograms of tiadinil;b:Total ion Chromatograms of fenhexamid)

表2 烟环酰菌胺和噻酰菌胺在水稻中的添加回收率和变异系数(n=5)Tab.2 Recovery rate and coefficients of variation of fenhexamid and tiadinil in rice(n=5)
3 结论
本研究建立了采用乙腈提取,PSA和GCB净化并结合UPLC-MS/MS快速同时检测环酰菌胺和噻酰菌胺在稻田生态系统中的残留量。此方法中环酰菌胺和噻酰菌胺在0.005~2 mg/L质量浓度范围内呈现良好的线性关系,在0.005~2 mg/kg添加质量分数范围内稻田土、稻田水、稻米、稻壳和水稻秆中的平均回收率为81.9%~107.6%,变异系数为1.4%~9.6%。该方法的准确度和灵敏度均符合我国国家标准的要求,且环保、简便快捷,易操作,能够满足环酰菌胺和噻酰菌胺在稻田生态系统中残留量的快速检测和确证的要求。
[1]黄 伟,柴嫔姬,谭成侠.环酰菌胺合成工艺[J].农药,2012,51(8):562-564.
[2]赵卫光,刘桂龙,王素华,等.新型稻田杀菌剂噻酰菌胺[J].农药,2003,42(10):47-48.
[3]ESTEVE-TURRILLASF A,ABAD-FUENTESA,MERCADER JV.Determination of fenhexamid residues in grape must,kiwifruit,and strawberry samples by enzyme-linked immunosorbent assay[J].Food chemistry,2011,124(4):1 727-1 733.
[4]LINA H,JEONG-HEUI C,JONG-HYOUK P,et al.Residual pattern of fenhexamid on pepper fruits grown under greenhouse conditions using HPLCand confirmation via tandem mass spectrometry[J].Food chemistry,2011,126(4):1 533-1 538.
[5]LIKASD T,TSIROPOULOSN G,MILIADISG E.Rapid gas chromatographic method for the determination of famoxadone,trifloxystrobin and fenhexamid residues in tomato,grape and wine samples[J].Journal of chromatography A,2007,1:208-214.
[6]贾福艳,刘志军,刘永利,等.黄瓜与西葫芦中环酰菌胺的残留分析[J].农药,2012,51(8):590-591.
[7]郭庆龙,崔淑华,段 浩,等.高效液相色谱串联质谱法测定蔬果中啶酰菌胺和环酰菌胺残留[J].食品科学,2012,33(10):255-259.
[8]王 岚,徐 娟,谢建军,等.高效液相色谱-质谱/质谱对动物源性食品中噻酰菌胺残留的检测[J].分析测试学报,2010,29(2):207-210.
[9]王 岚,徐 娟,谢建军,等.植物源性食品中噻酰菌胺残留的液相色谱串联质谱法检测[J].农药,2010(2):125-127.
[10]CHEN X Y,ZHAOK X,FAN ZJ,et al.Determination of Tiadinil and Its Metabolite in Flue-Cured Tobacco[J].Journal of chromatographic science,2013:90.
[11]陈武瑛,董丰收,刘新刚,等.分散固相萃取-超高效液相色谱-串联质谱法快速测定苹果中代森锰锌残留[J].分析化学,2010,38(4):508–512.
[12]KING R,BONFIGLIO R,FERNANDEZ-METZLER C,et al.Mechanistic Investigation of Ionization Suppression in Electrospray Ionization[J].J Am Soc Mass Spectrom,2000,11(11):942-950.
[13]LIU X G,XU J,LI Y B,et al.Rapid Residue Analysis of Four Triazolopyrimidine Herbicides in Soil,Water,and Wheat by Ultra-performance Liquid Chromatography Coupled to Tandem Mass Spectrometry[J].Analytical and Bioanalytical Chemistry,2011,399(7):2 539-2 547.

