BI-RADS-US超声分级在乳腺良恶性疾病的诊断价值
章 华,陈 萍,徐辉雄
(1.同济大学附属第一妇婴保健院超声科,上海 200040;2.同济大学附属第十人民医院超声医学科,上海 200072)
近年来,乳腺癌已成为我国女性的第1位恶性肿瘤。各种影像检查技术在乳腺癌诊疗中正发挥着越来越重要的作用。超声作为一种简便又有效的检查方法越来越被临床所应用。但乳腺肿块的超声图像各种各样,如何辨别良恶性图像,作规范的语言描述,为临床医生提供一个较准确的诊断标准?2003年美国放射学会出版了乳腺影像学报告及数据系统(breast imaging report and data system,BI-RADS),包括了乳腺超声分级标准(breast imaging report and data system for ultrasonography,BI-RADS-US),其对乳腺病变制定了详细的声像图描述用语和分级诊断标准,为临床超声工作提供了规范和标准[1]。本研究采用 BI-RADS-US分级标准,分析99例(共103个病灶)乳腺患者肿块的声像图特点,并与手术后病理对照,以探讨BI-BADS-US分级对乳腺良、恶性病变的诊断价值。
1 资料与方法
1.1 研究对象
2011年5月至2012年3月随机选取在同济大学附属第一妇婴保健院检查的99个手术病例(共103个病灶),年龄13~76岁,平均年龄40±14.3岁,均为女性。
1.2 检查方法
采用Philip 240-A彩色超声诊断仪,频率8~14 MHz。采用直接检查法:患者取仰卧位,暴露双侧乳腺及腋窝,以乳头为中心,放射状在乳腺各象限连续扫查,并结合纵、横、斜切扫查。对乳腺病灶的形态、边界、回声类型、后方回声特征、血流分布边缘、钙化、周围组织、双侧腋下进行描述,并按BI-RADS-US分级诊断标准进行分级评价。
1.3 BI-RADS-US分级诊断标准
BI-RADS-US分级标准如下。0级:超声检查未发现异常,需结合其他检查再全面评估病变;1级:未见明显异常,随访1年;2级:良性征象,建议6~12个月的定期随访:3级:可能良性病变,建议3~6个月短期随访;4级:可疑异常,建议穿刺活检以明确诊断(3%~94%的恶性可能);5级:高度可疑恶性,应积极处理(≥95%的可能为恶性);6级:病理已证实为恶性病变。
1.4 统计学处理
采用 SPSS 17.0统计软件行 Person χ2检验,非参数法估计ROC曲线下面积。以病理结果为金标准,按超声分级诊断的真假阳性率作BIRADS-US分级的ROC曲线,P<0.05为差异有统计学意义。
2 结 果
根据超声诊断分级标准,99个病例(103个病灶)中,BI-RADS-US 3级有56例,BI-RADS-US 4级有41例,BI-RADS-US 5级有6例。
56例3级中经病理证实良性50例,(47例为纤维瘤,1例导管瘤,2例炎症),恶性6例,(2例浸润导管癌,4例乳腺导管内癌)。41例4级中,经病理证实良性7例,(4例纤维瘤,1例乳腺病,1例慢性肉芽肿性乳腺炎,1例导管内乳头状瘤);恶性34例(15例乳腺导管内癌,19例浸润性导管癌);6例5级中经病理证实6例均为恶性(5例浸润性导管癌Ⅲ级,1例黏液腺癌伴少量导管内癌),见图1。
图1 BI-RADS超声分级诊断乳腺良恶性疾病Fig.1 Diagnosis of benign and malignant breast diseases by BI-RADS-US classification
3级病灶中良性89.3%恶性10.7%,4级病灶中良性17.1%恶性82.9%,5级病灶中恶性100%。特异度为87.7%(50/57)敏感度86.9%(40/46),Person χ2检验结果:χ2=57.837,P <0.001,ROC 曲线下面积0.862(95%的可信区间为0.784~0.94),见图2。
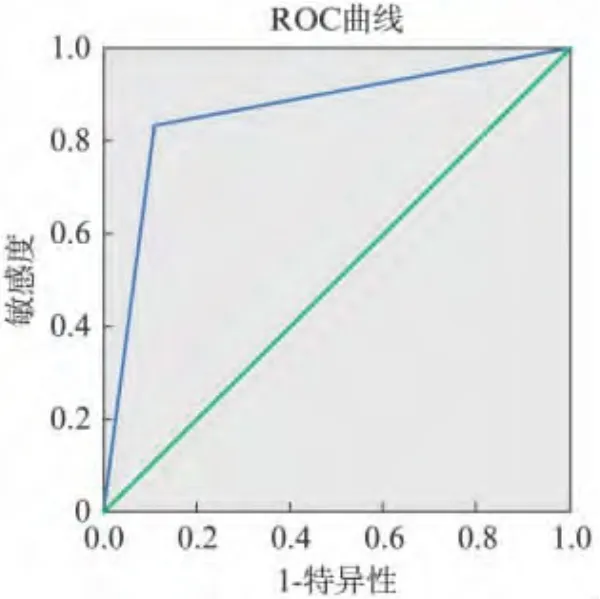
图2 BI-RADS分级的ROC曲线Fig.2 The ROC curve of BI-RADS classification
3 讨 论
如今的彩色乳腺高频超声可以清楚地显示肿块的回声、边界、形态、内部血流等,但超声医生往往凭自己的经验及主观意识来判断肿块的良恶性,给临床医生诊治带来困惑[5]。临床医生根据含糊的超声报告难以确定肿块的性质和决定治疗方案,将严重延误疾病的治疗[3]。随着2003年美国放射学会第三次修改,增加了超声和MRI的诊断标准,与钼钯的BI-RADS分级标准一样,为超声报告的书写提供统一的描述语言和统一的判断标准,使超声医生与放射科医生及临床医生间的沟通更方便,并且有了统一的判断标准让临床医生对病变的良恶性的判断和诊治更准确[1]。
本研究中严格按照分级标准要求分级,在本组103个病例中,3、4、5级恶性肿瘤检出率分别为10.7%、82.9%、100%,呈阶梯性上升,说明其分级标准有很好的恶性预测值,ROC曲线下面积0.862,95%的可信区间是 0.784 ~0.94(P <0.05)。表明该分级诊断方法具有较好的诊断与鉴别诊断乳腺良恶性病变的能力,在临床诊治有明确的指导意义,本组中3级恶性病变占10.7%,2例浸润导管癌,4例乳腺导管内癌。其中2例浸润导管癌误认为是纤维瘤或3级实质性占位,除了操作者采纳图像不够规范影响了判断有关外,主要原因还是没有严格按照分级标准来诊断。4例乳腺导管内癌可能与早期恶性病变显示良性的声像图特征以及操作者采纳图像不够规范影响了判断有关。也有文献报道认为是操作者忽视了病灶的细微恶性特征,尤其在多发病灶中[4]。所以建议临床医生对于超声诊断BI-RADSUS 3级的乳腺病灶应引起警惕,作短期随访或手术切除,并且可以结合钼钯对原位癌内的微小钙化灶比超声敏感的特点,局部再进行非常细致的扫查来发现部分一般检查容易漏诊及误诊的病灶。本组41例4级中有4例纤维瘤,1例乳腺病,1例慢性肉芽肿性乳腺炎,1例导管内乳头状瘤,可能与超声声像图表现出边界不清,形态不规则的特征而引起操作者的错误判断有关[8]。
本研究结果可知BI-RADS-US 4~5级中恶性程度较高,与文献报道一致[2-6],所以,临床医生对于超声诊断为BI-RADS-US 4级和5级的乳腺病灶应积极诊治,进行穿刺活检获得病理结果,尤其对BIRADS-US 4级的患者,除近期复查外,还应积极进行穿刺活检。本研究与临床医生达成共识,对4级以上患者必做手术或活检,从而获得明确的病理诊断,所以4、5级有较高的恶性预测值,给临床提供有效的信息。
本研究表明BI-RADS-US分级在临床应用中确实有指导意义,一方面使超声医生与放射科医生及临床医生间的沟通更方便,并且有了统一的判断标准,让临床医生对病变的良恶性的判断和诊治更准确;另一方面BI-RADS-US分级在良恶性肿瘤判断上有很好的恶性预测值,为临床提供有效的信息。本研究的不足之处在于病例数不够多,还需要大样本病例统计得出更详细的结论,提出更准确地评分标准,在以后的工作中可以制定合适的评估分界标线,同时对超声医师进行培训达成共识,减少个体的主观差异。从而更好地指导临床医生对乳腺病变进行判断并合理地选择临床诊治方案。
[1]American College of Radiology.BI-RADS:ultrasound∥Breast Imaging Reporting and Data System:BIRADS Atlas[M].4th ed.Reston,Va:American College of Radiology,2003.
[2]石健,王彬,刘荫华,等.乳腺高频彩色多普勒超声检查中应用BI-RADS分级诊断标准对乳腺疾病的诊断价值[J].中国医学影像技术,2010,26(5):877-880.
[3]吴猛,王雪梅,周如海,等.探讨BI-RADS分级在超声诊断乳腺癌中的应用价值[J].中国临床医学影像杂志,2013,24(7):465-468.
[4]王立平,蒋天安,杨琛,等.乳腺良性结节超声 BIRADS分级的可靠性及其影响因素分析[J].中华超声影像学杂志,2011,20(4):314-317.
[5]杨敏,刘芳,顾小宁,等.BI-RADS超声分级与高频彩色多普勒超声评分诊断乳腺良恶性病变的应用价值[J].中华医学杂志,2013,93(23):1833-1835.
[6]Raza S,Goldkamp AL,Chikarmane SA,et a1.US of breastmasses categorized as BI-RADS 3,4,and 5:pictorial review offactors influencing clinical management[J].Radiographics,2010,30(5):1199-1213.
[7]朱庆莉,姜玉新,张璨,等.乳腺影像报告和数据系统分级4和5级的触诊不清乳腺肿块的超声特征[J].中国医学科学院学报,2010,32:456-460.
[8]王涌,杨宝年,张希敏,等.对超声BI-RADS分级在诊断3635例乳腺病变中价值的初步探讨[J].中国超声医学杂志,2011,27(6):508-511.
[9]马慧娟,冷振鹏,王萍,等.乳腺超声影像报告数据系统在乳腺病灶诊治中的应用价值[J].中国超声医学杂志,2013,29(11):971-974.
[10]陈燕,张江宇,马小燕,等.超声BI-RADS分级在乳腺肿块诊断中的应用[J].中华临床医师杂志(电子版),2013,(6):2421-2424.

