N-甲基-N,N-双十二烷基壳聚糖盐酸盐的合成及自组装囊泡性能
洪键淞,辛梅华,李明春,方江海
(华侨大学材料科学与工程学院,环境友好功能材料教育部工程中心,福建 厦门 361021)
囊泡既有亲水性又有疏水性,结构上自我封闭,具有保护药物生物活性、有效地控制药物释放、提高稳定性和疗效、延长半衰期及降低药物毒副作用等诸多优点,作为新型药物载体被广泛研究,并用于动物体内外药物实验。
囊泡作为药物载体有两大特点[1]:一是具有包载多种类型药物的能力,囊泡的空腔可包载较大量的水溶性药物,夹在两层亲水基团中间的疏水微相也可包裹一些疏水性药物,囊泡的不同形态也使其包载药物分子的范围更加广泛;二是赋予药物更好的生物相容性和靶向性,囊泡具有双层膜结构,与生物膜有良好的相容性和细胞透过性。
囊泡制备方法很多,有乙醇注射法、薄膜分散法及逆相蒸发法等[2-5]。但除了乙醇注射法外,其他的制备方法往往大量使用有机溶剂,可能会使药物变性,且会造成环境污染及药物有机溶剂残留。乙醇注射法因制备简单、成本低、条件温和以及不会导致药物降解或氧化等优点而备受关注。Yang等[5]设计了自动乙醇注射法制囊泡及自动检测粒径的装置,获得一系列不同配方的磷脂载药囊泡,对囊泡配方进行优选。Justo等[6]研究了温度和放大生产对乙醇注射法制囊泡的影响,结果表明,在较高温度下制得的囊泡粒径分布更窄,能够得到更为均匀的体系,放大实验表明结果可重复。壳聚糖具有无毒、可生物降解和良好的生物相容性等优点。但采用乙醇注射法制备壳聚糖载药囊泡未见报道,一个重要的原因是乙醇注射法制囊泡要求囊材溶于乙醇而不溶于水。本文作者课题组[7]合成的高取代N,N-双长链烷基壳聚糖(NLCS)具有良好的有机溶剂溶解性,在NLCS的氨基进一步引入甲基得到N-甲基-N,N-双十二烷基壳聚糖盐酸盐(TMC),能溶于甲醇、乙醇和乙醚等,为进一步应用提供了方便。本文采用乙醇注射法制备TMC囊泡,并分别以维生素B12和酮洛芬作为亲/疏水性模型药物,研究不同pH值制备介质中制得的载药TMC囊泡的载药性能。
1 实验部分
1.1 主要仪器和试剂
Nexusu 470 型傅里叶变换红外光谱仪(Nicolet);Vario MICRO 元素分析仪(Elementar);THZ-82型恒温振荡器(江苏常州国华仪器厂);TU-1810紫外可见分光光度计(北京普析通用仪器有限公司);FD-1B-50冷冻干燥机(北京博医康实验仪器有限公司);ZEN3600纳米激光粒度及 Zeta电位分析仪(Malvern);超速冷冻离心机(Kendro SORVALL)。
1.2 N-甲基-N,N双十二烷基壳聚糖盐酸盐的制备
参照本实验室的方法合成 N,N-双十二烷基壳聚糖(NLCS)[7],见图1。然后将1g NLCS溶解于100 mL四氢呋喃中,加入过量碘甲烷,50 ℃下回流搅拌反应72 h。旋转蒸发仪除去溶剂和过量的碘甲烷,真空干燥得N-甲基-N,N-双十二烷基壳聚糖碘酸盐(TMIC)。将TMIC溶解于少量乙醇中,分别用 NaCl溶液和去离子水透析,冷冻干燥至恒重得N-甲基-N,N-双十二烷基壳聚糖盐酸盐(TMC)。制得的产物能溶于乙醇等有机溶剂。采用元素分析法,由C/N 摩尔比计算产物的季胺化取代度为0.75,高的季胺化度提高了产物的亲水能力。
1.3 TMC载药囊泡的制备
参照文献[6]的操作制备载亲/疏水性药物囊泡。
(1)载亲水性药物囊泡的制备 将 50 mg N-甲基-N,N-双十二烷基壳聚糖盐酸盐溶解于1 mL乙醇中。在450 r/min搅拌下以100 μL/min的速度缓慢滴加到50 ℃的含维生素B12的水溶液或pH值为 4.0和pH值为 1.2的盐酸溶液中。滴加完后继续搅拌90 min,以挥发尽乙醇,即得载药囊泡。将囊泡溶液调为中性。超速冷冻离心除去未包封的药物得载维生素B12囊泡。
(2)载疏水性药物囊泡的制备 将 50 mg N-甲基-N,N-双十二烷基壳聚糖盐酸盐和8 mg酮洛芬溶解于1 mL乙醇中,在450 r/min搅拌下以100 μL/min的速度缓慢滴加到50 ℃的水溶液或pH值为4.0和pH值为1.2的盐酸溶液中。按照(1)操作得载酮洛芬囊泡。
1.4 载药囊泡的体外释放
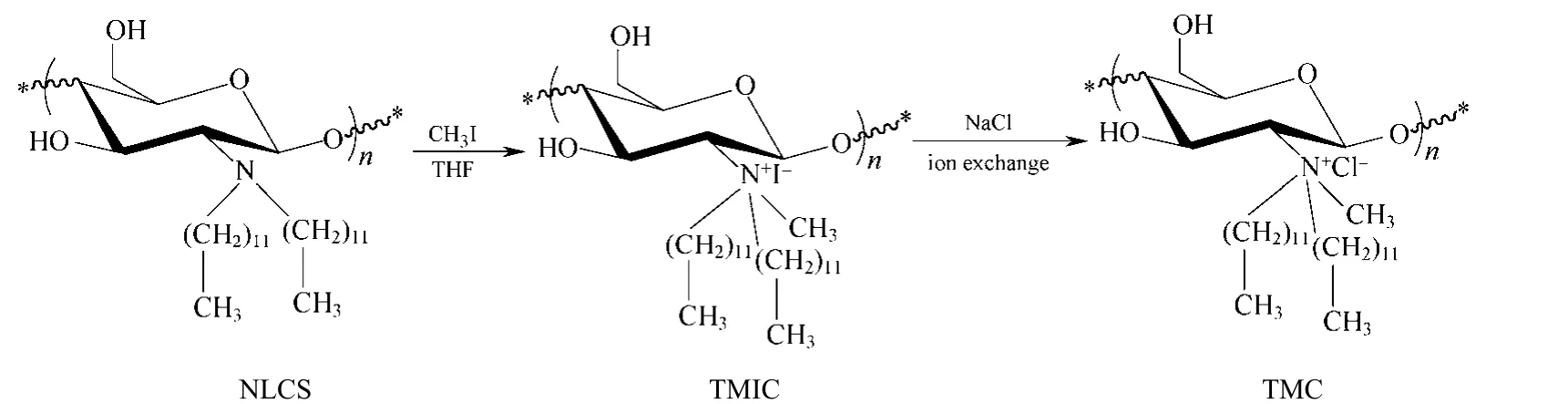
图1 N-甲基-N,N-双十二烷基壳聚糖盐酸盐的制备
取一定量载药囊泡于透析袋中,在模拟肠液或模拟胃液中释放。间隔一定时间取出5 mL透析液,再补充5 mL相应的新鲜介质。取出的溶液在361 nm(维生素B12)或260 nm(酮洛芬)下测定吸光度。根据相应的线性回归方程计算释放量绘制释放曲线。
1.5 载药囊泡的包封率和载药量
根据标准曲线回归方程计算释放平衡时药物的总释放量M1(g)。然后将透析袋中的囊泡倒出,加入其5倍体积的无水乙醇将囊泡破坏后,分光光度计测定未释放药物的质量 M2(g)。总投药量为 M(g),囊泡质量为M3(g)。载药囊泡的包封率和载药量计算如式(1)、式(2)。

2 结果与讨论
2.1 N-甲基-N,N-双十二烷基壳聚糖盐酸盐的FT-IR分析
采用 KBr压片法,测得CS、NLCS和TMC的FT-IR如图2所示。CS上1520~1640 cm−l的混合谱带是氨基的变形振动吸收峰,而 NLCS和 TMC上这个峰消失,表明其氨基已经发生了反应。与CS相比,NLCS 和 TMC 在 2850 cm−l和 2920 cm−l左右的 C—H 伸缩振动峰增强,说明其在壳聚糖上引入了甲基和亚甲基。并且NLCS和TMC在1470 cm−l和720 cm−1附近出现了新峰,其中1470 cm−1是亚甲基的C—H变形振动,720 cm−1是(CH2)n(n≥4)基团的骨架吸收峰,说明两种产物都引入了长链烷基。对比NLCS与TMC的红外谱图,两者亚甲基与甲基峰面积的比值不同,NLCS在2850 cm−1亚甲基峰面积与1380 cm−1甲基峰面积的比值为0.576,而TMC为0.220。亚甲基与甲基峰面积比值的降低说明NLCS已季铵化。
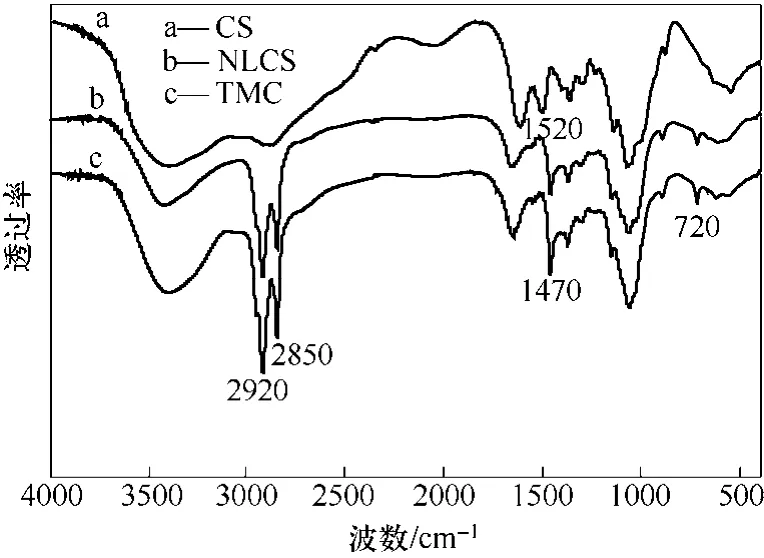
图2 原料及产物的FTIR谱图
2.2 囊泡的粒径分布及Zeta电位
囊泡的粒径大小及其分布影响药物在体内的滞留时间,测定粒径及其分布可以预测制剂的体内行为,为优化制备工艺及其配方提供依据。乙醇注射法制得的囊泡粒径可通过调整制备参数来改变,如囊材组成及浓度、注射速度、囊材/溶液比例、温度及搅拌速度等[5-6]。调节制备水相pH值成本低、操作简便、可操作性强。本文主要研究pH值对TMC囊泡的影响。
取囊泡混悬液,25 ℃下用激光粒度仪测定在不同介质中制得的载不同药物囊泡的粒径、分布以及Zeta电位,结果见表1。可见,制得的囊泡粒径范围在50~100 nm,多分散系数为0.17~0.26。Justo等[6]研究表明,制备介质pH值对乙醇注射法制得的磷脂囊泡粒径影响不大。而表1显示,降低制备水相pH值可使TMC囊泡粒径大大降低,这可能是因为制备介质pH值的变化对N-甲基-N,N-双十二烷基壳聚糖盐酸盐的自组装行为产生了影响,本文将在2.4节引入Langmuir膜技术进一步讨论。囊泡的粒径大小除了影响药物在体内的滞留时间外,还会影响囊泡的释药行为,这将在后面囊泡的释放性能中进一步讨论。
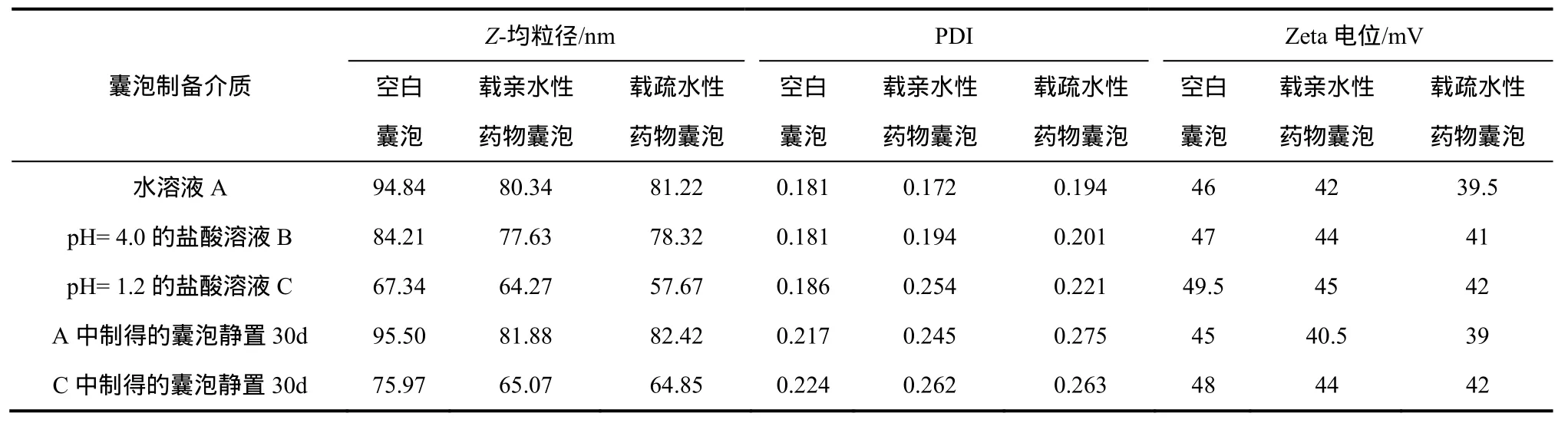
表1 囊泡的粒径大小、分布以及Zeta电位
将在不同介质中制得的囊泡静置30天,均未出现沉淀或分层现象。制备介质为水溶液的囊泡静置前后粒径几乎不变,而制备介质为pH值为1.2盐酸溶液的囊泡静置后粒径略有增大(约8 nm)。这可能是因为制备介质为pH值为1.2的囊泡制备完成后将pH值调至中性,结果囊泡在静置过程中略微溶胀。不同囊泡静置后PDI只是略微增大,说明不同制备介质下制备的囊泡在 30天内均保持较好的稳定性。
Zeta电位一定程度上可反映微粒分散体的稳定性,通常认为Zeta电位绝对值大于30 mV时微粒分散体能稳定存在,即微粒之间需要克服较高能垒才能聚集在一起[8]。表1显示,各种囊泡的Zeta电位均大于35 mV,说明囊泡能够稳定存在。载疏水性药物囊泡的Zeta电位降低较多,可能因为囊泡表面吸附着一些药物或疏水性药物部分镶嵌到囊泡表面,降低了囊泡的表面电荷[9]。制备介质pH值降低,囊泡的Zeta电位也略为增大,这可能因为囊泡粒径的降低,增大了囊泡表面的电荷密度[9]。静置30天后,囊泡的Zeta电位只是略为降低,进一步说明囊泡能稳定存在。
2.3 囊泡的体外释放性能
2.3.1 载亲水性药物囊泡的释放曲线
按照实验部分 1.4节的操作进行载维生素 B12囊泡的释放试验。取出的溶液在UV361 nm下测定吸光值,根据维生素 B12的线性回归方程(模拟肠液:A=0.05829C−0.00036,R2=0.9995。模拟胃液:A=0.05692C+0.0032,R2=0.9985。线性范围均为0~53.6 μg/mL)计算释放量,绘制不同介质制备载亲水性药物囊泡在不同释放介质下的药物释放曲线如图3,符合缓控释制剂0~2 h内药物累计释放率需低于30%的要求[10]。由图3可见,在不同pH值的释放介质中,制备介质的pH值越低,囊泡药物释放速率和平衡释药率越低。一般地,囊泡的粒径较小其药物释放率和平衡释放率较高[9]。而本文制备介质pH值降低后,TMC囊泡粒径减小(表1),药物释放率和平衡释放率反而下降,这可能是因为介质pH值降低增加了N-甲基-N,N-双十二烷基壳聚糖盐酸盐的亲水性,使囊泡自组装更易形成,囊泡变得更为致密,这将在2.4节中引入Langmuir膜技术进一步讨论。

图3 不同介质制备载亲水药物囊泡在不同介质的释放曲线

图4 不同介质制备载疏水药物囊泡在不同介质的释放曲线
由图3还可以看出,同一介质制备的载亲水性药物囊泡在不同释放介质的释放速率和平衡释放率相差不大,说明释放介质的pH值变化对载维生素B12的TMC囊泡释药行为影响较小。这与阿奇霉素囊泡在不同pH值下的释放行为没有明显变化的结果一致[11]。
2.3.2 载疏水性药物囊泡的释放曲线
按照实验部分1.4节的操作进行载酮洛芬囊泡的释放试验。取出的溶液在UV260 nm下测定吸光值,根据酮洛芬的线性回归方程(模拟肠液:A=0.0681C−0.007,R2=0.9999。模拟胃液:A=0.0611C+0.0101,R2=0.9998。线性范围均为0~30 μg/mL)计算释放量,绘制不同介质制备的载疏水性药物囊泡在不同释放介质的药物释放曲线如图 4,同样符合缓控释制剂的释药要求。由图4可见,与载亲水性药物囊泡的释放曲线规律相似,在不同pH值的释放介质下,制备介质的pH值越低,囊泡药物释放速率和平衡释药率越低。同一介质制得的载疏水性药物囊泡的释放行为相差不大。
比较图4和图3可以发现,同一介质下制得的载疏水性药物囊泡的释放速率和平衡释药率比载亲水性药物囊泡的高,并且载疏水药物囊泡的突释更加明显。而不同介质制得的载疏水性药物囊泡药物释放行为变化程度比载亲水性药物囊泡药物释放行为变化低。这可能是因为疏水性药物主要包含在囊材的疏水微相中,能够更好地扩散出来[12]。
2.4 不同亚相pH值下TMC的Langmuir膜行为
囊材的 Langmuir膜行为与囊泡的药物释放行为有很大的联系[3]。改变亚相的pH值测得TMC的Langmuir膜π-A等温线如图5所示。由图5中可以看出,随着亚相 pH值的降低,TMC的 Langmuir膜π-A等温线逐渐向左移,极限分子表面积逐渐降低,说明单分子膜排列得更为紧密;崩溃压略有升高,说明Langmuir膜稳定性上升。TMC的Langmuir膜行为表明,在较低的pH值下,TMC具有更好的成膜性,亦即在较低pH值下,TMC能够更好地自组装,这与2.2节和2.3.1节的分析一致。
2.5 包封率和载药量测定
按照实验部分1.5节操作,测定在不同介质中制得的载亲/疏水药物 TMC囊泡的载药量和包封率,结果见表2。
从表2可见,由于乙醇注射法制备载亲水性药物囊泡是将药物分散在水相,所以制得的囊泡包封率和载药量比较低,可考虑将含药物的水相重复使用。并且载亲水性药物囊泡的载药量比载疏水性药物低,这可能是因为在形成囊泡时,亲水性药物倾向于扩散到体积更大的液相中,而疏水性药物则倾向于包埋到囊泡的疏水层中[13]。采用乙醇注射法制备 TMC载疏水性药物囊泡的载药量高于逆相蒸发法制备 N,N-双十二烷基壳聚糖囊泡的载药量 0.14 mg/mg[7],并且高于微乳化法制备羧甲基壳聚糖十八烷基季铵盐囊泡的载药量0.20 mg/mg[8]。

图5 不同亚相pH值下TMC的Langmuir膜π-A等温线
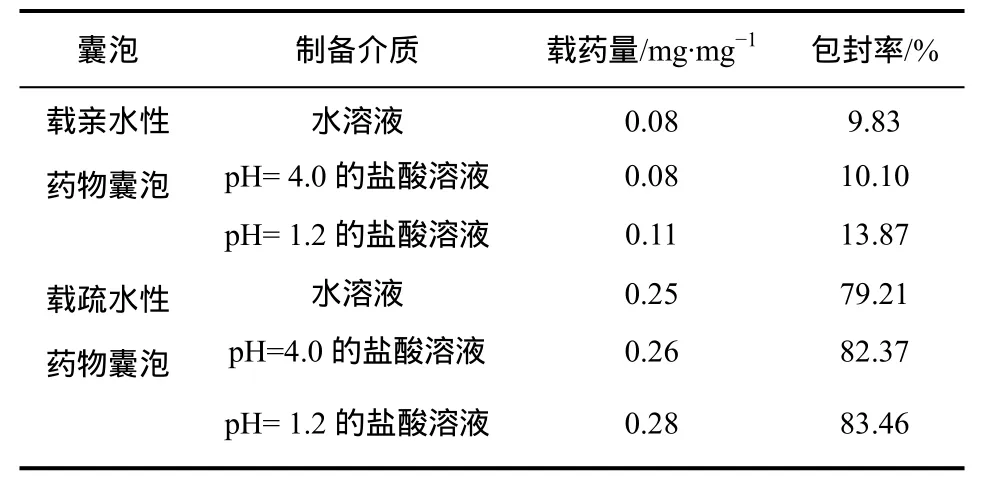
表2 不同介质制备囊泡的载药量和包封率
由表2还可以看出,制备介质的pH值降低,所制得的载亲/疏水性药物囊泡的包封率和载药量均有所提高。这可能是因为在酸性条件下制得的囊泡较为致密,制备过程药物泄漏较少;并且因为囊泡体积较小(表 1),总表面积较大,药物包封量增加[9]。
3 结 论
以壳聚糖为原料制备 N-甲基-N,N-双十二烷基壳聚糖盐酸盐(TMC),烷基链取代度达 1.58,季铵化取代度为0.75,季铵化增加了产物亲水性。产物可溶于乙醇、甲醇、氯仿和四氢呋喃等有机溶剂中,为进一步制备自组装囊泡提供方便。采用乙醇注射法制备TMC囊泡,研究不同pH值介质中制得的载亲/疏水TMC囊泡的载药及释放性能。结果表明,制得的TMC自组装囊泡为纳米级,静置30天后仍保持稳定。Langmuir膜行为研究表明在较低pH值下TMC更易自组装,但制备介质pH值不同对囊泡的粒径、药物释放行为影响较大,而释药环境pH值对囊泡的药物释放行为影响较小,为N-甲基-N,N-双十二烷基壳聚糖盐酸盐自组装载药囊泡的应用提供依据。
[1]Tian B,Tao X G,Ren T Y,et al. Polypeptide-based vesicles:Formation,properties and application for drug delivery[J]. Journal of Materials Chemistry,2012,22:17404-17414.
[2]邓英杰. 脂质体技术[M]. 北京:人民卫生出版社,2007.
[3]Li M C,Su S,Xin M H,et al. Relationship between N,N-dialkyl chitosan monolayer and corresponding vesicle[J]. Journal of Colloid and Interface Science,2007,311:285-288.
[4]Gianolio E,Porto S,Napolitano R,et al. Relaxometric investigations and MRI evaluation of a liposome-loaded pH-responsive gadolinium(iii) complex[J]. Inorg. Chem.,2012,51:7210-7217.
[5]Yang K,Delaney J T,Schubert U S. et al. Fast high-throughput screening of temoporfin-loaded liposomal formulations prepared by ethanol injection method[J]. Journal of Liposome Research,2012,22(1):31-41.
[6]Justo O R,Moraes  M. Analysis of process parameters on the characteristics of liposomes prepared by ethanol injection with a view to process scale-up:Effect of temperature and batch volume[J].Chemical Engineering Research and Design,2011,89:785-792.
[7]Li M C,Xin M H,Su S. Novel biomaterial study Ι:N,N-dilong chain alkyl chitosan (NCS) for self-assembled nanovesicle and NCS/PLLA blend for tissue engineering scaffold[J]. Proceedings of the International Conference on BioMedical Engineering and Informatics,2008,1:748-750.
[8]Chatterjee S,Salaun F,Campagne C,et al. Preparation of microcapsules with multi-layers structure stabilized by chitosan and sodium dodecyl sulfate[J]. Carbohydrate Polymers,2012,90:967-975.
[9]Laouini A,Jaafar-Maalej C,Gandoura S,C et al. Spironolactoneloaded liposomes produced using a membrane contactor method:An improvement of the ethanol injection technique[J]. Progr. Colloid.Polym. Sci.,2012,139:23-28.
[10]国家药典委员会. 中华人民共和国药典[M]. 北京:化学工业出版社,2010.
[11]钟萌,谭群友,冯悦. 阿奇霉素囊泡体外释放行为的初步研究[J].中国抗生素杂志,2012,37(6):476-480.
[12]Liang X F,Hu J Y,Chen F H. Characterization of chitosan polymeric ethosomes capable of encapsulating hydrophobic and hydrophilic drugs prepared by a microemulsion method[J]. Acta Phys. Chim. Sin,2012,28(4):897-902.
[13]Yin Y T,Misni M,Kah H L. Effect of ph on physicochemical properties and encapsulation efficiency of PEGylated linolenic acid vesicles[J]. E-Journal of Chemistry,2012,9(2):729-738.

