乙型肝炎病毒X基因在涎腺腺样囊性癌中表达的实验研究
谢玲 王卫红 许彪 刘屿
1.新津县人民医院口腔科,成都 611403;2.昆明医科大学附属口腔医院口腔颌面外科,昆明 650031
近年来,随着分子生物学研究的进展,越来越多的研究表明,全球8%~17%的肿瘤与病毒或细菌等慢性感染有关,如乙型肝炎病毒(hepatitis B virus,HBV)与肝癌[1]。然而HBV可感染身体其他部位[2-3],在这些器官、组织和细胞中均可检测到HBV DNA。这说明HBV嗜肝性不十分严格,有一定的泛嗜性。研究[4-5]表明唾液中也可检测到HBV,涎腺组织也易感染HBV[6]。乙型肝炎病毒X基因(hepatitis B-virus X gene,HBX)对肝癌的发生、发展起重要作用,涎腺组织也易感染HBV,推测HBX在涎腺腺样囊性癌(adenoid cystic carcinoma,ACC)中可能存在表达,且对ACC的发生、发展可能起着重要作用。本研究利用临床手术中保留的ACC新鲜组织标本,探讨HBX在ACC中的表达及其意义。
1 材料和方法
1.1 标本和方法
选取2008年6月—2012年10月就诊于昆明医科大学附属口腔医院口腔颌面外科的涎腺肿瘤患者为研究对象。经患者同意后,行HBV血清学检查。将临床手术中切取的部分新鲜涎腺肿瘤标本放入-196 ℃液氮罐中备用,根据血清学检查和术后病理结果将患者分为ACC组和对照组(涎腺腺淋巴瘤组),每组14例。每组中男6例,女8例,年龄26~53岁,平均42.5岁。无论血清学结果中HBeAg是阳性或阴性,以HBeAb阳性为HBV携带者或曾感染者[7-8]。
1.2 主要试剂
乙型肝炎病毒X抗体(Abcam公司,英国),通用型免疫组化试剂盒(福州迈新生物技术开发有限公司),总RNA提取试剂和Quant cDNA第一链合成试剂盒(北京天根生化科技有限公司)。
1.3 免疫组织化学染色
取冻存的部分涎腺肿瘤组织行石蜡包埋,石蜡块作4 μm切片供免疫组织化学染色。SP免疫组织化学法检测涎腺肿瘤标本中HBX的表达,HBX抗体浓度配制为原浓度的1/200倍。以PBS代替一抗作为阴性对照。以肿瘤细胞胞浆出现棕黄色颗粒且着色强度高于背景非特异性染色者判断为阳性。在相同光源强度下,每张切片随机选取10个视野,每个视野下选取5张图片(×400),保存图像格式为TIFF。应用Image-Pro plus 6.0软件对图像进行分析,录制Macro中测量参数包括光密度矫正、平均光密度、面积最小值。取得每个视野的平均光密度值。
1.4 逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)检测HBX mRNA的表达
取冻存的部分涎腺肿瘤组织,提取总RNA,逆转录合成cDNA,聚合酶链反应(polymerase chain reaction,PCR)扩增,β-actin为内参,PCR反应所用引物设计如下。HBX上游引物序列为5’-GGAAGACACAATGAAGAAT-3’,下游引物序列为5’-CACCACAGGAATATCAGT-3’,产物大小为169 bp;β-actin上游引物序列为5’-TGCGTGACATTAAGGAGAA-3’,下游引物序列为5’-AAGGAAGGCTGGAAGAGT-3’,产物大小为172 bp。反应条件为:95 ℃30 s,55 ℃ 45 s ,72 ℃ 30 s,共30循环,72 ℃延伸5 min。用1%琼脂糖凝胶电泳检测PCR产物,采用BIO-RAD凝胶成像系统进行凝胶成像。应用Gel-Pro analyzer 4.0软件对PCR图像进行分析,分析涎腺肿瘤标本中HBX mRNA表达(光密度值)。分析前将图片色彩进行反转,重复3次,取平均值。
1.5 统计学处理
采用SPSS 13.0统计学软件对实验数据进行分析。对于两组中HBX的表达率,非参数数据加权后,采用Crosstabs卡方分析;对于两组中HBX的表达强度,其独立样本定量资料进行t检验统计分析,以P<0.05为两组间差异有统计学意义。
2 结果
每组中抗HBeAb阳性和阴性者各7例(表1)。28例涎腺肿瘤组织中,14例HBeAb阳性涎腺肿瘤中HBX阳性表达10例,另14例HBeAb阴性涎腺肿瘤中HBX阳性表达1例,HBeAb阳性涎腺肿瘤中HBX阳性率明显高于HBeAb阴性涎腺肿瘤(χ2=12.13,P<0.01)。而ACC组和对照组中HBX阳性率无明显差异(χ2=1.348,P=0.246)(表1)。HBX大多数表达于细胞质内,小部分表达于胞核内。HBX免疫组织化学染色为胞浆棕黄染色(图1),HBX在ACC中表达强度强于涎腺腺淋巴瘤,其平均光密度值分别为0.238±0.022、0.157±0.021,二者间差异有统计学意义(t=7.909,P<0.01)。RT-PCR结果显示HBX mRNA水平在ACC中高于涎腺腺淋巴瘤,其平均光密度值分别为0.171±0.046、0.075±0.006,二者间差异有统计学意义(t=3.437,P=0.029)。
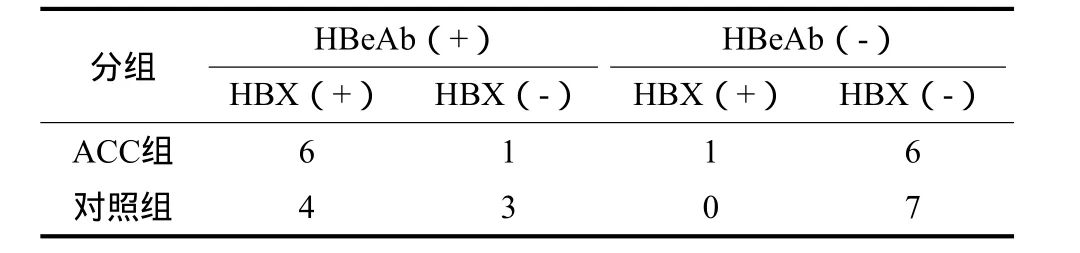
表1 HBX在不同涎腺肿瘤组织中的表达Tab 1 The expression of HBX in different salivary tissues n=14
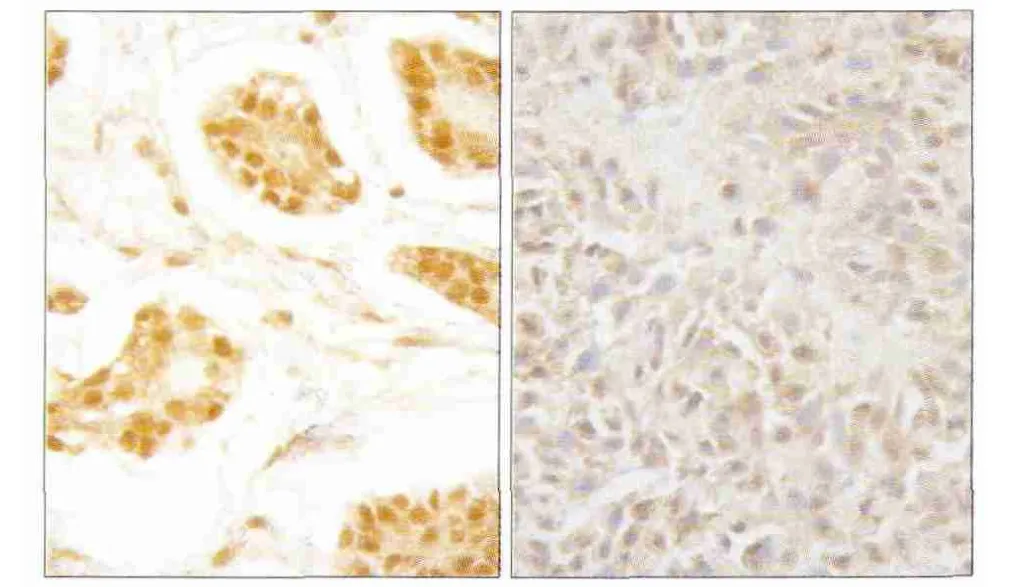
图1 HBX在ACC和涎腺腺淋巴瘤中的表达 SP × 400Fig 1 Expression of HBX in ACC and Warthin tumor SP × 400
3 讨论
HBX基因是HBV 4个开放读码框架(open reading frame,ORF)中最小的一个编码。HBX主要定位于细胞质内,小部分位于细胞核内。胞质中的HBX参与调控多条影响细胞生存、分化的信号转导通路。而胞核中的HBX具有反式激活作用,HBX蛋白的反式激活功能区内有与p53结合的位点。HBX与p53结合后,胞质中的p53进入细胞核受阻,使p53蛋白进入细胞核发挥正常负调节功能的过程受影响,导致p53基因的负调节功能失活,从而抑制p53诱导的凋亡,并与HBX一起反式激活,从而抑制p53介导的细胞凋亡,二者长期相互作用导致细胞表型发生改变而最终导致肿瘤的发生[9-10]。
目前国内外有关HBX基因的研究,多源于HBV相关性肝癌,而对于HBX基因在人体其他组织中的研究则较少[11]。以往研究[4-6]表明HBV嗜肝性不十分严格,有一定的泛嗜性,HBV对涎腺组织有较强的亲和力,唾液中HBV可源于受染的唾液腺组织。由于唾液中存在着HBV,可能导致口腔上皮细胞损害及炎症的发生,从而引起口腔肿瘤的发生。Takata等[12]认为HBV感染与口腔良性肿瘤存在相关性。笔者研究表明HBeAb阳性涎腺肿瘤中HBX阳性率明显高于HBeAb阴性涎腺肿瘤(P<0.01),初步说明HBX在涎腺肿瘤的表达与HBV感染有关。免疫组织化学染色结果显示HBX在ACC和涎腺腺淋巴瘤中存在表达,平均光密度值分别为0.238±0.022、0.157±0.021,二者间差异有统计学意义(P<0.01)。RT-PCR结果显示:ACC组和对照组HBX mRNA平均光密度值分别为0.171±0.046、0.075±0.006,二者间差异有统计学意义(P=0.029),HBX在ACC中表达明显高于对照组。说明HBX在ACC的发生、发展过程中可能扮演重要的角色。但本研究结果同时显示,ACC组和对照组中HBX阳性率无明显差异(P=0.246),可能是因为本组样本量仅为28例,且没有正常涎腺组织的对照,因此两组间HBX阳性率无明显差异并不能说明HBV感染与涎腺肿瘤无关。有1例HBeAb阴性ACC组织中HBX阳性表达,可能存在既往HBV感染,这需要进一步大量临床资料研究证实。
初步研究表明HBX在ACC中存在表达,防治HBV感染,也许可阻断癌基因HBX的表达,促进涎腺肿瘤细胞的凋亡。然而关于HBV感染与ACC或涎腺肿瘤的关系,还需进一步研究探讨。
[1]Yang JD, Roberts LR. Epidemiology and management of hepatocellular carcinoma[J]. Infect Dis Clin North Am, 2010,24(4):899-919.
[2]Chen LZ, Fan XG, Gao JM. Detection of HBsAg, HBcAg,and HBV DNA in ovarian tissues from patients with HBV infection[J]. World J Gastroenterol, 2005, 11(35):5565-5567.
[3]Komatsu H, Inui A, Sogo T, et al. Tears from children with chronic hepatitis B virus (HBV)infection are infectious vehicles of HBV transmission: experimental transmission of HBV by tears, using mice with chimeric human livers[J]. J Infect Dis, 2012, 206(4):478-485.
[4]Kidd-Ljunggren K, Holmberg A, Bläckberg J, et al. High levels of hepatitis B virus DNA in body fl uids from chronic carriers[J]. J Hosp Infect, 2006, 64(4):352-357.
[5]Meo SA, Assad AA, Sanie FM, et al. Transmission of hepatitis-B virus through salivary blood group antigens in saliva[J]. J Coll Physicians Surg Pak, 2010, 20(7):444-448.
[6]Chen L, Liu F, Fan X, et al. Detection of hepatitis B surface antigen, hepatitis B core antigen, and hepatitis B virus DNA in parotid tissues[J]. Int J Infect Dis, 2009, 13(1):20-23.
[7]Sogut I, Hatipoglu I, Kanbak G, et al. Monoclonal antibodies speci fi c for hepatitis B e antigen and hepatitis B core antigen[J]. Hybridoma: Larchmt, 2011, 30(5):475-479.
[8]Kaijima H, Yukimasa N, Sugano E, et al. Analysis of the relevance of the mutations of the precore and basic core promoter in HBV genome with the DNA amount of HBV viremia[J]. Rinsho Byori, 2009, 57(4):332-337.
[9]Zhang SJ, Chen HY, Chen ZX, et al. Possible mechanism for hepatitis B virus X gene to induce apoptosis of hepatocytes[J]. World J Gastroenterol, 2005, 11(28):4351-4356.
[10]Park SG, Min JY, Chung C, et al. Tumor suppressor protein p53 induces degradation of the oncogenic protein HBX[J].Cancer Lett, 2009, 282(2):229-237.
[11]Rawat S, Clippinger AJ, Bouchard MJ. Modulation of apoptotic signaling by the hepatitis B virus X protein[J]. Viruses,2012, 4(11):2945-2972.
[12]Takata Y, Takahashi T, Fukuda J. Prevalence of hepatitis virus infection in association with oral diseases requiring surgery[J]. Oral Dis, 2002, 8(2):95-99.

