出血性脑卒中患者急性期外周血内皮祖细胞数量变化的初步研究
宋黄成 张 松 朱为民 虞 聪 俞俊杰 刘一坤 袁斌斌
1)江苏海门市人民医院神经外科 海门 226100 2)复旦大学附属华山医院神经外科 上海 200040
脑卒中(Stroke)具有高发病率、高致残率和高致死率,是当前严重威胁人类健康的三大主要疾病之一。随着当今社会的老龄化,脑卒中发病率还在不断增高。脑卒中高居西方发达国家人口死亡原因第3位,也是导致残疾的首要原因。在我国,脑卒中是目前发病率、致死率、致残率占首位的疾病。全球每年有554万人死于脑卒中[1]。我国每年有近150万人死于脑卒中,并新增200万患有残疾的幸存者。随着我国人口老龄化的加速,我国脑卒中的发病率正以每年近9%的速度上升,脑卒中已成为威胁老年人健康的主要疾病之一。脑卒中包括缺血性和出血性卒中两种。脑出血(intracerebral hemorrhage,ICH)是常见的脑血管类疾病,属于脑卒中的一种,占卒中发病率的15%。因发病原因不同分为两类,第一类是高血压性脑出血,由于高血压导致动脉粥样硬化及淀粉样病变从而引起脑出血,这是脑出血中的主要类型;第二类是由于动静脉畸形(AVM)、动脉瘤(aneurysm)及其他凝血功能紊乱造成的脑出血。高血压脑出血常发生于大脑半球深部的基底节区域,主要出血部位在脑内毛细血管级别的小血管中,如大脑中动脉的二级分支豆纹动脉、基底动脉的脑桥支等。出血型脑卒中相对于缺血型脑卒中具有更高的病死率和致残率,我国每年130万~150万人发病,病死率为40%~60%,存活者遗留严重残疾的约占40%。
Asahara等[2]于1997年首次从外周血单核细胞中提取出具有干细胞的增殖能力的CD34(+)的细胞亚群,同时发现其可以分化为成熟内皮细胞并命名为内皮祖细胞(endothelial progenitor cell,EPC)。越来越多的研究发现,EPC在特定细胞因子(VEGF、GM-CSF、SDF-1、IL-6、EPO、Statins等)的趋化作用下迅速集中于血管损伤或内膜缺损部位,维持内皮细胞的完整性并参与血管的修复和再生。大量的动物和临床试验已证实增加外周血中功能性EPC的含量或动员内源性的EPC均可保护机体血管内皮系统的稳态,防止内皮损伤所造成的病变进一步加重[3-5]。目前外周血中内皮祖细胞可作为评估患者内皮损伤程度和血管修复能力的重要指标。有实验研究指出,在大鼠脑出血后,血管新生的相关因子的表达量会上调。研究发现,在脑出血后检测到VEGF、Flt-1和Flk-1等血管新生的相关因子表达量上调[6],认为脑出血可引起血管新生。而内皮祖细胞作为新生血管内皮细胞的前体细胞,必然参与血管新生和血管修复的过程。至今国内关于出血性脑卒中患者外周血中急性期内皮祖细胞数量变化的研究少有报道,本文将通过初步检测3例急性脑出血的患者第1~10天外周血中内皮祖细胞的数量变化和部分功能研究,探讨出血性脑卒中患者急性期外周血中内皮祖细胞与患者预后的关系。
1 材料和方法
1.1研究对象急性脑出血患者3例(具体资料见表1),来源于本院2013-01—02住院患者,其中左侧基底节区脑出血2例,出血量分别为50mL和90mL(破入脑室),右侧基底节区脑出血1例,出血量为20mL。如图1所示。
1.2仪器FACSCalibur流式细胞仪,美国BD公司产品,用CELLQuest软件(BD公司)获取和分析实验数据。SF 23000血球计数仪,日本东亚公司产品。
1.3试剂CD34-PE单抗,同型对照IgGa2PE、KDR-APC均由德国美天旎公司提供,红细胞裂解液由美国BD公司提供,EGM-2细胞培养液由美国LONZA公司提供,人纤维连接蛋白由Sigma公司提供,Dil标记的乙酰化低密度由Molecular Probes公司提供,FITC标记的Ⅰ型荆豆凝集由Sigma-Aldrich公司提供,DAPI由 Molecular Probes公司提供,6孔细胞培养板由美国Corning公司提供,PBS由美国Gibco公司提供。
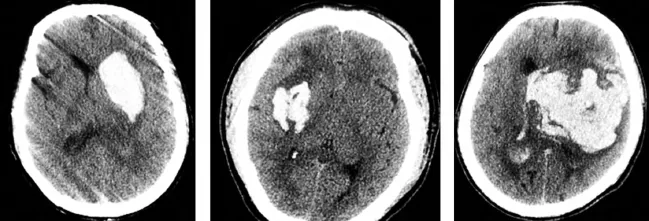
图1 3例高血压脑出血患者急诊入院头颅CT显示出血情况 a为60岁左侧基底节区脑出血的患者,出血量约50mL,b为约50岁左侧基底节区脑出血的患者,出血量约20mL,c为约80岁左侧基底节区脑出血的患者,出血量约为90mL,且破入脑室

表1 3例病人的资料
2 方法
2.1标本处理采集EDTA.K2抗凝的静脉血1~2mL,加入1X红细胞裂解液10mL,混匀,室温孵育15min,1 000 rpm离心5min。弃上清,混匀,加入3~5mL PBS,1 000 rpm离心5min×2次。弃上清,加入80μL PBS重悬后加入10μL CD34-PE和10μL KDR-APC抗体并置于4℃暗室孵育30min后,1 500rpm离心5min。弃上清,加入500μL PBS重悬后,1 500rpm离心5min×2次。弃上清,加入400 μL PBS重悬后至流式管中上机检测。对照管中作类似处理。
2.2仪器设置和数据分析用FACSComp调整FSC、SSC、FL2和FL3电压。用CELL Quest软件获取100000个细胞进行分析。以对数FSC作为X轴,对数SSC作为Y轴,选取有核细胞圈门P2。以对数 KDR-APC作为 X轴,对数SSC作为Y轴,Format P3到本窗中,选取KDR阳性细胞圈门P3。另开一个窗,以对数CD34-PE作为X轴,对数SSC作为Y轴,Format P3到本窗中。以对照管调整mark的位置。在同等的实验条件下,用以分析测定管(见图2)。P4框内即为循环内皮祖细胞群值。
2.3统计学处理采用SPSS统计软件分析,计数资料用(s)表示,2组间均数比较采用ANOVA检验。
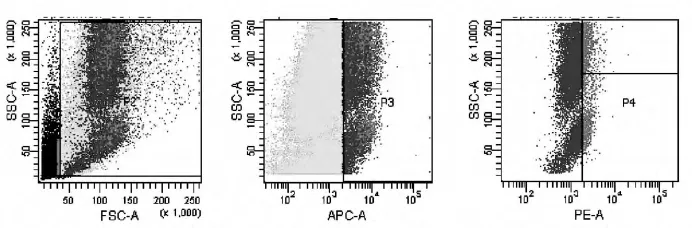
图2 流式细胞术检测循环内皮祖细胞图(P4框内为循环内皮祖细胞群)
3 结果
3.1 3例脑出血患者第1~第10天外周血中内皮祖细胞的测定结果(见图3)。从图3a我们看出,50岁和60岁患者在出血的超急性期外周血中EPC含量很高,几乎为急性期的最高峰,然后随时间延长其含量逐渐降低,第4天几乎达到最低值,术后第7天和第5天再次升高。而80岁患者在急性期第2天外周血中EPC达到最高峰,然后随时间逐渐下降,第6天再次达到高峰。而图3b通过统计分析可以得出,脑出血患者在超急性期EPC被大量动员,达到最高峰,然后随时间延长其含量逐渐降低,第4天降到最低值,第7天再次达到一个新的峰值。
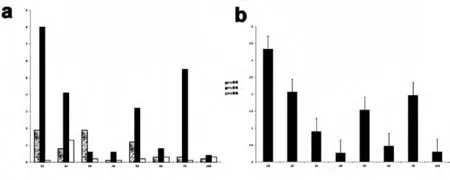
图3 图a示分别测定3例脑出血患者第1~第7及第10天外周血中内皮祖细胞的变化情况,b示3例患者第1~第7及第10天外周血中内皮祖细胞的整体变化趋势
3.2 50岁患者外周血中超急性期内皮祖细胞的培养和鉴定在第2例患者入院当天通过流式检测该病人外周血中EPC含量很高,遂在病人知情同意下通过静脉抽取肝素抗凝的外周血20mL,用PBS等倍稀释后加入淋巴细胞分离液,通过密度梯度离心的方法提取单核细胞(如图4)。然后将细胞按照密度为1×106个/L接种在加有EGM-2完全培养液的预涂纤连蛋白的6孔培养板中,置37°C、5%CO2饱和湿度培养箱中培养。3d后换液,将未贴壁细胞弃之。此后每隔3d更换培养液。每天拍照观察细胞生长情况和形态变化(如图5)。并对细胞行内皮细胞内吞功能测定(Dil-ac-LDL与FITC-UEA-1)和流式鉴定[CD31(+)KDR(+)]。见图6。

图4 密度梯度离心法提取外周血MNC 下面箭头所指为外周血加入淋巴细胞分离液离心后看到的明显的白沫层,即单核细胞层
4 讨论
内皮祖细胞于1997年被Asahara等[2]学者在外周血中首次发现,该细胞在各种趋化因子的诱导下能够从骨髓中动员,迁移并聚集到血管损伤部位,替换受损的内皮细胞并分化成成熟的内皮细胞从而保持内膜完整,维持血管内皮系统的稳态,并可作为评价血管内皮功能的一个有效标志物[7-8]。目前尚无关于内皮祖细胞表面抗原特异性鉴定的统一标准,但普遍认为CD34(+)KDR(+)细胞为外周血中循环内皮祖细胞,因此本文也将二者双阳性的细胞定义为PBEPC(如图2)。
高血压脑出血,因脑血管破裂引起脑血流循环障碍和脑组织功能或结构的损害,又称为出血性脑卒中。组织病理证实高血压患者血管病理变化主要为细动脉的硬化。因此在脑血管破裂前,患者必定存在血管内皮细胞的损伤。而内皮祖细胞目前可作为一个良好评估血管内皮功能的maker,同时其数量和功能可作为血管修复能力的一个有效指标。我们通过检测3例高血压脑出血患者连续7d和第10d外周血中内皮祖细胞的变化,观察3例高血压脑出血病人在出血急性期骨髓中的EPC被大量动员,并随时间推移EPC被消耗,而出血后第7天EPC再次在外周血中达到高峰。因此我们的假设是在高血压脑出血的急性期,由于损伤血管释放IL-6、TNF-α等趋化因子,骨髓池中的EPC被募集到血管损伤部位,从而参与血管的修复。而无论是开颅血肿清除术抑或是保守治疗,随着血肿的减少或吸收和血肿周围水肿的逐渐减轻,破裂血管周围脑组织的功能恢复乃至神经再生非常依赖新生的血管。血管新生的一种是从已有的血管上长出芽孢从而形成新的毛细血管[9]。而内皮祖细胞作为血管内皮细胞的前体细胞也必然参与血管新生的过程。故出血后第7天再次达到高峰。同时发现EPC的动员与年龄有一定的相关性,年龄越大,动员能力越差。图3a显示80岁患者在超急性期外周血EPC未达到最高峰,相反在出血后第1天达到峰值,而且急性期总体动员能力远不如50岁和60岁患者。说明EPC的动员能力可能随年龄增长减弱。通过前文论述推测,在同龄同部位同出血量情况下,排除影响EPC的诸多因素外,EPC的动员和患者的预后存在一定的相关性。另外,我们通过培养某一超急性期外周血EPC含量最高患者的单核细胞,发现该患者在接种时即有很多小锤状的细胞,而培养1周左右该细胞便大量增殖并形成类似晚期EPC的旋涡状,而进一步的培养并未形成晚期EPC。我们猜想:该患者被大量动员到外周血的EPC,也许较正常人存在功能上的某些缺陷,从而无法形成典型的铺路石样晚期EPC。由于无法培养出晚期EPC,我们无法与正常人进行克隆增殖能力、成管能力、迁移能力的比较,从而无法准确进行细胞功能的鉴定。但该患者从一定意义上说明了高血压脑出血患者外周血中EPC存在功能缺陷。另外,通过对3例患者急性期每天CCS评分发现,外周血中EPC含量高的患者恢复相对较快。如前文所述,脑出血本身可引起血管新生,毫无疑问,EPC参与血管新生,且含量越高,越能促进和加快血管新生,从而改善卒中区脑组织血供,改善患者预后。EPC变化可能与脑卒中的预后有密切关系,有望作为出血性脑卒中预后观察的指标。
查阅国内文献,多数研究集中于出血性脑卒中患者急性期内皮祖细胞(EPC)数量的变化与卒中危险因素或炎症因子方面[10-12],目前尚无文献报道脑卒中患者急性期外周血内皮祖细胞的动员情况和细胞功能变化。我们初步探讨了3例高血压脑出血患者急性期外周血中EPC的变化,虽然在一定层面上说明了EPC的动员情况和部分功能变化,但由于样本量太小,无确切的统计学意义。因此,今后大样本的出血性脑卒中患者急性期外周血内皮祖细胞的数量和功能变化有待进一步研究。

图5 在低细胞密度、低血清环境下分离和纯化的患者外周血单个核细胞(PBMMNs),于含有VEGF、FGF、IGF-1、EGF等生长因子的环境中成功培养出内皮祖细胞(PBEPCs)。a为刚接种的细胞,箭头所示为如同锤状的不规则细胞,可能为动员到外周血中的EPC;c为接种1周后细胞形成漩涡状,如同晚期EPC形态,d为20倍镜看到的典型的早期EPC形态,纺锤状不规则形态;e为接种近2周后细胞的状态,形成具有克隆能力的“集落”;g为接种近3周时细胞的状态,未看到典型的鹅卵石或铺路石样的晚期EPC。a,c,e,g分别为10倍镜图,标尺为200μm;b,d,f,h为20倍镜图,标尺为100μm

图6 a:人外周血内皮祖细胞免疫荧光鉴定 Dil-ac-LDL与 FITC-UEA-1荧光双染(c)(DiI-acLDL为红色,FITC-UEA-1为绿色,Dapi为蓝色;b:EPC流式鉴定结果:CD31 99.6%(d),KDR 85.5%(e),CD31(+)KDR(+)90.7%(f)
[1]Kochanek KD,Xu J,Murphy SL,et al.National vital statistics reports[J].National Vital Statistics Reports,2011,59(4):1.
[2]Asahara T,Murohara T,Sullivan A,et al.Isolation of putative progenitor endothelial cells for angiogenesis[J].Science,1997,275:964-967.
[3]Urbich C.Endothelial progenitor cells:Characterization and role in vascular biology[J].Circulation Research,2004,95:343-353.
[4]Miller-Kasprzak E,Jagodziński PP.Endothelial progenitor cells as a new agent contributing to vascular repair[J].Archivum Immunologiaeet Therapiae Experimentalis,2007,55:247-259.
[5]Zampetaki A,Kirton JP,Xu Q.Vascular repair by endothelial progenitor cells[J].Cardiovasc Res,2008,78:413-421.
[6]Tang T,LiuXJ,Zhang ZQ,et al.Cerebral angiogenesis after collagenase-induced intracerebral hemorrhage in rats[J].Brain Research,2007,1 175:134-142.
[7]Dzau VJ,Gnecchi M,Pachori AS,et al.Therapeutic potential of endothelial progenitor cells in cardiovascular diseases[J].Hypertension,2005,46:7-18.
[8]Murasawa S,Asahara T.Review:Cardiogenic potential of endothelial progenitor cells[J].Therapeutic Advances in Cardiovascular Disease,2008,2:341-348.
[9]Carmeliet P,Jain RK.Molecular mechanisms and clinical appli-cations of angiogenesis[J].Nature,2011,473(7347):298-307.
[10]周伟君,朱鼎良,李燕,等 .循环内皮祖细胞与急性脑卒中及脑血管危险因素的相关研究[J].中华老年心脑血管病杂志,2006,8(8):510-512.
[11]钟立新,刘志强,韩明,等 .急性缺血性脑卒中炎性指标与循环内皮祖细胞的关系[J].岭南急诊医学杂志,2011,16(1):25-26.
[12]赖贤良,邓志峰 .出血性脑卒中患者血管内皮祖细胞与相关危险因素的关系[J].南昌大学学报(医学版),2011,51(2):18-20;24.

