无氯仿提取小麦半籽粒DNA的方法
刘永安,潘彬荣,岳高红,梅喜雪,许立奎,张宗宸,周志辉
(1. 浙南作物育种重点实验室温,浙江 温州325006;2. 温州市农业科学研究院,浙江 温州325006)
分子标记是研究小麦遗传和育种的重要技术手段,既可以研究小麦种质资源的遗传多样性,又可以对农艺性状进行辅助选择,具有不受时间限制、针对性强、效率高等优点。通常,用于分子标记的DNA 是从小麦的幼叶中提取的。在研究过程中,虽然可以随时萌发种子获取幼叶用以提取DNA,但小麦的生长受一定季节的限制。如果没有温室等设施,在不适宜小麦播种的季节进行分子标记辅助选择,选择出的目标植株将不能正常生长,甚至不能获得种子,而这些设施正是一些基层科研单位所缺少的。而从远离小麦胚的半粒种子中提取DNA 是解决该问题的有效途径。从半粒种子中提取的DNA 用于分子标记,剩下的半粒种子可适时播种,不需借助温室等设施。
目前,小麦种子DNA 的提取已有较多报道[1-2]。在提取的过程中,通常会用到苯酚、氯仿、异戊醇等试剂。然而,氯仿受公安部门管制,购买时需要公安部门审批[3],对一些基层科研单位,购买氯仿不但相对困难,而且还比较费时。因此,研究尝试探索一种不用氯仿的小麦籽粒DNA 提取的简单方法,以便为基层科研单位进行小麦分子标记提供技术支持。
1 材料与方法
1.1 试验材料
以含有Pm21 基因的扬麦18 为研究对象,该材料从江苏省里下河地区农业科学院引进。主要试验试剂有Tris、浓盐酸、EDTA、SDS、NaCl、乙醇、醋酸铵等,以上试剂均为分析纯。
1.2 试验方法
1.2.1 小麦幼叶DNA 提取 参考柴建芳等[4]的方法提取,但最后不加RNA 酶,该法提取的DNA 作为从籽粒提取DNA 的对照。
1.2.2 有氯仿小麦籽粒DNA 提取 参考董建力等的方法进行提取,该法提取的DNA 作为无氯仿小麦籽粒提取DNA 的对照。
1.2.3 无氯仿小麦籽粒DNA 提取 用刀片切取半粒小麦种子(有胚和无胚),置于1 张干净称量纸上,将称量纸对折以便使小麦籽粒留于中间;用研棒将籽粒研碎,移于1.5 mL 离心管中;加入700 μL DNA 提取缓冲液(100 mmol/L Tris·HCl pH 8.0,50 mmol/L EDTA,500 mmol/L NaCl,2%SDS),65℃水浴约30 min,其间摇匀数次;冷却至室温,于4℃下13 000 rpm 离心15 min;取500 μL 上清液于一新的1.5 mL 离心管中,加入50 μL 10 mol/L 醋酸铵和1 mL 95%乙醇,上下颠倒7~8 次,于4℃下13 000 rpm 离心10 min;弃上清液,加入500 μL 70%乙醇,上下颠倒7~8 次,于4℃下13 000 rpm 离心2 min;弃上清液,于37℃恒温箱中干燥1 h;加50 μL TE缓冲液溶解DNA。
1.2.4 DNA 质量检查 取2 μL DNA 样品与1 μL 6×DNA Loading Buffer 混合,于1%琼脂糖凝胶(含EB)上电泳15 min 检查DNA 质量。
1.2.5 PCR 检测 用多重PCR 检测扬麦18 的3个Wx蛋白亚基(Wx-A1、Wx-B1 和Wx-D1)基因和抗白粉病基因Pm21,其反应体系及扩增条件参考许立奎等[5]的方法,引物序列及预扩增条带见表1。

表1 引物序列及其预扩增片段
2 结果与分析
2.1 DNA 质量检测
由图1 可知,3种提取方法都能得到DNA 条带,但不同方法所取得的DNA 量有所不同,从叶片中提取的和用氯仿提取的DNA 浓度较高,没有用氯仿提取的DNA 浓度较低。同时,有研究表明不同提取方法和小麦籽粒不同部位提取RNA 的浓度有显著差异,从叶片中提取的和从有胚半粒小麦种子中提取的RNA 的浓度较高,从无胚半粒小麦种子提取RNA 的浓度较低。另外,从叶片中提取的RNA 片段较小,用有氯仿方法从有胚半粒种子提取的RNA 片段较大,而用无氯仿方法从有胚半粒种子提取RNA 片段呈现较为均匀的弥散状态。
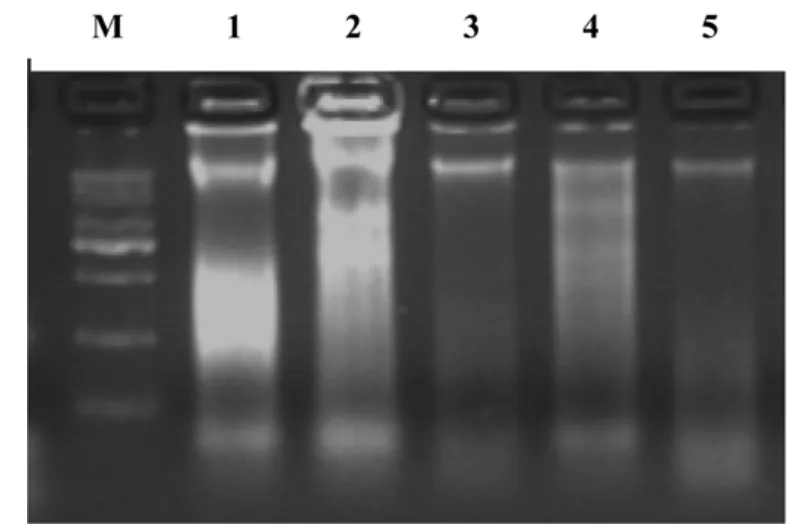
图1 小麦籽粒不同提取方法DNA 凝胶电泳图谱
2.2 多重PCR 检测
如图2 所示,用各种方法提取的DNA 进行扩增,基本都能得到目标条带Wx-D1(204 bp)、Wx-A1(265 bp)、Wx-B1(854 bp)和Pm21(1 400 bp),但其多重PCR 结果有明显差异,主要表现在目标条带Wx-D1(204 bp)和Pm21(1 400 bp)亮度的差异。从叶片中提取的DNA 扩增效果最好,各目标条带都较亮;用氯仿提取的半粒种子DNA 扩增效果稍差,泳道2(有氯仿有胚半粒提取DNA)的Wx-D1(204 bp)条带不明显;没有用氯仿提取的半粒种子的DNA 扩增效果也较差,从有胚和无胚半粒种子提取DNA 扩增的Pm21(1 400 bp)都较暗,这可能与模板DNA 浓度较低有关。
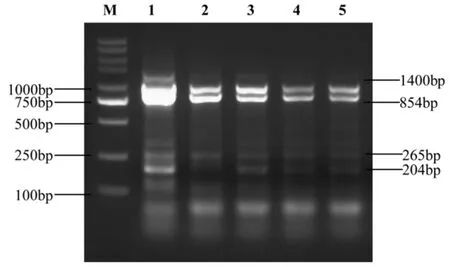
图2 不同DNA 样品多重PCR 扩增结果凝胶电泳图谱
3 讨论
研究所用的无氯仿小麦籽粒DNA 提取方法,与以前的研究相比,所需试剂没有氯仿,操作步骤少了“氯仿-异戊醇或苯酚-氯仿-异戊醇抽提”这一环节,具有所需试验试剂容易获取、操作步骤简单快捷等优点。与传统的氯仿提取方法相比,虽然该方法所得的DNA 浓度较低,但一样可用作PCR 扩增模板。
该研究用多重PCR 进行检测,与一般PCR 相比,具有所需试剂少、通量高、经济等优点[9],但也存在对模板DNA 质量要求高、引物设计困难、不同扩增片段存在竞争等问题[10]。用无氯仿提取法所得到DNA 为模板,可扩增出所有目标条带,说明该DNA 提取方法具有较好的实用性。不过,用该方法提取的DNA 为模板,所扩增出的Pm21(1 400 bp)条带较暗,需增加上样量或用聚丙稀酰胺凝胶电泳检测,以得到更为理想的效果。因此,无氯仿小麦籽粒DNA 提取方法可在对DNA 质量要求不高以及氯仿无法及时得到时使用,尤其适合基层科研单位使用。
[1]董建力,张增艳,王敬东,等.用于PCR分析的小麦种子DNA微量快速提取[J].种子,2007,26(5):10-12.
[2]任 强,张增艳,黄 鹏.半粒小麦种子DNA提取的研究[J].甘肃农业大学学报,2010,45(4):59-62.
[3]苗翠英,张 晶.论走私、贩卖易制毒化学品案件的特点及防范对策[J].公安大学学报,2002,(1):92-96.
[4]柴建芳,刘 旭,贾继增.一种适于PCR扩增的小麦基因组DNA快速提取法[J].植物遗传资源学报,2006,7(2):246-248.
[5]许立奎,潘彬荣,岳高红,等.抗白粉病糯性小麦的多重PCR分子鉴定技术[J].核农学报,2014,28(7):1203-1207.
[6]Shariflou M R,Sharp P J.A polymorphicmicrosatellite in the 3’end of‘waxy’genes ofwheat,Triticum aestivum[J].Plant Breeding,1999,118(3):275-277.
[7]刘迎春.小麦Wx基因的分子标记及其应用[D].南京:南京农业大学,2004.
[8]Liu Z,Sun Q,Ni Z,et al.Development of SCAR markers linked to the Pm21 gene conferring resistance to powderymildew in common wheat[J].PlantBreeding,1999,118(3):215-219.
[9]陈明洁,方 倜,柯 涛,等.多重PCR——一种高效快速的分子生物学技术[J].武汉理工大学学报,2005,27(10):33-36.
[10]黄银花,胡晓湘,徐慰倬,等.影响多重PCR扩增效果的因素[J].遗传,2003,25(1):65-68.

