α-AlH3的合成及热分解动力学①
秦明娜,张 彦,汪 伟,唐 望,石 强,邱少君
(西安近代化学研究所,西安 710065)
0 引言
AlH3是一种选择性的还原剂,不仅可用作储氢材料、燃料电池的氢源和聚合催化剂[1-2],而且由于它具有很高的燃烧热和比冲,可作为固体推进剂和液体推进剂的燃料[3-5]。据计算,若在固体推进剂中,以AlH3代替铝粉比冲可以提高10 s;在固液推进剂中以AlH3代替铝粉,比冲可提高32 s;在液体推进剂中,添加AlH3,比冲可提高27s。以AlH3、ADN和含能粘合剂组成的固体推进剂,其标准理论比冲可达2 883 N·s/kg,比传统推进剂高20%~25%。AlH3毒性小、环保洁净,可作为典型的高能低特征信号和洁净的推进剂的添加剂[6-7]。
由于AlH3是2种还原性的原子结合组成的物质,其稳定性较差。即使是最稳定的α-AlH3,仍有缓慢放气、分解等现象,不能满足固体推进剂配方研制的要求。所以,使用前必须进行稳定化处理[8]。因此,有必要对α-AlH3的热分解性能进行研究,以便对 α-AlH3有一个较全面的认识。目前,国内有关α-AlH3的热分解性能报道较少。
本文采用 TG-DSC联用研究 α-AlH3在不同升温速率下的热分解曲线,计算得到α-AlH3热分解活化能、指前因子和热分解动力学方程,这些数据将为研究α-AlH3稳定化和降感研究提供理论基础和实验依据。
1 实验
1.1 材料与仪器
LiAlH4,分析纯,天津市北斗星精细化工有限公司;AlCl3,分析纯,东营坤宝化工有限责任公司;甲苯,分析纯,成都科龙试剂厂;无水乙醚,分析纯,成都科龙试剂厂;盐酸,分析纯,成都科龙试剂厂。
日本理学D/max-3A型X射线衍射仪(Cu靶);日本S-5800型扫描电子显微镜;德国 NETZSCH STA 449C、TG-DSC 分析仪。
1.2 α-AlH3的合成
向 500 ml三口烧瓶中,加入 2.28 g(0.06 mol)Li-AlH4,再加入150 ml无水乙醚使其溶解,温度降至-10 ℃以下,将 2.67 g(0.02 mol)AlCl3的 100 ml无水乙醚溶液缓慢滴加到反应瓶中,控制反应温度在-5~0℃。滴加完后,继续搅拌30 min,得到白色固体2.38 g。
将上述所得白色固体加入到85℃恒温的300 ml无水甲苯溶液中,反应温度控制为(85±0.5)℃,搅拌2 h后,停止搅拌和加热,静置至室温,过滤得白色固体。乙醚洗涤固体再依次用稀盐酸和去离子水洗涤,60℃下真空干燥1 h,得到灰白色粉末2.04 g。
1.3 热分析测试
α-AlH3的 TG/DTG-DSC 在 NETZSCH STA 449C综合热分析仪上进行,样品量约为2~3 mg,升温速率为 2.5、5、10、20 ℃/min,动态气氛,氮气流量为100 ml/min。
2 结果与讨论
2.1 XRD 分析
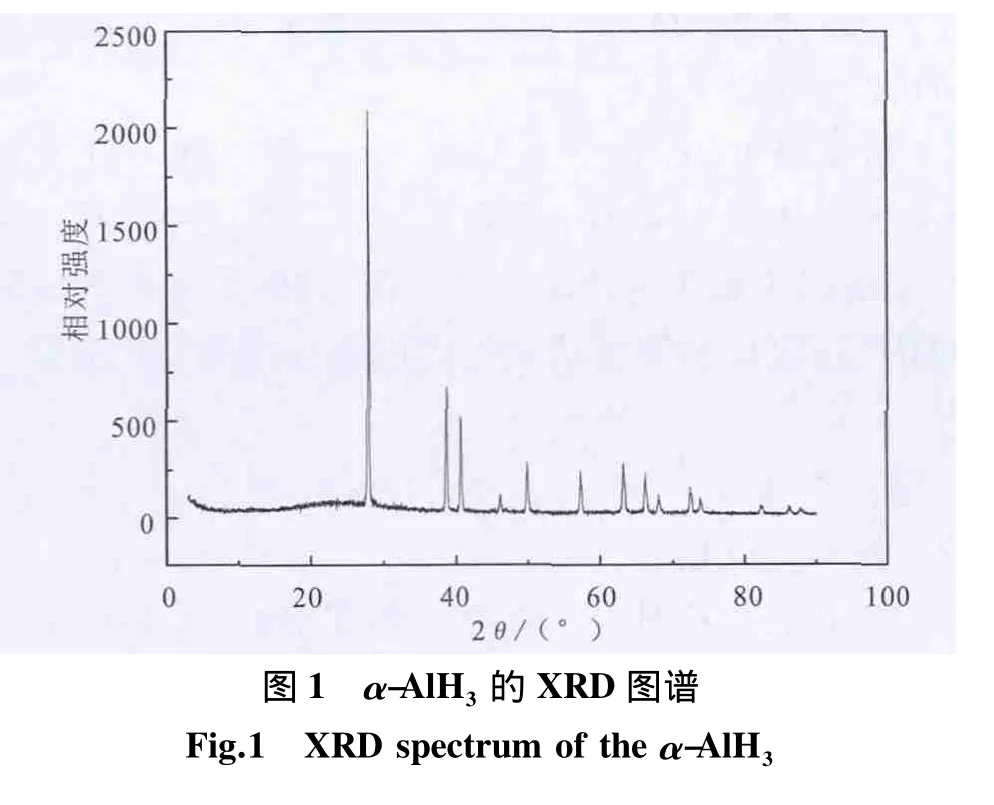
产品的 XRD 图谱如图 1 所示,在 2θ为 27.84°、38.58°、40.72°、46.1°、49.96°、57.26°、63.26°、66.26°、68.14°、72.48°、73.84°处出现衍射峰,其衍射角度和衍射峰强度与晶体衍射图库中α-AlH3衍射数据(PDF卡片号23-0761)一致,无其他杂质峰,说明产品结晶好,晶体主要为α-AlH3,无或存在少量其他晶型产物。
2.2 SEM 分析
合成的产品为灰白色粉末,其微观形貌如图2所示。由图2可看出,α-AlH3颗粒为六方形晶型,且表面无其他缺陷,粒径均匀约为5 μm。

2.3 TG-DSC 分析
在升温速率为10℃/min的TG-DSC曲线和不同升温速率的DSC线见图3和图4。
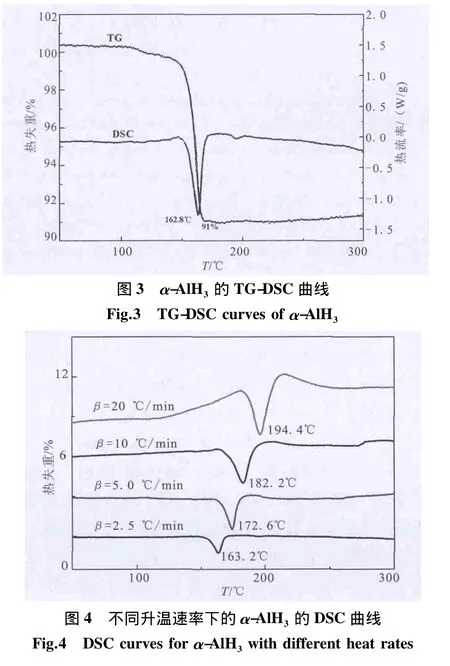
由图3可看出,在163.2℃有α-AlH3分解吸热峰,由吸热峰面积积分计算得出α-AlH3标准生成焓ΔH=-7.8 kJ/mol。由图 4 可看出,随升温速率增加,α-AlH3热分解温度逐渐升高。在计算α-AlH3分解活化能时,选用的是不同升温速率下的热分解峰温处的数据。
2.4 α-AlH3的非等温反应动力学
Brown M E 等[9]指出,在求取Arrhenius参数时,排除模型函数的影响是有利的。Kissinger法和Ozawa法都不涉及模式函数的选择,是目前较常用的多重扫描速率非等温动力学研究方法,前者是一种微分处理方法,后者是将动力学基本方程进行积分变换,并采用Doyle近似得到。根据在不同的升温速率下得到的DSC曲线,在相同转化率处的温度差异来进行动力学分析。Starink通过对Kissinger法和Ozawa法的讨论,认为这两种方法可用一个如下通式表示,并通过对温度积分的进一步分析,提出了Starink法[10]。
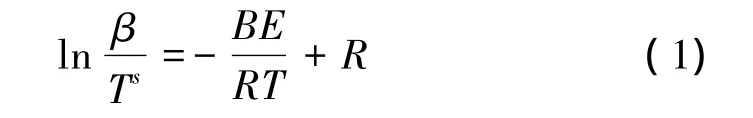
式中 β为升温速率;T为温度;E为活化能;R为气体常数;B 为常数;s=2、1.8、0,当 s=2 时,方程为 Kissinger法,系数B=1;当s=1.8时,方程为Starink法,系数B=1.003 7;当 s=0 时,方程为 Ozawa 法,系数 B=1.051 6。
研究α-AlH3热分解过程的第1个放热分解过程,用上述3种方法进行动力学研究,视分解放热达到峰顶温度Tp时转化率相同。相关数据见表1。

表1 由DSC得到的动力学基本数据Table 1 Base data of the kinetics obtained by DSC
根据上述的Kissinger、Starink和Ozawa 3种方法,分别用ln(β/Tp2)、、lnβ 对 1/Tp作图,如图5所示。
用最小二乘法进行线性拟合,得到3种方法对应的斜率分别为-12.846、-12.932、-13.755,相关系数 R分别为 0.997 3、0.997 4、0.997 5。运用 3 种方法求的活化能分别为:106.802、107.120、108.748 kJ/mol,3 种方法计算的结果具有较好的一致性,比较合理。Kissinger法的通式中常数C=ln(RA/E),线性拟合得到的截距为 18.215,计算得出指前因子 lnA=27.675 s-1。因而,可将热分解α-AlH3过程的阿累尼乌斯方程表示如下:lnk=27.675-106.802×103/RT(k 为反应速率常数)。Coats-Redfern[9]方 法 与 模 型 函 数密 切相 关,Coats-Redfern 方法如式(2):
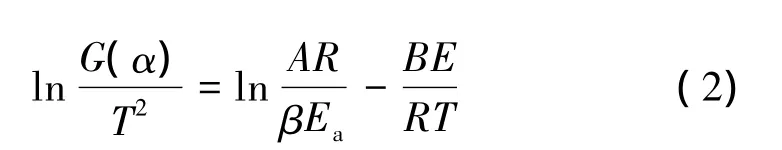
以 ln[G(α)/T2]-(1/T)作线性回归,从截距和斜率可计算出表观活化能Ea和指前因子A,以所作直线的线性回归相关系数 r和上面的 Starink、Kissinger、Ozawa法获得的活化能和指前因子为参考,确定反应过程的最可能机理函数,G(α)是从多维扩散、成核和生长、收缩的几何形状、幂指数法则、化学反应和自催化反应等21个机理函数中选择其合适的积分形式。所得结果列于表2。
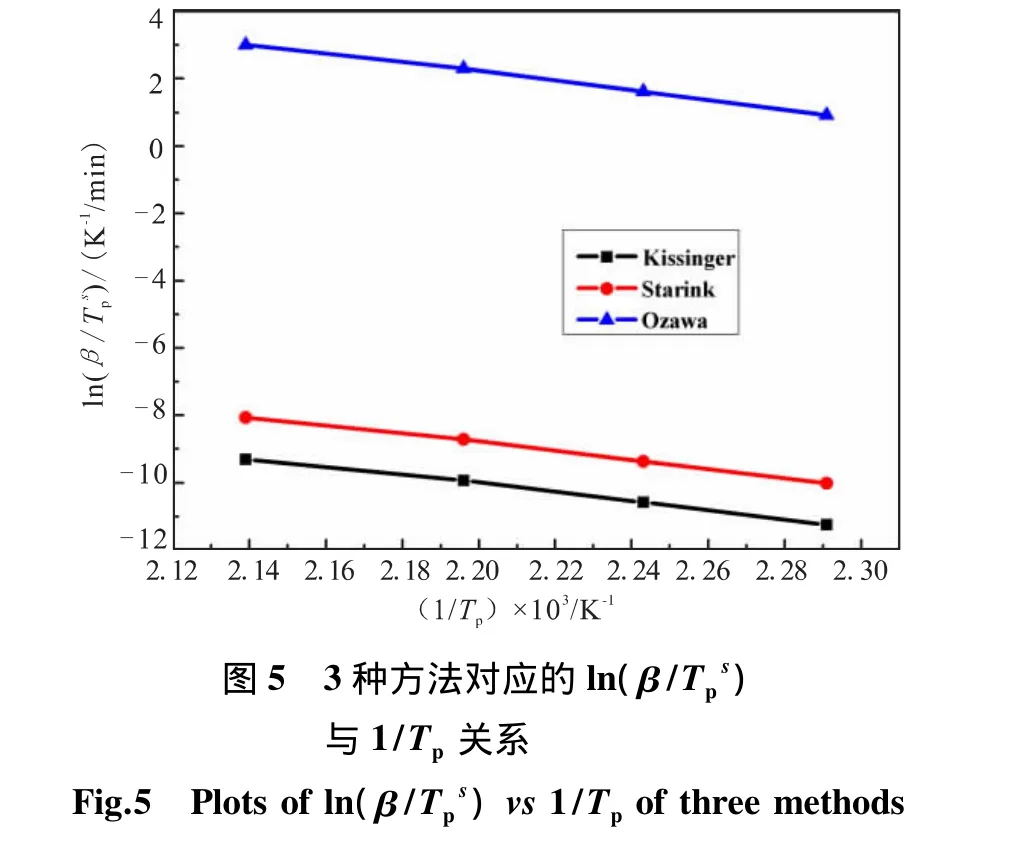
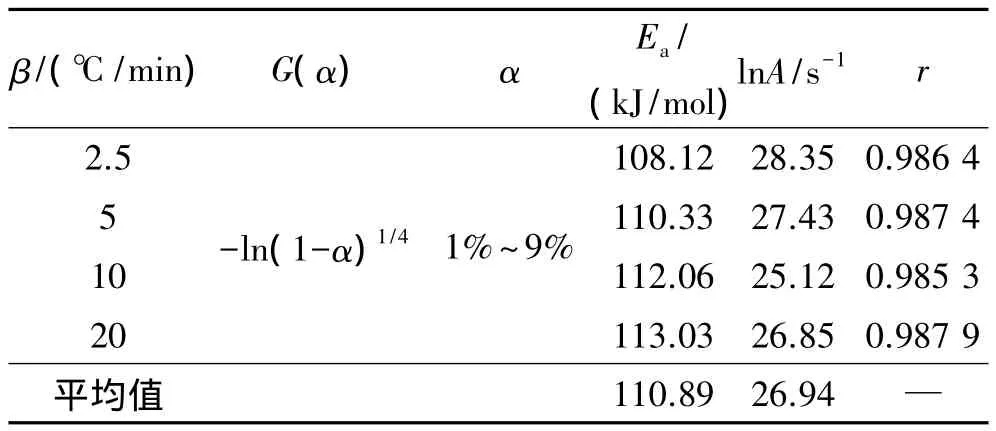
表2 Coats-Redfern方法获得的动力学数据Table 2 Kinetic parameters of α-AlH3obtained using Coats-Redfern methods at different heating rates
根据上述的判断条件,可认为α-AlH3热分解最可能机理函数为-ln(1-α)1/4,相应的微分式为 4(1-α)[-ln(1-α)]3/4,表观活化能 Ea=110.89 kJ/mol,指前因子 lnA=26.94 s-1。表明 α-AlH3热分解受成核和核生长过程控制,分解反应机理服从n=1/4的Avrami-Erofeev 方程。这与 Ismail I M[11]和 Graetz J[12]的观点一致,认为160℃以上,通过以下反应2AlH3→2Al+3H2,氢化铝发生快速分解,产生金属铝,紧接着为铝晶的成核与铝晶生长,而铝晶的成核与生长在很大程度上影响AlH3的分解。
采用4种不同的计算方法(Kissinger法、Flynnwall-Ozawa 法、Starink 和 Coats-Redfern 法)所得的动力学参数基本一致,说明各种方法所得的结果是可接受的。将最可能机理函数的微分式和所得到的动力学参数代入非等温动力学方程,得到α-AlH3热分解的动力学方程:
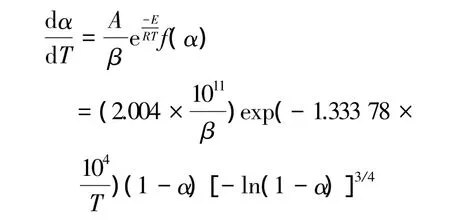
3 结论
(1)采用传统在乙醚溶液中用LiAlH4还原A1C13的方法制得了纯度较高、晶型好的α-AlH3。
(2)在动态氩气气氛中,线性升温条件下,α-AlH3热分解反应遵循随机成核和随后生长反应动力学模型,其反应活化能Ea=110.89 kJ/mol,指前因子 lnA=26.94 s-1,其热分解反应动力学方程为 dα/dT=(2.004×1011/β)exp(-1.333 78×104/T)(1-α)[-ln(1-α)]3/4。
[1]Brower F M,Matzek N E,Reigler P F.Preparation and properties of aluminum hydride[J].Journal of the American Chemical Society,1976,98(9):2450-2453.
[2]张斌,毛根旺,王赫,等.AlH3的最新研究进展[J].金属功能材料,2009,16(6):71-75.
[3]Fichtner M,Engel J,Fuhr O,et al.Nanocrystalline aluminium hydrides for hydrogen storage[J].Materials Science and Engineering,2004,B108:42-47.
[4]Bulychev B M,Verbetskii V N,Sizov A I.Non-solvated aluminum hydride.Crystallization from diethyl ether-benzene solutions[J].Russ.Chem.Bull.,Int.Ed.,2007,56(7):1305-1312.
[5]Pawelke R H,Felderhoff M,Weidenthaler C,et al.Convenient synthesis of deuterated aluminium hydrides[J].Scripta Materialia,2008(59):515-517.
[6]刘明星,何金选,曹一林.三氢化铝的合成及性能研究[J].固体火箭技术,2008,31(1):75-78.
[7]张志国,何伟国,赵传富,等.三氢化铝制备工艺及稳定性研究进展[J].化学推进剂与高分子材料,2010,8(2):11-14.
[8]陈支厦,郑邯勇,王永昌,等.新型含能材料三氢化铝在固体推进剂中的应用现状[J].船舶科学技术,2010,32(12):24-27.
[9]胡荣祖,史启祯.热分析动力学[M].北京:科学出版社,2001.
[10]冯金玲,张建国,李志敏,等.高氮含能配合物[Co(AZT)2(H2O)4〛(HTNR)2.4H2O 的合成、晶体结构及性质[J].化学学报,2010,68(24):2493-2499.
[11]Ismail I M,Hawkins T.Kinetics of thermal decomposition of aluminum hydride:I-non-isothermal decomposition under vacuum and in inert atmosphere(argon)[J].Thermochimica Acta,2005,439(1-2):32-43.
[12]Graetz J,Reilly J J,Kulleck J G,et al.Kinetics and thermodynamics of the aluminum hydride polymorphs[J].Journal of Alloys and Compounds,2007(446-447):271-275.

