利用SPR生物传感器检测缺血修饰白蛋白*
李 广, 陈龙聪, 李 贤, 杨 萌, 陈萌梦, 熊兴良
(1.重庆医科大学 生物医学工程实验室,重庆400016;
2.重庆大学 生物力学与组织工程教育部重点实验室,重庆 400044)
0 引 言
由于非心脏原因胸痛的发生率很高,所以,鉴别短暂心肌缺血和心绞痛病人一直为临床上的一个重要挑战。利用心电图检测ST段抬高只能提供有限的灵敏度和特异性。在缺乏心肌缺血“金标准”检测方法的情况下,病人需要在12~24 h内频繁地接受一系列烦琐的非特异性排查测试。尽管心肌坏死生化标志物如肌酸激酶同工酶MB(CK-MB)、肌红蛋白(myoglobin,Myo)和肌钙蛋白(cardiac troponin,cTn)对于治疗是非常重要的参数,但这些物质仅在细胞出现不可逆病变6 h后才从心肌细胞中释放出来。因此,不能用于心肌缺血的早期诊断。
无论病人是否出现心肌梗死,在病人症状刚发生时(cTn出现之前),寻找一种可靠、快速、低检测限的心肌缺血检测方法显得非常必要。缺血修饰白蛋白(ischemia modified albumin,IMA)是近年FDA批准的用于评估心肌缺血的唯一生化标志物,现广泛采用的IMA检测方法是由Bar-Or等人[1]建立的白蛋白结合钴试验(AC试验)。但该方法不是直接检测IMA,而是通过间接检测血液中白蛋白(human serum albumin,HSA)与钴离子结合从而间接检测IMA,因此,ACB法的检测结果假阳性偏多;另外,当患者血液中白蛋白浓度低于34 g/L[2]时,该方法无法用于检测IMA。再者,ACB法需使用染色剂DTT,该物质不稳定,熔点很低,在空气易挥发,且含有刺激性气味,对人体健康会造成影响。近年来又有学者[3]提出了ELISA方法检测IMA,但检测时间较长(大于1 h),处理过程复杂,操作过程繁琐。
SPR生物传感器基于入射光与金属表面的等离子发生共振的原理,建立探测生物分子间相互作用的生化分析技术,具有实时、快速、灵敏、免标记及特异性强等优点。已在病毒、蛋白质和DNA等生化物质检测[4]方面存在大量应用。但传统的SPR检测方法难以检测超低浓度的生物分子。近年来,人们开始应用各种材料如液晶分子、生物素—亲和素、纳米金、磁纳米微球、碳纳米管进行信号增强以提高SPR生物传感器的灵敏度[5]。其中,由于纳米金具有高密度、高介电常数以及高比表面积等优点,有利于提高生物识别分子的固定量,从而极大地增强检测信号,提高检测灵敏度。
本文利用纳米金颗粒和混合巯基自组装于金膜表面上,研制了一种快速、低检测限的SPR生物传感器,并比较了直接检测法与间接检测法对IMA检测下限的影响。
1 实 验
1.1 芯片表面预处理
将50 ℃,体积分数为30 %H2O2∶98 %H2SO4=1∶3的Piranha溶液清洗传感器金膜表面30 min,再用去离子水清洗3次后,氮气吹干备用。
1.2 蛋白质的固定
取10 mmol/L MHA(11—巯基十一酸)与MUOH(11—巯基十一醇)混合物(MHA∶MUOH=1∶9)滴于预处理后的芯片表面,在室温下避光反应24 h,使其表面形成一层巯基自组装单分子层。然后用酒精冲洗芯片表面,随后用大量去离子水冲洗,氮气吹干。随后,将0.1 mol/L NHS和0.4 mol/L EDC等体积混合,取20 μL滴于金膜表面反应5 h,交联活化金膜,使羧基与氨基交联在一起,提高结合的稳定性。取IMA(或抗IMA)20 μL滴于芯片表面反应8h后,用去离子水冲洗芯片表面5次,氮气吹干。然后,滴加1 mol/L,pH=8.5的盐酸乙醇胺溶液,封闭多余的羧基,以减少结合过程中羧基对IMA(或者抗IMA)的非特异性吸附。最后将制备好的传感器芯片放于4 ℃冰箱中保存,备用。
1.3 IMA—纳米金复合物制备
将IMA与10 nm 纳米金颗粒的溶液混合于pH=9的0.1 mol/L的K2CO3溶液中,振荡4 h,然后在4 ℃下以9 000 r/min转速冷冻离心25 min。移去上清液,沉淀用pH=7.4的PBS稀释。
1.4 检测方法
直接检测法:将固定有抗—IMA的传感器芯片安装好,然后以20 μL/min通入不同浓度(0~100 mg/L)的IMA溶液,使芯片上的抗IMA与IMA充分结合。每次测试完成后需通入pH=13的100 mmol/L NaOH +0.05 % SDS混合溶液进行再生,以备下次使用。
抑制检测法:不同浓度(0~100 mg/L)的抗IMA与800 mg/L IMA混合后,以20 μL/min流速通入固定有IMA的芯片表面,反应3 min,使溶液中的IMA抑制抗体与芯片表面的IMA结合,接着通入25 mg/L的抗IMA,改变IMA浓度重复实验。再生方法同上。
IMA—纳米金复合物方法操作同上。不同浓度(0~100 mg/L)的抗IMA与纳米金颗粒体积比为0.71的IMA—纳米金颗粒混合以后,以20 μL/min通入芯片表面3 min;然后,再通入3 mg/L的抗IMA+不同体积比(0~1)的IMA—纳米金颗粒复合物。
2 结果与讨论
2.1 IMA特异性对照实验
由于人血液中含有肝素、血红蛋白、胆红素、甘油三酯等干扰物质,因此,本实验首先考察了该方法的特异性来验证上述物质是否会对检测造成影响。实验通过配置相同浓度的IMA水溶液和血浆溶液,然后分别通入固定有抗IMA的传感器进行检测,SPR响应结果如图1所示。图中可以发现二者的响应值非常接近,含相同浓度的IMA水溶液和血浆溶液的SPR响应值分别为:1572±96RU和1625±137RU。说明血浆中的物质几乎不对检测结果造成干扰,即该方法具有很好的特异性。
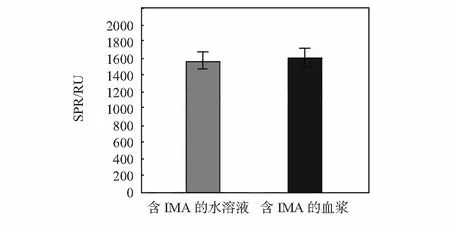
图1 IMA水溶液与含相同浓度IMA血浆溶液的SPR响应对比(实验条件:IMA=100mg/L,采用纳米颗粒)
2.2 单一自组装与混合自组装芯片比较
本实验采用裸金芯片,与常用的CM5芯片相比,自组装裸金芯片少了100 nm糖苷层,使得纳米金颗粒与芯片表面更为接近,SPR现象更明显。同时,这些糖苷结构会引起某种空间效应,自组装方法能很好地解决这一问题。由于 CM5芯片表面含有羧基,要想把蛋白质牢固地连接在芯片表面,须用巯基酸。常用的巯基酸如MUA,MHA等,有文献报道巯基醇[6]具有稳定作用,常用的巯基醇如MPOH(3—巯基丙醇),MUOH(11—巯基十一醇),且巯基醇与巯基酸混合对于蛋白质的固定有独特的优势。相同碳原子数的组合占据蛋白质的固定空间,而不同碳原子数的组合就充分利用了空间高低排布,巯基醇对蛋白质固定不会造成空间影响。而碳原子数少的巯基相对于多的来说,含碳越少越不稳定,挥发性越强,含碳多的巯基在室温下做实验有利于保持蛋白质活性。本实验分别测试了单独采用MUA自组装和MHA与MUOH混合巯基自组装,实验结果证实了混合巯基自组装性能更优越(如图2所示)。Lee E G等人[7]研究表明,这个组合比例为1∶9时,对于蛋白质的固定具有最高的SPR响应信号。本文采用的混合比也是1∶9。
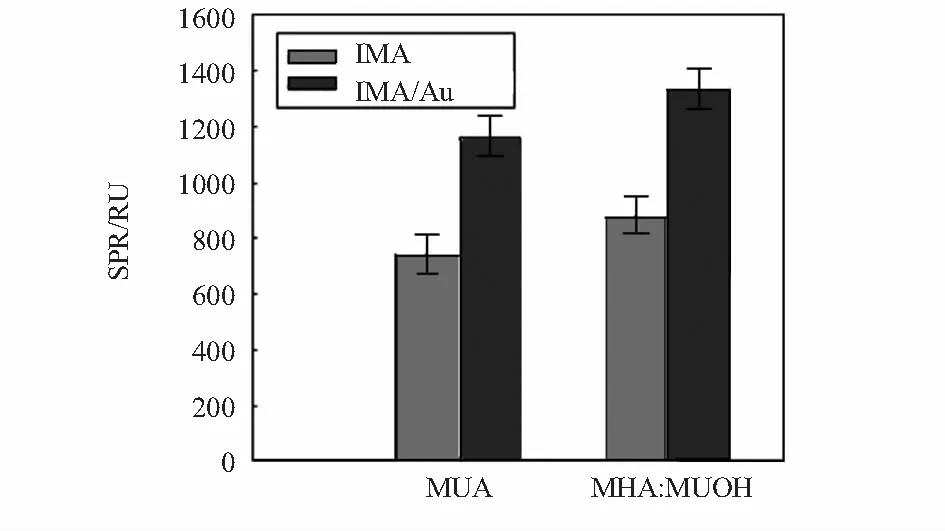
图2 混合自组装与单一自组装的SPR响应比较(IMA=80 g/L)
2.3 纳米金粒子信号放大作用
纳米金颗粒具有量子尺寸效应,可以自由给出和获取电子,同时,由于其比表面积高,十分有利于提高生物传感器中生物识别分子的固定量,进而降低检测下限。纳米金颗粒用于增强生物传感器的信号已有许多报道,但是不同直径的纳米金颗粒对于信号放大效果并不完全相同。Fernández F[8]的研究表明:SPR上采用10~20 nm金纳米颗粒信号的增强效果最显著,所以,本实验选用直径为10 nm的纳米金颗粒。
图3为有无纳米金颗粒参与反应下的SPR响应差异对比。图中可以发现,在相同IMA浓度下,有纳米金颗粒参与的反应比没有纳米金颗粒参与的反应,其SPR响应信号得到了极大地增强。前者的响应信号比后者提高将近10倍左右。因此,采用纳米金颗粒可以使生化物质的检测限得到明显的改善。
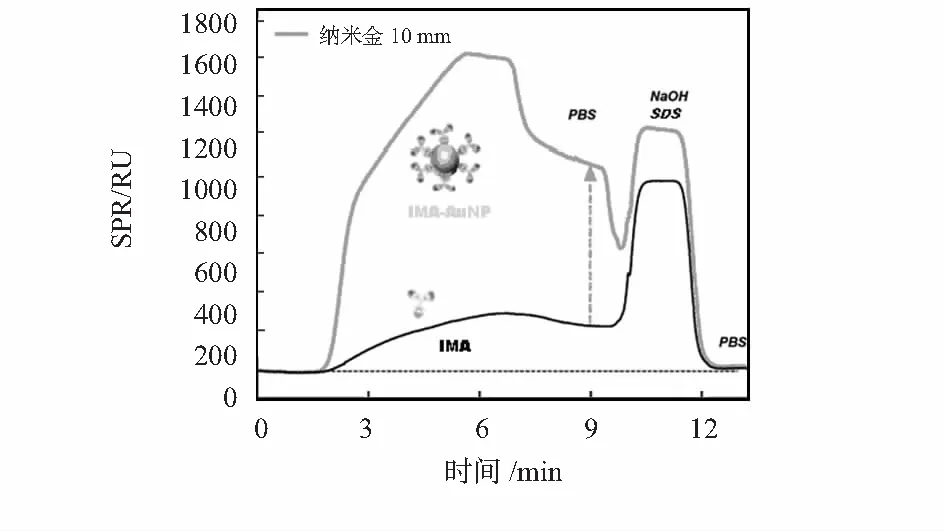
图3 加入纳米金前后SPR响应值比较(IMA=100 mg/L)
2.4 2种检测法比较
将IMA固定在芯片表面后,将不同浓度的抗IMA溶液通过芯片表面将产生响应信号。利用直接检测法可以检测到372 ng/L。对于浓度高于393.7 ng/L的IMA,可以直接通过SPR检测,不需要纳米金颗粒等的放大作用,直接进行检测。但对于浓度低于393.7 ng/L时,特别是患者刚刚出现心肌缺血时,血液中IMA含量很低(正常人为0),直接利用SPR检测就很难检测到信号变化,所以,直接法检测IMA浓度远远不能达到诊断目的。而抑制法就能很好地解决这个问题。通入不同浓度的IMA或IMA—纳米金颗粒复合物与抗IMA混合溶液。芯片表面固定的IMA越少,抗IMA裸露的位点越多,当注入IMA或IMA—纳米金颗粒复合物后,与抗IMA特异性结合产生的SPR信号越大。显然,加入纳米金颗粒极大地增强传感器响应信号,利用抑制法检测限小于5.0 ng/L。实验中分别测试了不同浓度IMA产生的响应信号。
与直接检测法相比,抑制检测法在低浓度检测中具有独特优势。3种情况下批间的变异系数(标准差/3种物质平均值)分别为3.8 %,0.9 %,0.7 %。批内的变异系数(标准差/5个单独检测平均值)分别为16.4 %,10.9 %,9.6 %。在自组装芯片表面,通过注入IMA溶液,SPR信号增强了6.1倍,然而,加入纳米金以后,SPR信号增加了9.3倍,极大地改善了检测限。直接检测时,芯片表面只通入抗IMA,抗体最低浓度为50 mg/L可得到响应信号,而通入IMA溶液以后,抗体浓度只需25 mg/L,加入纳米金颗粒以后,抗体浓度可以低到3 mg/L。3种情况下IMA检测限分别为393.7±78,45.3±6.4,5.0±1.6 ng/L。表1给出了2种检测的具体数据。结果表明:通过这种自组装纳米金方法,得到了更高的灵敏度,有效地增强了响应信号,同时,极大的降低了检测限。
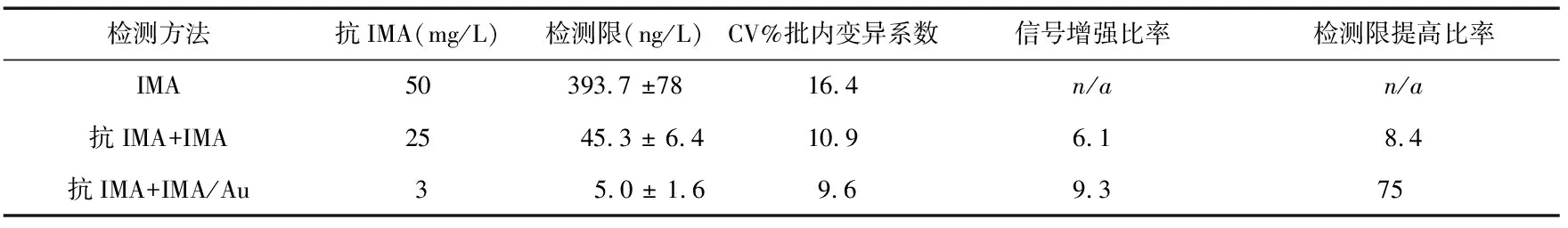
表1 SPR检测IMA各项测试结果
3 结 论
SPR生物传感器与其他方法相比,SPR预处理简单,用时短,可以同时测定多种样品。但由于仪器费用较高,而且IMA固定后要在一个星期内使用才能保持活性,所以,SPR还不是一种广泛使用的方法。目前本实验提供的方法还只能在实验室实现,但从初步的实验结果看,由于该方法具有特异性好、检测下限低,以及检测耗时短等优点,因此,对于心肌缺血的早期诊断具有较好的应用前景。
参考文献:
[1]Bar-Or D,Lau E,Winkler J V.A novel assay for cobalt-albumin binding and its potential as a marker for myocardial ischemia-a preliminary report[J].The Journal of Emergency Medicine,2000,19(4):311-315.
[2]Gaze D C,Crompton L,Collinson P.Ischemia-modified albumin concentrations should be interpreted with caution in patients with low serum albumin concentrations[J].Medical Principles and Practice,2006,15(4):322324.
[3]Oh B J,Seo M H,Kim H S.Insignificant role of the N-terminal cobalt-binding site of albumin in the assessment of acute coronary syndrome:discrepancy between the albumin cobalt-binding assay and N-terminal-targeted immunoassay[J].Biomarkers,2012,17(5):394-401.
[4]高锦航,刘 瑞,童 欢,等.表面等离子共振技术测定生长抑素含量[J].高等学校化学报,2010,31(7):1327 -1331.
[5]熊兴良,蔡绍皙,李 苑.利用液晶取向变化的光学免疫检测方法[J].高等学校化学学报,2009,30(5):891-895.
[6]Yuan J,Oliver R,Li J,et al.Sensitiveity enhancement of SPR assay of progesterone based on mixed self-assembled monolayers using nanogold particles[J].Biosensor and Bioelectronics,2007,23:144-148.
[7]Lee E G,Park K M,Jeong J Y,et al.Carbon nanotube-assisted enhancement of surface plasmon resonance signal[J].Analytical Biochemistry,2011,408:206-211.
[8]Fátima F,Sánchez-Baeza F,Marco M.Nanogold probe enhanced surface plasmon resonance immunosensor for improved detection of antibiotic residues[J].Biosensors and Bioelectronics,2012,34(1):151-158.

