基于Ag纳米粒子的LSPR传感器装置设计与实现*
刘宪华, 石潇璇, 杨娇凤, 米 玛
(1.天津大学 环境科学与工程学院,天津 300072;
2.西藏自治区环境监测中心站,西藏 拉萨 850000)
0 引 言
表面等离子体共振(surface plasmon resonance,SPR)传感技术作为一种生化检测方法,可以实时在线检测,无需标记待测物,耗样量少[1],但由于SPR生物传感器设备体积大,价格昂贵,对温度等实验条件要求严格,真正高精度自动化的商业检测装置难以推广[2]。局域表面等离子体共振(localized surface plasmon resonance,LSPR)技术不仅继承了SPR技术的优点,而且克服了SPR技术的不足,装置小型化,成本低廉,受温度等实验条件的影响小[3]。LSPR在生物传感器方面的应用受到越来越多的关注,包括利用胶体聚集的生物传感器用于蛋白识别[4]和酶活性探测[5]以及用于检测抗原—抗体识别[6,7],激素药物检测[8,9]。透射光谱检测方法是LSPR生物传感器常用的检测方法之一,可以直接在比色皿中进行检测。它的缺点是每次检测时LSPR芯片位置会发生改变,导致检测结果不准确。将检测池设计成为流动池,能够避免检测过程中换样时芯片移动产生的误差。但是先制备芯片后检测,步骤繁琐,稳定性差的问题依然存在。
本文主要是针对上述LSPR传感器系统芯片制备过程繁琐、制备与检测相互孤立等缺点,将电化学沉积法应用于LSPR芯片的制备,设计一种操作简单、小型化的原位制备LSPR芯片和用于检测的一体化的免标记LSPR生物传感器装置。
1 传感器的设计与实现
1.1 基本原理
LSPR是Au,Ag,Pt等贵金属纳米粒子传感性质的一种光谱表现形式,金属纳米粒子表面大量活跃的自由电子被入射光照射,发生集体振荡,当入射光频率与自由电子集体振荡频率相当时,产生共振,入射光被强烈吸收,在紫外可见光光谱上表现为出现明显的特征吸收峰。研究表明,纳米粒子的组成、尺寸、形状和周围介质折射率等因素均会影响LSPR性质[10]。LSPR传感器即是利用Ag纳米粒子的LSPR对外围介质变化的敏感性制备的。通过计算机采集光谱数据,并进行处理分析,获得所需信息,达到检测目的。
1.2 系统结构
原位制备检测LSPR生物传感器分为两部分:芯片电沉积系统;原位检测系统(如图1)。芯片电沉积系统由电化学工作站组成;原位检测系统由光源系统、传感系统、光谱分析系统和数据处理系统组成,光源系统由氘灯和钨灯提供紫外光和可见光光源,传感系统由光学样品流动池组成,光谱分析系统由光谱仪组成,数据处理系统由电脑和相关处理软件组成。其中,传感系统是整个传感器的核心部分,也是整合制备和检测的关键部分。
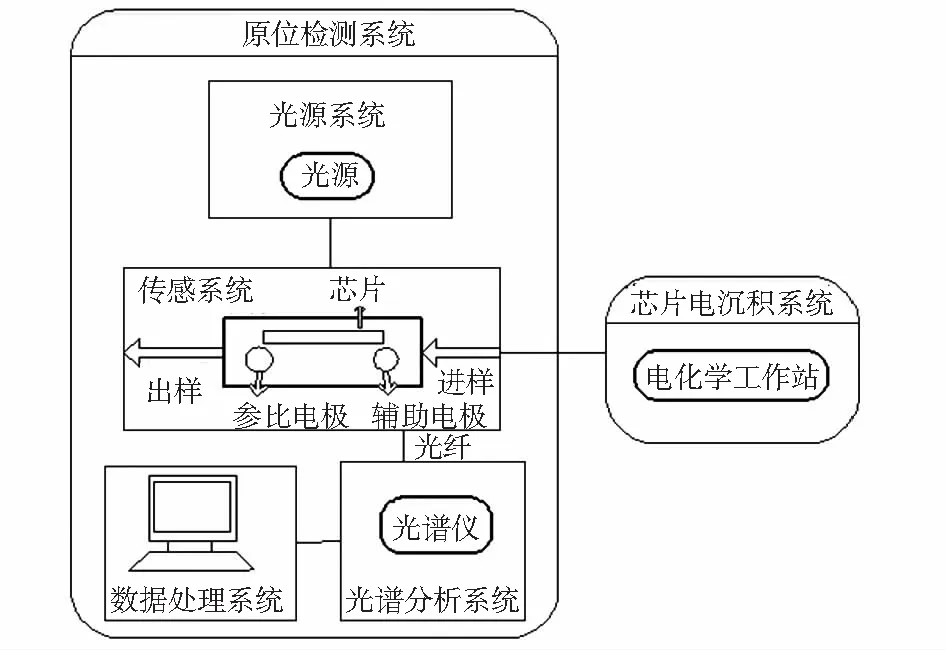
图1 传感器芯片原位制备与检测装置结构示意图
图2是传感系统中光学样品流动池的半剖结构图,光纤连接装置连接光纤和样品流动池,芯片插入芯片插口,覆盖垫圈,光纤接口装置在螺纹中缓慢推移芯片,使芯片与垫圈完全接触密封,样品池为圆柱形,样品池的另一端为石英玻璃,整个样品池空间密封,在石英片与另一光纤连接装置之间有一段空白区域,防止光纤连接装置挤压石英片影响密封,另一光纤连接装置也与光纤相连。样品由蠕动泵匀速进样,从进样口进入流动池,出样口流出,进样通道与样品池下底面相切,Pt丝电极与进样通道相接触,Pt丝设计为螺旋状,以增加接触面积。出样通道与样品池顶部相切,甘汞电极与出样口相接触。另有2个圆柱形塞子,可在不使用Pt丝电极与甘汞电极时替代电极,密封样品池空间。样品池厚度仅为3 mm,有效地缩短了光程。
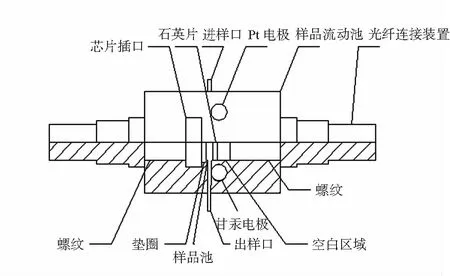
图2 光学样品流动池半剖结构图
1.3 系统检测
LSPR生物传感器芯片原位制备检测的过程如图3所示。一般选择氧化铟锡(indium tin oxide,ITO)导电玻璃做基底芯片,先以基底芯片在水中的光谱线做参比,然后通入电解液,在一定条件下电沉积法在ITO层表面自组装纳米粒子,并测得吸光光谱图,做基准值。如果只是简单地测周围介质折射率的改变,可直接通入不同折射率的溶液,记录吸光光谱的变化即可;如果做复杂的蛋白质、DNA、生物小分子等的检测,待检测物与纳米粒子无法直接作用,则需要进一步地修饰LSPR芯片表面来达到检测的目的。最后由相关的光谱分析软件实时记录和分析所得数据。整个过程制备检测一体化,实时快速便捷,无需移动,有效地减少了繁琐的步骤和移动带来的干扰。
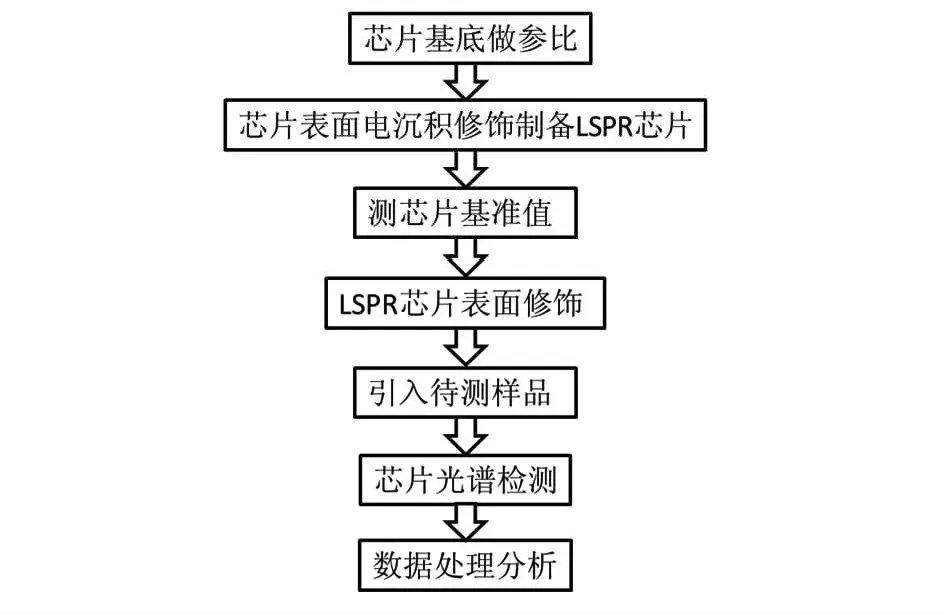
图3 LSPR生物传感器芯片原位制备与测试过程示意图
该LSPR生物传感器也适用于传统的先制备好芯片后进行检测,只需使用另外的2个圆柱形塞子代替Pt丝电极和甘汞电极密封样品池空间,其余步骤类似。整个检测过程中,芯片位置不需要移动,同样地显示出其原位检测的优点。
2 实验测试
2.1 实验步骤
本实验选用ITO层厚度为25±5 nm的ITO导电玻璃。将ITO导电玻璃切割成120 mm×20 mm的长方形,在丙酮、乙醇、超纯水中分别超声清洗10 min,氮气吹干。将清洗好的ITO导电玻璃安装在LSPR传感器装置中,导电的一面朝向样品流动池。通入含2 mmol/L AgNO3和0.5 mol/L H2SO4的水溶液电解液,Pt丝做对电极,甘汞电极做参比电极,使用电化学工作站在一定的电压下电沉积60 s,制得LSPR芯片,然后依次通入0 %(n=1.333),10 %(n=1.347 9),20 %(n=1.363 9),30 %(n=1.381 1),40 % (n=1.399 7)和50 % (n=1.420 0)质量分数的蔗糖溶液(n表示折射率),记录其吸光光谱,检测其对于周围介质折射率的敏感度。
2.2 实验结果与讨论
对ITO导电玻璃在依次在-1.2,-1.4,-1.6 V条件下电化学沉积60 s,并通入上述不同质量分数梯度的蔗糖溶液,得到的吸光光谱。其中在-1.4 V电位下制备的LSPR芯片在不同质量分数蔗糖溶液中的吸光光谱如图4所示。对吸光光谱图进行分析,得到峰位移敏感度和吸光度敏感度(表1)。ITO层厚度为23±5 nm的ITO玻璃,在电化学沉积电位为-1.2 V时,相对周围介质折射率的峰位移敏感度为238 nm/RIU,在-1.4,1.6 V时,峰位移敏感度分别为246,257 nm/RIU。由此可见,在同一ITO厚度层的条件下,当电化学沉积电位在负方向由1.2 V增大到1.6 V时,LSPR峰所处波段的红移相对于周围折射率变化增大,Ag纳米自组装LSPR芯片对周围介质折射率响应增大。

图4 ITO导电玻璃在-1.4 V电位下电化学沉积60 s
LSPR峰的吸光度数值的变化与周围介质折射率的变化呈线性关系也表现了电化学沉积法自组装的Ag纳米LSPR对于周围介质折射率的响应。ITO层厚度为23±5 nm的ITO玻璃,电化学沉积电位在负方向依次增大时,LSPR峰的吸光度数值相对周围介质折射率的敏感度分别为-0.58,-0.65,-0.32 nm/a。电化学沉积电位为-1.4 V时,吸光度灵敏度最高。厚度为23±5 nm的ITO玻璃,电化学沉积电位为-1.4 V时,表现出的246 nm/RIU的折射率灵敏度比已报道的Ag纳米球的折射率灵敏度要高[11],此条件下所制得的LSPR芯片性能最好。
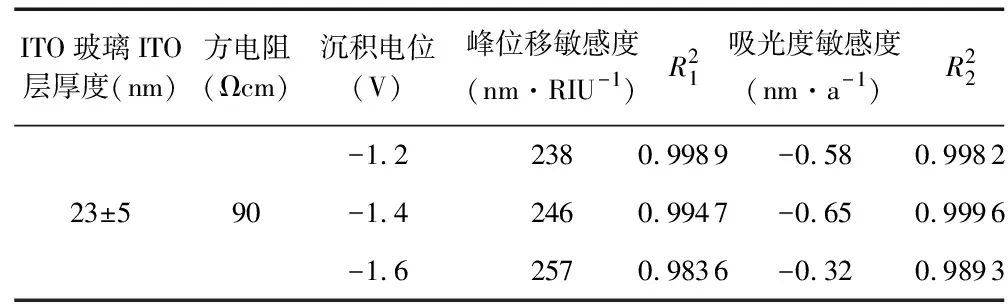
表1 ITO玻璃在不同电化学沉积电位下自组装的LSPR芯片相对于周围介质折射率的峰位移敏感度和吸光度敏感度
3 结 论
本文与电化学法相结合,设计了芯片制备和检测一体化的LSPR生物传感器。该装置具有小型化、易操作、检测结果实时化等特点,具有广阔的商业化前景。研究了不同电化学沉积电位对自组装Ag纳米粒子LSPR芯片的影响,厚度为23±5 nm的ITO玻璃,电化学沉积电位为-1.4 V时,制得的LSPR芯片折射率灵敏度为246 nm/RIU,高于已报道的Ag纳米球折射率灵敏度。
参考文献:
[1]张建碧.基于MEMS的硅微压阻式加速度传感器设计[J].电子与封装,2009,9(10):39-41.
[2]曾祥华,杨 军,田 浩,等.一种小型化SPR生物传感器的设计与实现[J].传感器与微系统,2013,32(4):109-112.
[3]张晓锋.LSPR生物传感器的制备与测试[D].天津:南开大学,2011.
[4]Wang Zhenxin,Le’vy R,Fernig D G,et al.Kinase-Catalyzed modification of gold nanoparticles:A new approach to colorimetric kinase activity screening[J].Journal of American Chemical So-ciety,2006,128(7):2214-2215.
[5]Nath N,Chilkoti A.A colorimetric gold nanoparticle sensor to interrogate biomolecular interactions in real time on a surface[J].Analytical Chemistry,2002,74(3):504-509.
[6]Frederix F,Friedt J M,Choi K H,et al.Biosensing based on light absorption of nanoscaled gold and silver particles[J].Analytical Chemistry,2003,75(24):6894-6900.
[7]Kreuzer M P,Quidant R,Badenes G,et al.Quantitative detection of doping substances by a localised surface plasmon sensor[J].Biosensors and Bioelectronics,2006(21):1345-1349.
[8]Kreuzer M P,Quidant R,Salvador J P,et al.Colloidal-based localized surface plasmon resonance(LSPR)biosensor for the quantitative determination of stanozolol[J].Analytical and Bioanalytical Chemistry,2008,391(5):1813-1820.
[9]Lee K S,El-Sayed M A.Gold and silver nanoparticles in sensing and imaging:Sensitivity of plasmon pesponse to size, shape, and metal composition[J].Journal of Physical Chemistry B,2006,110(39):19220-19225.
[10] Doremus R H.Optical properties of small silver particles[J].The Journal of Chemical Physics,1965,42(1):414-416.
[11] Mock J J,Smith D R,Schultz S.Local refractive index dependence of plasmon resonance spectra from individual nanoparticle-s[J].Nano Letters,2003,3(4):485-491.

