纳米TiO2光催化降解海产品深加工废水的研究
徐晓,于晓彩,宫喜斌,陈晋芳,金晓杰,吴云英
(大连海洋大学海洋科技与环境学院,辽宁大连116023)
海产品的深加工不仅能解决鲜活海产品的保存、运输和食用时间等问题,而且还能大大增加海产品的经济附加值。随着海产品深加工行业的不断扩大,海产品深加工废水排放量也逐年增加[1]。海产品深加工废水成分复杂,不仅有机物、化学需氧量、氨氮等含量高,而且蛋白质含量也高,从而显著地提高了废水中化学需氧量 (COD)、氨氮(N-N)、悬浮物 (SS)等主要污染物的浓度,增加了废水处理的难度和处理成本[1-2]。目前,海产品加工行业废水一般都是经过简单处理后直接排放大海,这样既污染环境又浪费资源。因此,研究开发新的废水处理技术具有重要意义。废水处理方法一般包括物理法、化学法和生物处理法等,传统的物理法、化学法是将有机污染物从水相转移到其他相,所以存在着二次污染的可能性[3]。
光化学法产生的氧化剂可以将污染物彻底氧化为无机小分子,利用纳米TiO2在紫外光照射下催化降解和处理污染物,在处理多种废水方面都收到了良好效果[4-6]。本研究中,通过试验研究了纳米TiO2的添加量、氨氮初始浓度、COD初始浓度、溶液pH、光照时间对模拟海产品深加工废水中高浓度N-N和COD降解率的影响,并通过正交试验确定纳米TiO2光催化降解海产品深加工废水的优化工艺条件。
1 材料与方法
1.1 材料
主要仪器有光催化反应装置 (自制)、721型紫外可见分光光度计、AL204电子分析天平、Tecnai G2F20场发射透射电子显微镜、D/MAX-2500X射线衍射仪等。
主要试剂有钛酸丁酯、冰乙酸、30%(体积分数)过氧化氢、硫酸铵[(NH4)2SO4]、优级纯邻苯二甲酸氢钾 (HOOCC6H4COOK)、盐酸等。
1.2 方法
1.2.1 光催化剂的制备 采用溶胶-凝胶法 (Sol-Gel)制备复合纳米TiO2。取适量钛酸丁酯,在磁力搅拌器搅拌下缓慢滴加到一定量的无水乙醇溶液中,搅拌1 h后,再滴加一定量的冰醋酸和蒸馏水,持续搅拌2 h后得到淡黄色的半透明TiO2溶胶,自然陈化24 h,在105℃下干燥6 h,研磨成粉末,再在马福炉 (500℃)下锻烧2 h后制得纯TiO2纳米粒子。并对制得的纳米TiO2的晶型、粒径、形貌用X射线衍射和扫描电镜进行分析。
1.2.2 海产品深加工废水的配制 取大连市黑石礁海域附近海水,用抽滤后的海水 (氨氮为0.1102 mg/L,pH为8.03)加入一定量的硫酸铵和邻苯二甲酸氢钾配制海产品深加工废水,试验时根据要求对COD浓度和氨氮浓度进行调整。
1.2.3 光催化降解试验 利用自制光催化反应装置,在烧杯中量取一定浓度的模拟海产品深加工废水,用盐酸或氢氧化钠调节pH值,加入一定量的自制纳米TiO2,用磁力搅拌器搅拌1 h,在40 W紫外灯照射下反应后,将反应溶液稀释一定倍数,在波长640 nm处测定氨氮吸光度,计算氨氮和COD的降解率。
COD含量的测定:采用快速开管法[7],在水样中加入重铬酸钾标准液,并在强酸介质 (硫酸银-硫酸)中以硫酸汞做催化剂,经加热消解后,以试亚铁灵为指示剂,用硫酸亚铁铵标液滴定未被还原的重铬酸钾。CODCr浓度的计算公式为
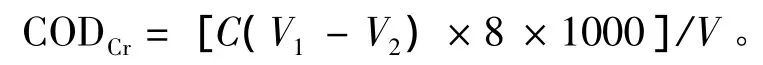
其中:C为硫酸亚铁铵的浓度 (mol/L);V1、V2分别为空白试样和试验水样测定时消耗的硫酸亚铁铵体积 (mL);V为水样的体积 (mL);8为氧的当量 (g/mol)。
氨氮含量的测定:采用靛酚蓝比色法[8],在弱碱性介质中,以亚硝酰铁氰化钠为催化剂,氨氮与苯酚、次氯酸钠依次反应生成靛酚蓝,在640 nm处测定吸光度。根据氨氮浓度 (mg/L)与吸光度的关系做出氨氮的标准工作曲线,标准曲线的线性方程为 y=1.8377x+0.0292,相关系数 R2=0.9992。结果显示,吸光度与氨氮浓度呈现较好的线性关系。应用靛酚蓝比色法,测定目标物质的吸光度,通过标准曲线的线性方程可以得出目标物质剩余氨氮浓度Ci。
根据下式计算:
氨氮(或COD)的降解率=(C0-Ci)/C0×100%,其中,C0为氨氮 (或COD)初始浓度 (mg/L),Ci为剩余氨氮 (或COD)浓度 (mg/L)。
2 结果与讨论
2.1 纳米TiO2光催化剂的表征
2.1.1 X射线衍射分析(XRD) 决定纳米材料物理化学性质的一个关键因素就是晶体尺寸,它直接影响材料的性能。使用XRD分析方法能够很方便地确定所制备的光催化剂的物相组成和晶体尺寸。本试验中,自制纳米TiO2的XRD测试结果如图1所示。当2θ为25.28°时,有明显的峰值,而当2θ为 37.3°、48.05°、53.89°、62.69°时,峰值有明显的下降趋势。将XRD图谱与标准JCPDS卡(JCPDS21-1272)对照,可以看出,此样品为锐钛矿型TiO2。采用半高宽化法,由Scherrer公式[9]计算样品晶粒的平均尺寸为33.2 nm。
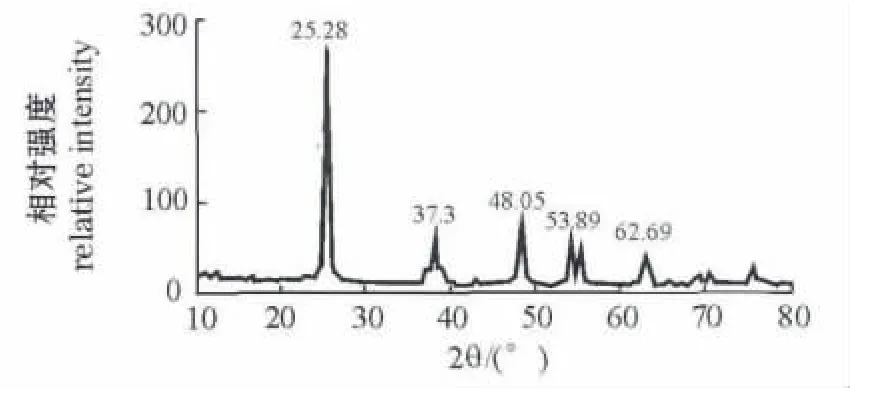
图1 纳米TiO2光催化剂的XRD图Fig.1 XRD pattern of nano-TiO2photocatalyst
2.1.2 透射电镜分析 (TEM) 自制纳米TiO2的透射电镜分析结果 (图2)表明,TiO2粒子是由小尺寸的粒子凝聚形成大尺寸粒子,粒子大小不均、形状不规则,呈多边形,TiO2粒径与由Scherrer公式计算所得的粒径一致,为30~50 nm。
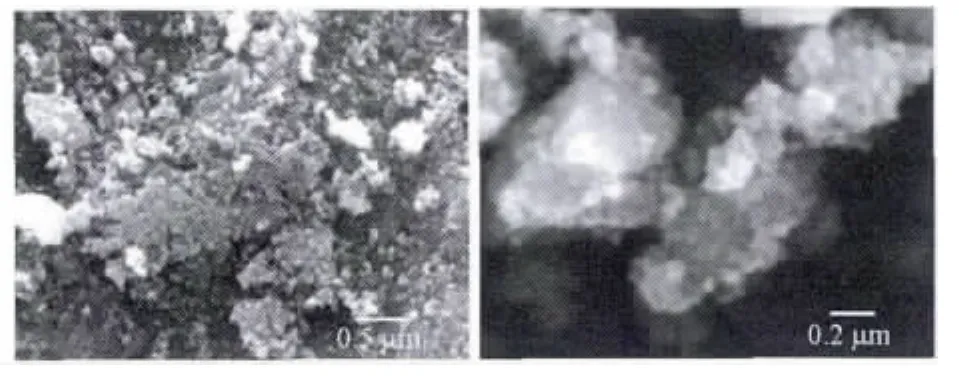
图2 纳米TiO2光催化剂的SEM图Fig.2 SEM image of nano-TiO2photocatalyst
2.2 不同因素对催化降解废水的影响
2.2.1 纳米TiO2的用量 取40 mL COD浓度为1500 mg/L、5 mL氨氮浓度为1000 mg/L的模拟海产品深加工废水,分别置于6个100 mL的烧杯中,用海水定容到50 mL,此时氨氮初始浓度为100 mg/L,COD初始浓度为1200 mg/L,调节各烧杯废水的 pH为 7.0时,分别加入 0、0.3、0.6、0.9、1.2、1.5 g/L TiO2,搅拌1 h,紫外光照射2 h后,测定吸光度,计算氨氮和COD的降解率。从表1可见,随着TiO2用量的增加,氨氮和COD降解率呈上升趋势,但当TiO2用量超过1.2 g/L时,降解率出现下降。分析原因可能是,当溶液中TiO2浓度较低时,随着 TiO2浓度的逐渐增加,TiO2参与光解反应的颗粒数增加,降解率也增加,但当TiO2浓度达到一定量时,由于溶液中TiO2对光的散射增强,光降解率反而会下降。因此,本试验条件下,确定最佳TiO2用量为1.2 g/L。
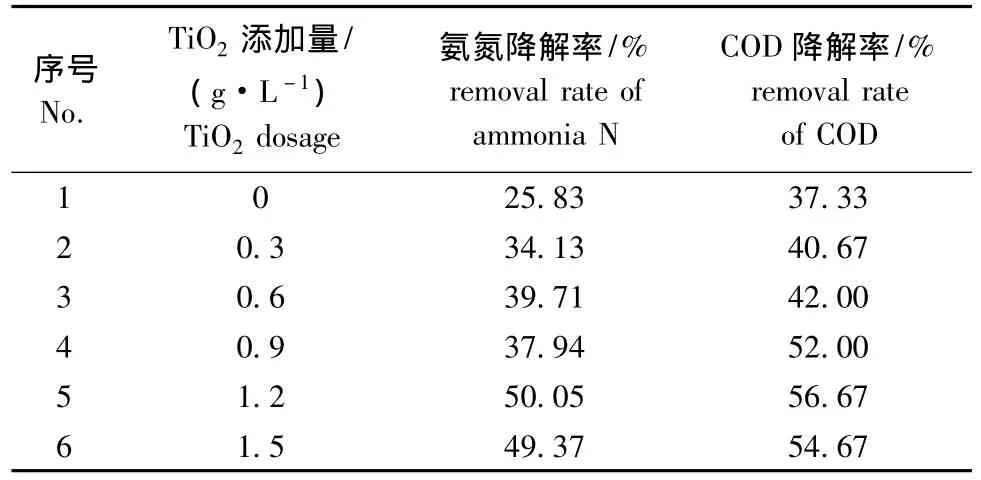
表1 二氧化钛添加量对光催化性能的影响Tab.1 Effects of amount of nano-TiO2on the properties of the photocatalytic oxidation
2.2.2 溶液的pH 取40 mL COD浓度为1500 mg/L、5 mL氨氮浓度为1000 mg/L的模拟海产品深加工废水,分别置于6个100 mL的烧杯中,用海水定容到50 mL,此时氨氮初始浓度为100 mg/L,COD初始浓度为1200 mg/L,TiO2催化剂用量为1.2 g/L,调节各烧杯废水的pH分别为5、6、7、8、9、10时,搅拌1 h,紫外光照射2 h后,测定吸光度,计算氨氮和COD降解率。从表2可见,溶液初始pH对氨氮和COD的降解率有较大影响,当pH为6~8,氨氮和COD的降解率均较高,当pH为7时,二者的降解率均较高。分析原因可能是,当pH较低时,催化剂和含氨氮、COD的废水均带正电,pH值会影响催化剂的表面特性而不利于氨氮和COD吸附到催化剂表面进行催化反应;相反,当pH较高时,TiO2表面带负电荷,同时也不利于废水中氨氮和COD进行催化降解反应。因此,本试验条件下,确定最佳pH为7。
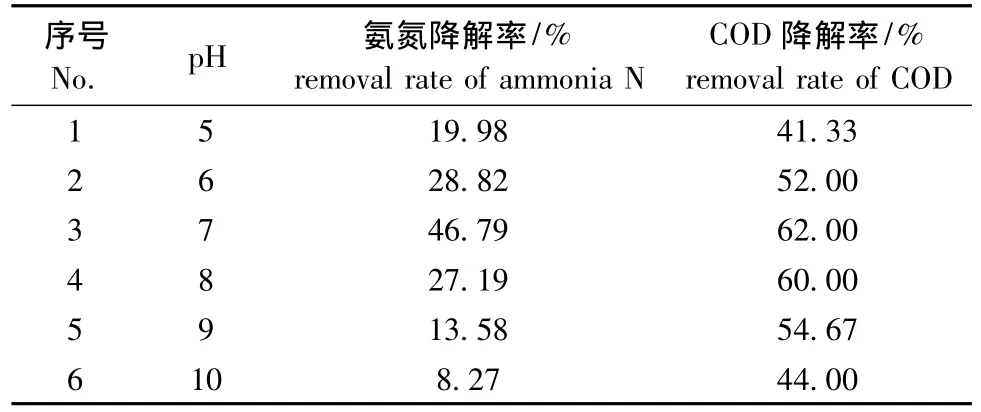
表2 溶液pH对光催化性能的影响Tab.2 Effects of pH on the properties of the photocatalytic oxidation
2.2.3 氨氮初始浓度 取40 mL COD浓度为1500 mg/L的模拟海产品深加工废水,分别置于6个100 mL的烧杯中,分别加入2.5、4.0、5.5、7.0、8.5、10.0 mL氨氮浓度为1000 mg/L的模拟海产品深加工废水,用海水定容到50 mL,此时氨氮初始浓度分别 为 50、80、110、140、170、200 mg/L,COD初始浓度均为1200 mg/L,TiO2催化剂用量为1.2 g/L,调节废水pH为7.0时,搅拌1 h,光照射2 h后,测定吸光度,计算氨氮和COD的降解率。从表3可见,随着氨氮初始浓度的增加,氨氮的去除率呈直线下降,而COD的降解率则无明显变化规律。分析原因可能是,随着氨氮初始浓度的提高,吸附的氨氮和COD分子数会随之增加,从而减少了产生羟基自由基的活性位,说明光催化氧化更适合于氨氮浓度较低的废水。因此,本试验条件下,确定最佳氨氮初始浓度80 mg/L。
2.2.4 COD初始浓度 取5 mL氨氮浓度为1000 mg/L的海产品深加工废水,分别置于6个100 mL的烧杯中,分别加入 2.5、5.0、7.5、10.0、12.5、15.0 mL COD浓度为6000 mg/L的模拟海产品深加工废水,用海水定容到50 mL,此时COD初始浓度分别为 300、600、900、1200、1500、1800 mg/L,氨氮初始浓度为100 mg/L,TiO2催化剂用量均为1.2 g/L,调节各烧杯废水pH为7.0时,搅拌1 h,紫外光照射2 h后,测定吸光度,计算氨氮和COD的降解率。从表4可见,随着COD初始浓度的增加,氨氮的降解率先下降后升高然后再下降,而COD的降解率在开始时去除率很高,之后逐渐下降并趋于稳定。分析原因可能也是,随着COD初始浓度的提高,吸附的氨氮和COD分子数会随之增加,从而使自由基的活性位减少,同时这也说明光催化氧化不适合用在COD浓度较高的废水处理中。因此,本试验条件下,确定最佳COD初始浓度为300 mg/L。
2.2.5 光照时间 取40 mL COD浓度为1500 mg/L、5 mL氨氮浓度为1000 mg/L的海产品深加工废水,分别置于6个100 mL的烧杯中,用海水定容到50 mL,此时各烧杯中氨氮初始浓度均为100 mg/L,COD初始浓度为1200 mg/L,TiO2催化剂用量为1.2 g/L,调节各烧杯废水pH为7.0时,搅拌1 h,分别用紫外光照射1、2、3、4、5、6 h后,测定吸光度,计算氨氮和COD的降解率。从表5可见,随着光照时间的延长,氨氮和COD的降解率变化明显,在光照1 h时降解率均很低,2~3 h时氨氮和COD降解率呈上升趋势,4 h时COD降解率达到峰值,4 h以上时氨氮和COD降解率逐渐降低。因此,本试验条件下,确定最佳光照时间为2~3 h。
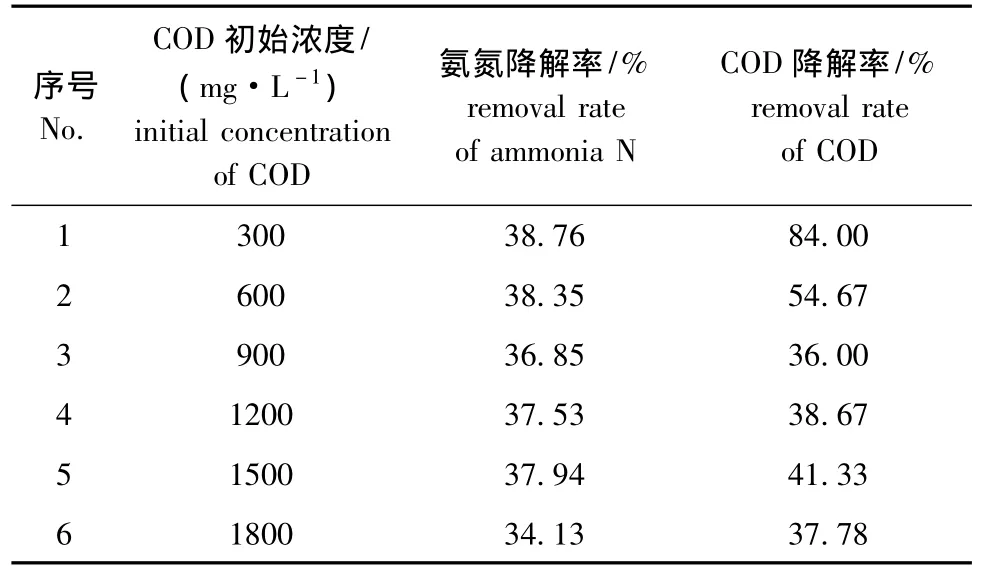
表4 COD初始浓度对光催化性能的影响Tab.4 Effects of the initial concentration of COD in seawater on the properties of the photocatalytic oxidation
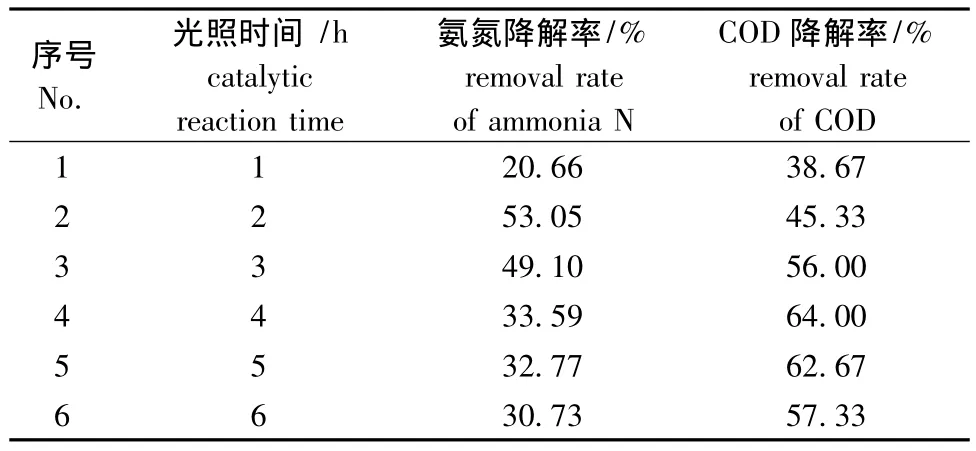
表5 光照时间对光催化性能的影响Tab.5 Effects of the illumination time on the properties of the photocatalytic oxidation
2.3 正交试验优化光催化降解条件
为了确定纳米TiO2光催化剂对海产品深加工废水中氨氮和COD的优化光催化反应条件,从而考察影响光催化反应各因素的交互影响,选择光催化剂用量、溶液pH、氨氮初始浓度、COD初始浓度、光照时间5个因素,选用L16(54)正交试验表,通过正交试验确定TiO2光催化剂催化氧化的最佳反应条件。正交试验设计与试验结果见表6。
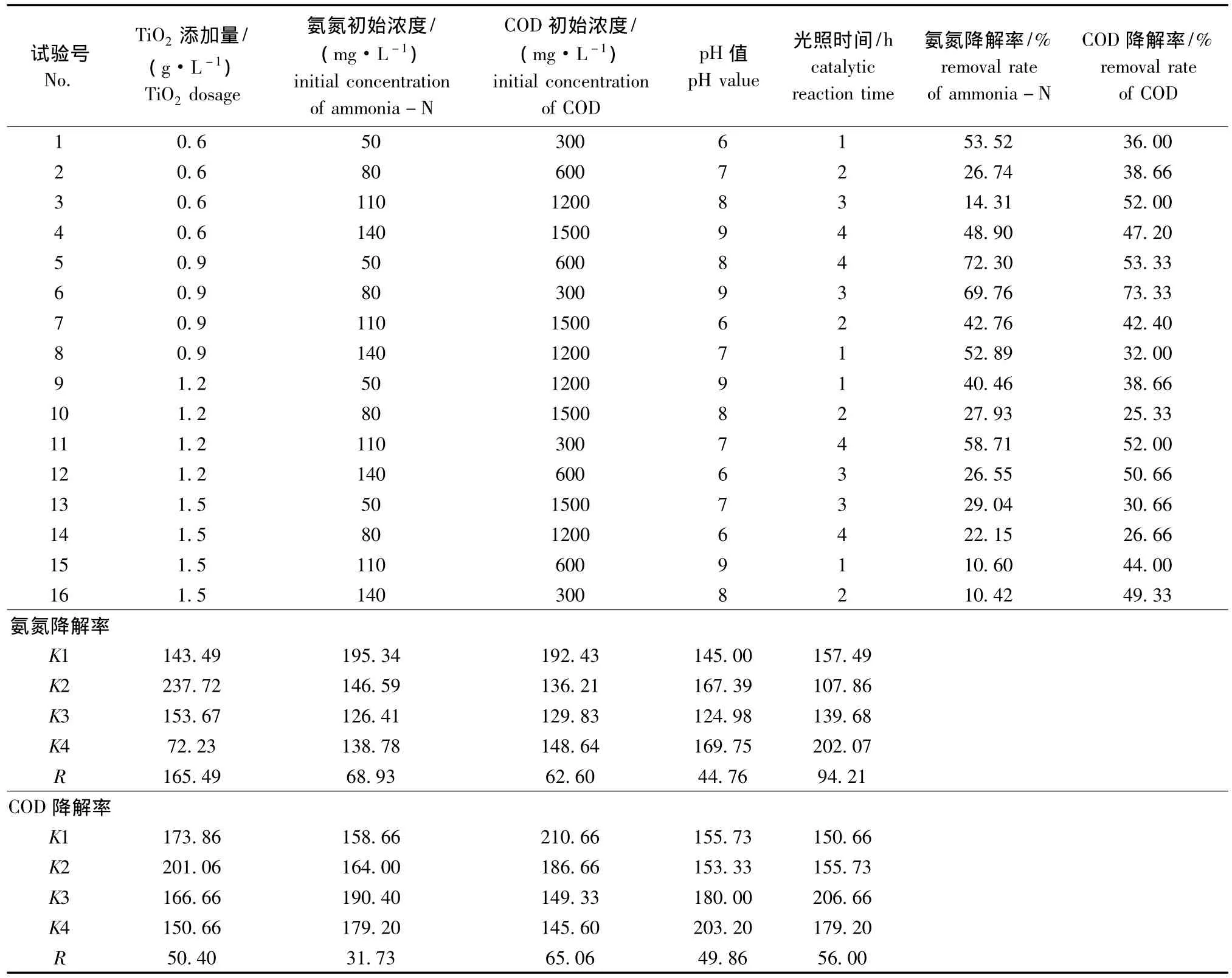
表6 光催化降解废水的正交试验设计方案及试验结果Tab.6 The design and results of the orthogonal test for photocatalytic of degradation the effluents
从极差分析结果得出:影响纳米TiO2光催化降解海产品深加工废水中氨氮效率的影响因素依次为催化剂添加量>光照时间>氨氮初始浓度 >COD初始浓度>pH值;影响纳米TiO2光催化降解海产品深加工废水中COD降解效率的影响因素依次为COD初始浓度>光照时间>催化剂添加量 >pH值>氨氮初始浓度。最优试验组合为6号组,即TiO2添加量为0.9 g/L,溶液pH为9,氨氮初始浓度为80 mg/L,COD浓度初始为300 mg/L,光催化时间为3 h,在此优化工艺条件下,氨氮和COD的降解率均比较高,分别为69.76%、73.33%。
[1]陈娇桂,林妃妃.东兴市海产品深加工行业废水处理工艺及实例探讨[J].大众科技,2011,141(5):82-83.
[2]崔力拓,李志伟,胡克寒.河北省海水养殖区水质的时空变化特征[J].大连海洋大学学报,2012,27(2):182-185.
[3]Bessa E,Santanna G L,Dezotti M.Photo-catalytic/H2O2treatment of oil field produced waters[J].Appl Catal B,2001,29(2):125-134.
[4]Qamar M,Saquib M,Muneer M.Photocatalytic degradation of two selected dye derivatives,chromotrope 2B and amido black IOB,in aqueous suspensions of titanium dioxide[J].Dyes Pigments,2005,65(1):1-9.
[5]Shankar M V,Cheralantha K K,Arabindoo B,et al.Enhanced photocatalytic activity for the destruction of mono-crotophos pesticide by TiO2/Hβ[J].J Mol Catal A,2004,223(1/2):195-200.
[6]李桂英,安太成,陈嘉鑫,等.光电催化氧化处理高含氯采油废水的研究[J].环境科学研究,2006,19(1):30-34.
[7]姚淑华,石中亮,宋守志,等.用开管法快速测定废水的COD[J].化工环保,2004,24(2):138-140.
[8]蒋岳文.靛酚蓝分光光度法测定海水中的氨氮[J].海洋环境科学,1990,9(1):75-80.
[9]唐玉朝,黄显怀,俞汉清,等.N掺杂TiO2光催化剂的制备及其可见光活性研究[J].无机化学学报,2005,21(11):1747-1751.

