TiO2纳米颗粒对金鱼乳酸脱氢酶表达的影响
戈洋,汪静,曲冰,潘超,古菲菲,邹颖慧
(大连海洋大学理学院,辽宁大连116023)
纳米颗粒因其具有小尺寸效应、表面效应、量子尺寸和宏观量子隧道效应的物理化学特性而被广泛应用于工业生产中,它在给人类带来便利的同时也会对生物体构成威胁。暴露于空气中的纳米颗粒对哺乳动物生物效应的相关报道屡见不鲜[1-6]。对细菌的相关研究发现,ZnO、TiO2、Fe3O4和SiO2等纳米颗粒会破坏大肠杆菌细胞膜的通透性,且粒径越小毒性越强[7]。纳米颗粒在应用过程中也会进入水体,刘娅琛等[8]研究发现,SiO2纳米颗粒能够降低小球藻的生物量和蛋白含量;董霞[9]研究发现,经TiO2处理后的斑马鱼出现侧游、体质量减轻、比干重增加、鳃组织坏死或脱落等现象。但有关纳米颗粒对金鱼生物效应的研究目前尚未见报道。同工酶是基因表达的产物,不同的同工酶与基因的关系不同[10]。生物在进化过程中为适应环境的变化产生了与代谢活动相统一的同工酶。乳酸脱氢酶 (LDH)广泛存在于生物体的各器官组织中,是生物体代谢过程中不可或缺的一种酶。本研究中,采用聚丙烯酰胺凝胶电泳方法,分析不同浓度的纳米颗粒对金鱼LDH表达的影响,旨在为纳米颗粒的安全使用提供参考依据。
1 材料与方法
1.1 材料
试验用金鱼Carassius auratus体长为 (8.0±0.2)cm,购自大连市香炉礁花鸟鱼虫市场。TiO2纳米颗粒 (P25)购自德国奥德赛公司。
1.2 方法
1.2.1 试验分组及TiO2处理 将试验鱼分为6组,每组5尾鱼,分别用浓度为0(对照)、30、60、90、120、150 mg/L的TiO2溶液进行24 h处理。
1.2.2 样品的制备 低温条件下对金鱼进行解剖,提取鰓、心、肝胰脏、肾和脑组织,用体积分数为0.9%的预冷生理盐水清洗各组织血污,加入pH为7.0的磷酸盐缓冲液,所加缓冲液的体积与金鱼组织质量之比为3∶1(mL∶g),在4℃下以10 000 r/min离心30 min,取上清液,与体积分数为75%的甘油等体积混合后,置于冰箱 (-20℃)中保存备用。
1.2.3 电泳 采用非变性聚丙烯酰胺凝胶电泳法,分离胶浓度为7%,浓缩胶浓度为5%,电极缓冲液为pH 8.8的Tris-Gly缓冲液。用DYY-6C型稳压稳流电泳仪进行电泳。用10 μL的微量进样器进行上样,每孔加入10 μL样品,再加入适量的溴酚蓝指示剂,连接电泳槽 (DYCZ-24D型垂直板电泳槽)的正负极,将电泳槽移至4℃的冰箱内进行电泳,电泳时间约为5 h。
1.2.4 染色及酶谱处理 电泳结束后,将凝胶置于LDH染色液中避光染色30 min后,用体积分数为7%的醋酸进行固定脱色。用数码照相机拍照后使用Imagej软件进行灰度分析。
2 结果与分析
2.1 TiO2对金鱼各组织LDH同工酶谱的影响
从图1可见:经TiO2纳米颗粒处理后,金鱼鳃组织的酶带发生了明显变化,各浓度组鳃组织中LDH3缺失;对照组心脏组织中表达出4条酶带,而各浓度组心脏中均缺失LDH4和LDH5;对照组肝胰脏中表达出5条酶带,30、60、90、150 mg/L浓度组肝胰脏中LDH1、LDH3、LDH4和LDH5均消失,120 mg/L浓度组肝胰脏中LDH3和LDH5有表达且还表达出LDH6酶带;对照组肾组织中表达出3条酶带,而各浓度组缺失LDH3;对照组脑组织中表达出5条酶带,而各浓度组缺失LDH4和LDH5。肝胰脏中LDH3和LDH5在低浓度组不表达,在120 mg/L浓度组中又出现,说明低浓度TiO2纳米颗粒破坏了组织液中酶分子的构象,当浓度继续升高,TiO2纳米颗粒破坏细胞膜的通透性,使细胞中的LDH渗透到组织液中继而表达出酶活性。研究表明,经TiO2纳米颗粒处理后金鱼各组织的LDH酶带数减少。
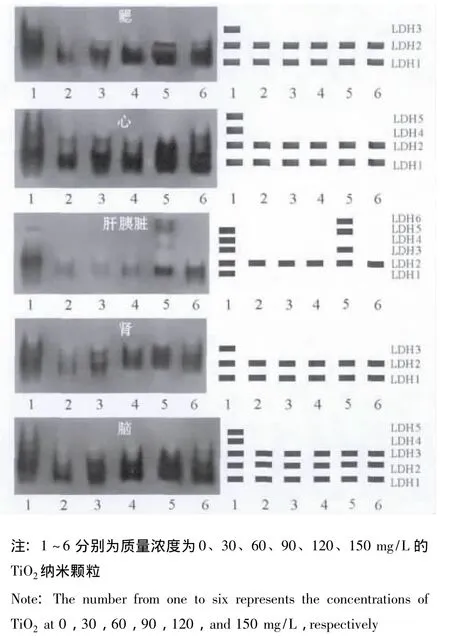
图1 TiO2纳米颗粒对金鱼各组织LDH同工酶谱的影响Fig.1 The effects of TiO2nanoparticles on LDH isozyme zymogram in different tissues
2.2 TiO2对金鱼各组织LDH同工酶活性的影响
经不同浓度的TiO2纳米颗粒处理后,金鱼鳃、心、肝胰脏、肾、脑组织中LDH同工酶的活性如表1所示。金鱼鳃组织中,LDH1和LDH2活性随TiO2浓度的升高而增强,TiO2浓度为120 mg/L时活性最强,超过120 mg/L时酶活性又呈下降趋势,即低浓度诱导表达,高浓度抑制表达;LDH3在对照组中活性较低,在各浓度组中均不表达,说明LDH有一定的环境耐受范围,为适应环境变化,LDH1和LDH2在环境胁迫下表现出应激性,当环境条件超过耐受范围的阈值时,酶活性开始下降。LDH3的耐受范围较LDH1、LDH2窄,低浓度的TiO2纳米颗粒就可使其活性完全消失,说明LDH3对环境因子较敏感。本试验中发现,金鱼暴露于经TiO2处理的曝气水中时,鳃盖扇动频率增加,对照组的鳃组织呈鲜红色,30、60 mg/L浓度组的鳃组织颜色无明显变化,但随着TiO2浓度的升高 (如90、120 mg/L),金鱼鳃组织颜色逐渐加深,呈深红色,各浓度组鳃组织中均能看到聚集的白色TiO2颗粒。当TiO2浓度升高到150 mg/L时,鳃组织颜色趋于发白。
金鱼心脏组织中,LDH1呈现低浓度诱导表达,高浓度抑制表达;而LDH2则呈现低浓度抑制表达,高浓度诱导表达;LDH4和LDH5在对照组中活性较LDH1和LDH2弱,在各浓度组中酶活性完全消失。LDH5只在对照组中出现且表达活性弱,这与心脏属于好氧器官,催化乳酸转化为丙酮酸以产生大量的ATP来维持心脏的收缩功能有关。
金鱼肝胰脏组织中,LDH1在各浓度组中活性完全消失;LDH2的活性随TiO2浓度的升高而增强;LDH3和LDH5表现为低浓度抑制表达,高浓度诱导表达;LDH4在各浓度组中活性均消失;LDH6在对照组和低浓度组中均不表达,而在TiO2浓度为120 mg/L时出现了迁移率较低的LDH6酶带,可能是外界环境的变化开启了C基因的表达,这是生物受环境胁迫时基因选择性表达的结果。
金鱼肾组织中,LDH1和LDH2在对照组中活性较强,在30、60、90 mg/L浓度组中活性稳定,当TiO2浓度升高至120 mg/L时酶活性明显升高,到150 mg/L时活性略有下降,这与肾脏是排泄器官有关;LDH3在对照组中活性低,但在各浓度组中活性完全消失,说明LDH3对环境因子较敏感。
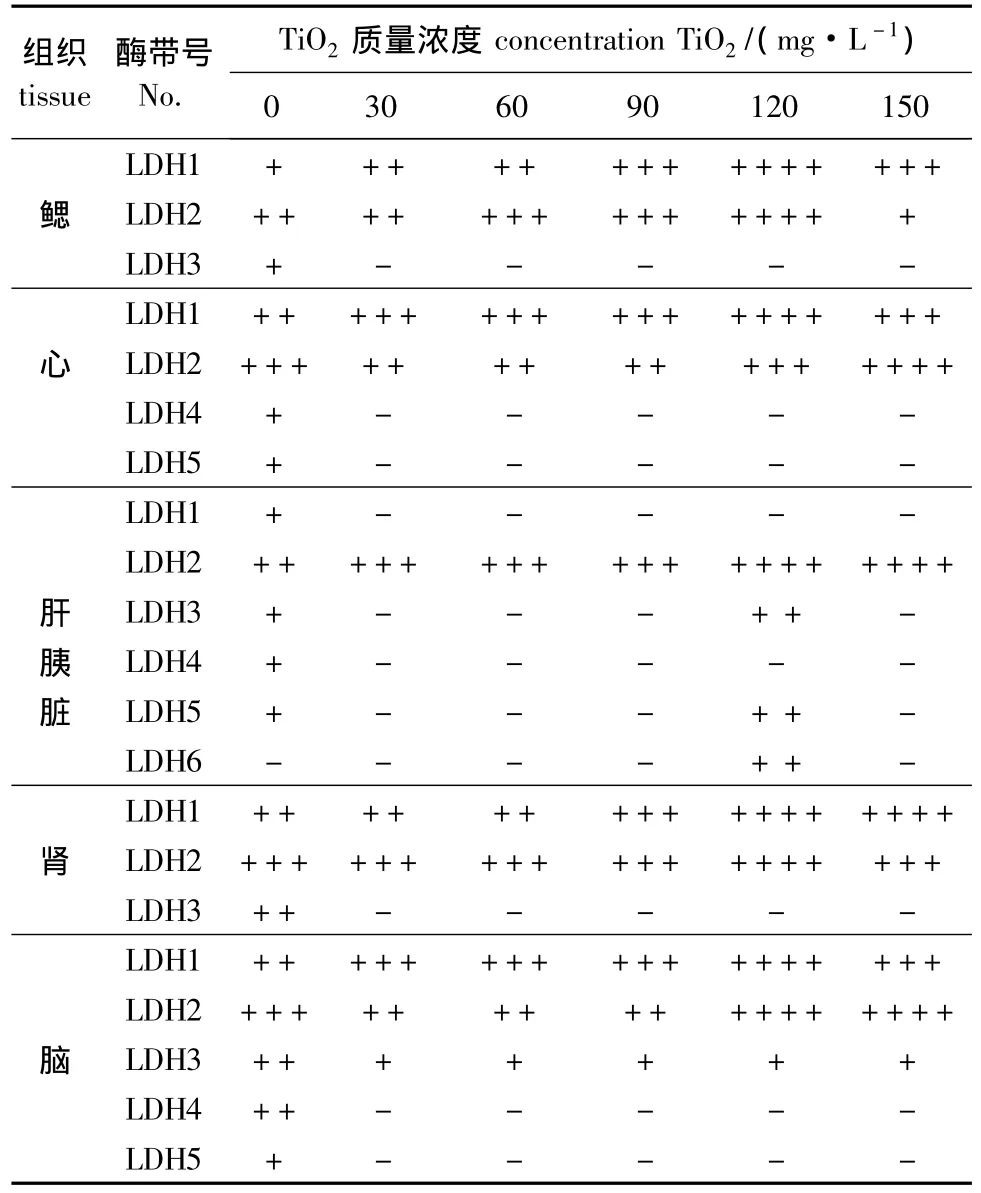
表1 TiO2纳米颗粒对金鱼各组织LDH同工酶表达活性的影响Tab.1 The effects of TiO2nanoparticle on expression of LDH isozymes in different tissues in goldfish
金鱼脑组织中,LDH1活性随TiO2浓度的升高先增强后减弱;LDH2活性随TiO2浓度的升高先减弱后增强;LDH3活性在各浓度组略有降低;LDH4和LDH5在对照组中活性较弱,各浓度组中活性均消失。
综上所述,TiO2纳米颗粒对金鱼组织LDH有毒性作用,一方面纳米颗粒会使LDH酶带数减少,另一方面纳米颗粒会进入细胞使细胞膜的通透性改变从而影响细胞中LDH的活性,同时在肝胰脏中为协调环境的变化出现C基因的选择性表达。
[1]石碧华.不同尺寸二氧化硅纳米颗粒体内生物效应研究[D].长沙:湖南大学,2009.
[2]Rahman Q,Lohani M,Dopp E,et al.Evidence that ultrafine titanium doxide induces micronuclei and apoptosis in Syrian hamster embryo fibroblasts[J].Environ Health Perspect,2002,110:797-800.
[3]Zhou Y M,Zhong C Y,Kennedy I M,et al.Pulmonary responses of acute exposure to ultrafine iron particles in healthy adult rats[J].Environ Toxicol,2003,18(4):227-235.
[4]杨辉.典型纳米材料胚胎毒性及其氧化应激机制的初步研究[D].北京:中国人民解放军军事医学科学院,2008.
[5]Lee Y S,Kim D W,Lee Y H,et al.Silver nanoparticles induce apoptosis and G2/M arrest via PKCζ-dependent signaling in A549 lung cells[J].Arch Toxicol,2011,85:1529-1540.
[6]王冕,何晓晓,石碧华,等.不同尺寸二氧化硅纳米颗粒体内分布与代谢研究[J].科学通报,2013,58(7):568-574.
[7]覃春丽.纳米材料对细菌的生物效应研究[D].天津:天津理工大学,2012.
[8]刘娅琛,汪静,曲冰,等.SiO2纳米颗粒对小球藻生长活性的影响[J].海洋环境科学,2011,30(5):646-648,652.
[9]董霞.纳米二氧化钛的体内生物毒理效应研究[D].杭州:浙江工业大学,2009.
[10]张娟,王红叶,蔡焰值,等.中华倒刺鲃同工酶组织特异性研究[J].湖北农业科学,2011,50(24):5206-5210.

