弥散加权成像对宫颈癌淋巴结转移的诊断价值
张 洁,任 翠,薛华丹,周海龙,孙照勇,金征宇
中国医学科学院 北京协和医学院 北京协和医院放射科,北京 100730
·论 著·
弥散加权成像对宫颈癌淋巴结转移的诊断价值
张 洁,任 翠,薛华丹,周海龙,孙照勇,金征宇
中国医学科学院 北京协和医学院 北京协和医院放射科,北京 100730
目的探讨弥散加权成像 (DWI)对宫颈癌转移及非转移淋巴结的诊断价值。方法回顾性收集经手术病理证实的行淋巴结清扫的宫颈癌患者65例,所有患者均在术前行盆腔常规MRI及DWI检查。手术共切除淋巴结1590枚,将短径≥5 mm的392枚淋巴结纳入本研究。测量淋巴结的长径 (L)、短径 (S)及表观弥散系数ADCmin、ADCmean和原发癌灶的ADCmin、ADCmean,计算淋巴结的S/L、rADCmin、rADCmean,比较转移及非转移淋巴结的形态学指标及ADC值差异。结果转移淋巴结的L、S、S/L均显著大于非转移淋巴结 (P均<0.0001),转移淋巴结的ADCmin、ADCmean、rADCmin、rADCmean均显著小于非转移淋巴结 (P均<0.0001);ADCmin鉴别转移及非转移淋巴结的Az(0.956)最大,高于其他ADC值及形态学指标;以ADCmin=759.0×10-6mm2/s作为鉴别淋巴结转移的阈值,敏感性和特异性分别为95.2%和92.1%。结论DWI尤其ADCmin有助于鉴别宫颈癌转移及非转移淋巴结。
宫颈癌;淋巴结转移;弥散加权成像
Acta Acad Med Sin,2014,36(1):73-78
宫颈癌是最常见的妇科恶性肿瘤,淋巴结转移严重影响患者预后。对于发生淋巴结转移的患者,术后辅助放化疗可以改善患者的生存率。但另一方面术后放化疗存在严重的并发症,极大影响了患者生活质量。因此,术前准确判断是否存在淋巴结转移很有必要。
磁共振成像 (magnetic resonance imaging,MRI)具有较高的软组织分辨率,可以多方位成像,有助于淋巴结的检出,常规MRI诊断淋巴结转移的形态学指标包括短径 (S) >10 mm,S/长径 (L) >0.8等[1]。以往研究显示,常规MRI诊断淋巴结转移的敏感性差异较大,为24% ~73%不等[2-5]。
弥散加权成像 (diffusion weighted imaging,DWI)可以量化水分子弥散受限的程度,对转移及非转移的淋巴结均可以很好的显示。研究表明,宫颈癌转移淋巴结的表观弥散系数 (apparent diffusion coefficent,ADC)值显著低于非转移淋巴结,ADC值判断淋巴结转移的敏感性和准确性均高于常规MRI。Klerkx等[6]对68例早期宫颈癌患者的研究发现,常规MRI淋巴结S判断转移及非转移淋巴结的曲线下面积 (area under curve,AUC) 最大 (AUC=0.81,95%CI:0.70 ~0.91),DWI及ADC值较常规MRI并不能提高诊断淋巴结转移的准确率。本研究评估了DWI及常规MRI诊断盆腔淋巴结转移的能力,探讨了诊断淋巴结转移的最佳指标。
资料和方法
资料来源2008年5月至2013年5月在北京协和医院手术治疗经病理证实的ⅠB~ⅡA期宫颈癌患者65例,平均年龄 (45.6±6.5) 岁 (35~73岁)。入选标准:(1)原发性宫颈癌;(2)不合并其他恶性肿瘤; (3)MRI检查后及术前未经任何抗肿瘤治疗;(4)均在术前20 d内行MRI常规加DWI检查。
MRI检查方法采用GE Signa EXCITE Twin Speed HD 1.5磁共振扫描仪,8通道体部相控线圈。盆腔MR扫描序列包括:横轴位自旋回波T1加权像,重复时间400~600ms,回波时间10~20ms;横轴位、冠状位、矢状位快速自旋回波T2加权像,重复时间2500~4000ms,回波时间60~100ms,视野30 cm×30 cm,矩阵256×256,激发次数2,层厚4 mm,间隔1 mm。横轴位DWI,重复时间4500ms,回波时间62.4ms,反转时间160ms,激发次数4,矩阵128×128,视野38 cm×38 cm,层厚4 mm,间隔1 mm,扩散系数b=0,800 s/mm2。
图像分析及标准由分别拥有3年和5年工作经验的2名放射科医师在不知道手术病理结果的前提下,共同分析所有患者的MRI图像。将轴位T2WI图像上所有S≥5 mm的淋巴结纳入本研究,由2名医师共同测量淋巴结的形态学指标及ADC值。在轴位T2WI上测量淋巴结的S、L并计算S/L;参照同层面横轴位T2WI,按照解剖部位将盆腔淋巴结划分为6组:左、右髂总组,左、右髂外组,左、右髂内及闭孔组淋巴结 (髂内和闭孔解剖部位相近,因此合并为1组)。病理结果中,若某个分组内无淋巴结转移,则该组内MRI轴位图像上所有S≥5 mm的淋巴结均视为非转移淋巴结;若某个分组内1个或1个以上淋巴结转移,则该组内MRI轴位图像上S最大或较大的淋巴结视为转移淋巴结,该分组内其他S≥5 mm的淋巴结均被剔除。
ADC值测量采用 AW4.2工作站Functool软件重建出ADC图,参照同层面横轴位T2WI,在ADC图上沿宫颈癌病灶最大层面边缘手动绘制感兴趣区 (region of interest,ROI),同时避免病灶内的囊变、出血及坏死区,记录肿瘤的平均及最小ADC值 (ADCmean、ADCmin)。在淋巴结内绘制类圆形ROI,同时避开淋巴结边缘,测量ADCmean时,应尽可能覆盖整个淋巴结区域,测量3次后求平均值;测量ADCmin时,尽量将ROI放于ADC伪彩图的最蓝色区域内,ROC约15 mm2,测量3次后求平均值。计算淋巴结与原发肿瘤的相对ADC值 (rADCmin、rADCmean)。
统计学处理采用SPSS 18.0统计软件,比较转移及非转移淋巴结各形态学指标及ADC值,若数据满足正态分布,采用两独立样本t检验;若不满足,则采用Wilcoxon秩和检验。不同指标间ROC比较采用MedCalc11.4软件。通过ROC曲线分析得出各形态学指标及ADC值的最佳阈值,并计算判断淋巴结转移的敏感性及特异性。
结 果
病理结果及MRI结果65例患者中,21例存在淋巴结转移,其中,鳞癌19例,腺癌2例。手术共切除1590枚淋巴结,其中,转移淋巴结共35组63枚,非转移淋巴结共355组1527枚。T2WI上共检出S≥5 mm的盆腔淋巴结392枚,其中,转移淋巴结63枚(图1),非转移淋巴结329枚。

图1 宫颈鳞癌左髂外组淋巴结转移 (箭头)Fig 1 Left external iliac lymph node metastasis in cervical squamous cell carcinoma(arrow)
转移及非转移淋巴结的形态学指标及ADC值比较淋巴结形态学指标及各种ADC值均服从正态分布,转移淋巴结的L、S及S/L均明显大于非转移淋巴结 (P均<0.0001)(表1);转移淋巴结的ADCmin、ADCmean、rADCmin、rADCmean均明显小于非转移淋巴结(P 均 <0.0001)(表2)。
淋巴结的形态学指标及ADC值的ROC曲线分析不同观察指标诊断宫颈癌淋巴结转移的ROC曲线下面积Az、最佳阈值、特异度及敏感度见图2、3和表3。在形态学参数中,淋巴结S判断淋巴结转移的Az最大,明显高于 L(Z=1.966,P=0.049) 及 S/L(Z=2.191,P=0.028);L与 S/L间差异无统计学意义 (Z=0.240,P=0.811)。在所测得的 ADC值参数中,ADCmin判断淋巴结转移的Az最大,但各种ADC值Az两两比较差异均无统计学意义 (ADCmin比ADCmean,Z=0.618,P=0.537;ADCmin比 rADCmean,Z=0.949, P=0.343;ADCmin比 rADCmin, Z=0.720,P=0.472;ADCmean比 rADCmean,Z=0.144,P=0.886;ADCmean比 rADCmin, Z=0.023,P=0.981;rADCmean比 rADCmin,Z=0.233,P=0.816)。所有ADC值的 Az均明显大于 L、S、S/L(P均 <0.05)(表 4)。
表1 宫颈癌转移与非转移淋巴结形态学特征比较 (±s,mm)Table 1 Comparison of morphologic indexes between metastatic and non-metastatic lymph nodes(±s,mm)

表1 宫颈癌转移与非转移淋巴结形态学特征比较 (±s,mm)Table 1 Comparison of morphologic indexes between metastatic and non-metastatic lymph nodes(±s,mm)
L:长径;S:短径L:long-axis diameter;S:short-axis diameter
Group L S S/L转移淋巴结Metastatic group(n=63)分组10.810 ±0.469 8.608 ±0.869 0.783 ±0.035非转移淋巴结 Non-metastatic group(n=329) 10.390 ±0.297 7.541 ±0.447 0.749 ±0.031 t<0.0001 <0.0001 <0.0001-9.226 -14.457 -7.848 P
表2 宫颈癌转移及非转移淋巴结ADC值比较 (±s, ×10-6mm2/s)Table 2 Comparison of ADC values between metastatic and non-metastatic lymph nodes(±s, ×10-6mm2/s)
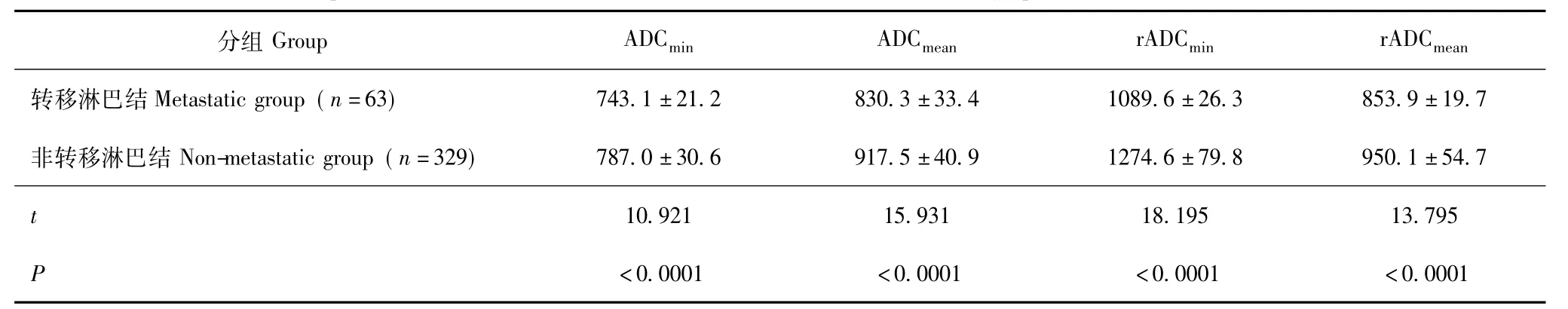
表2 宫颈癌转移及非转移淋巴结ADC值比较 (±s, ×10-6mm2/s)Table 2 Comparison of ADC values between metastatic and non-metastatic lymph nodes(±s, ×10-6mm2/s)
ADC:表观弥散系数;ADCmin:最小表观弥散系数;ADCmean:平均表观弥散系数;rADCmin:相对最小表观弥散系数;rADCmean:相对平均表观弥散系数ADC:apparent diffusion coefficent;ADCmin:minimum ADC;ADCmean:mean ADC;rADCmin:relative minimum ADC;rADCmean:relative mean ADC
分组Group ADCmin ADCmean rADCmin rADCmean转移淋巴结 Metastatic group(n=63) 743.1 ±21.2 830.3 ±33.4 1089.6 ±26.3 853.9 ±19.7非转移淋巴结 Non-metastatic group(n=329) 787.0 ±30.6 917.5 ±40.9 1274.6 ±79.8 950.1 ±54.7 t<0.0001 <0.0001 <0.0001 <0.0001 10.921 15.931 18.195 13.795 P

图2 形态学指标鉴别宫颈癌转移与非转移淋巴结的ROC曲线Fig 2 ROC curves of morphologic index in identifying lymph node metastasisis

图3 ADC值鉴别宫颈癌转移与非转移淋巴结的ROC曲线Fig 3 ROC curves of ADC value in identifying lymph node metastasisis
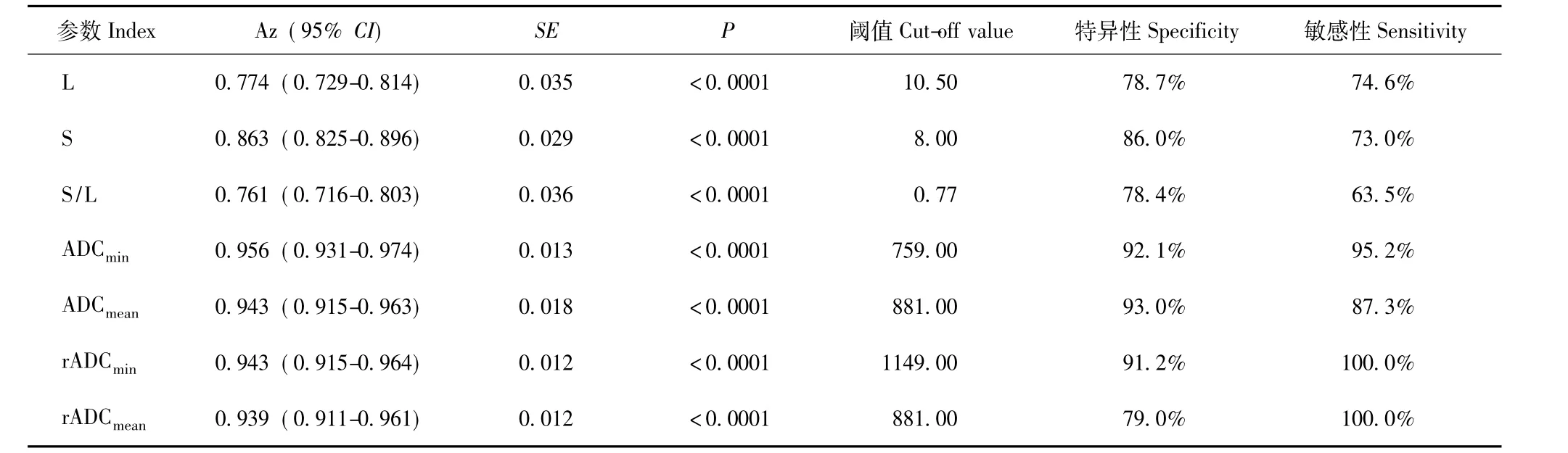
表3 形态学参数及ADC值鉴别宫颈癌淋巴结转移的ROC曲线分析Table 3 ROC curve analysis of morphologic indexes and ADC values in diagnosis of lymph node metastasis
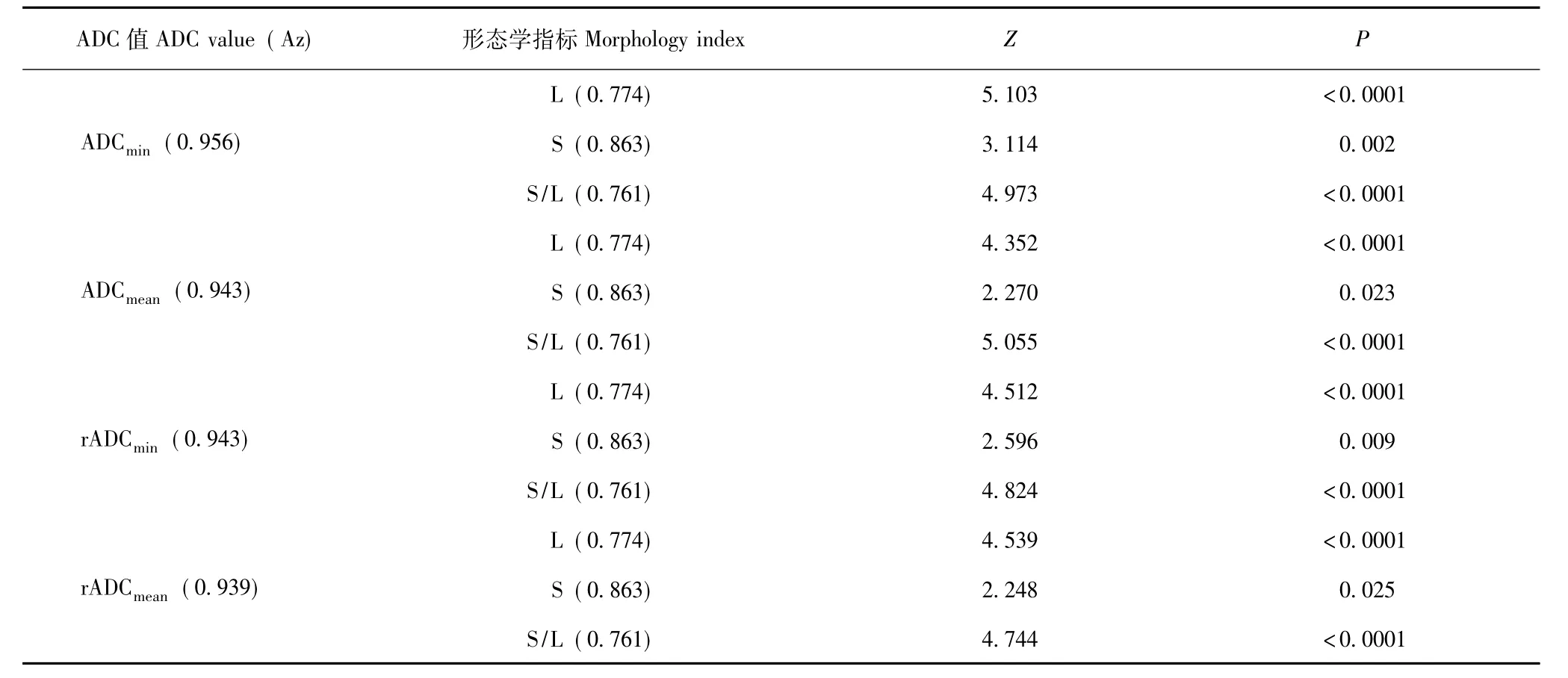
表4 ADC值与形态学参数ROC曲线比较Table 4 Comparison of ROC curves between ADC values and morphologic indexes
讨 论
临床工作中,广泛接受的是以淋巴结大小作为判断其是否转移的指标,但缺乏统一标准。大多数研究认为盆腔非转移淋巴结S的上限值为10 mm[3]。Benedetti等[7]对225例宫颈癌患者行根治性子宫切除及系统性盆腔、腹主动脉旁淋巴结清扫,结果发现80%转移淋巴结的直径 <10 mm。Williams等[8]采用 CT、MRI、PET诊断妇科恶性肿瘤盆腔淋巴结转移与病理对照的研究发现,手术获取的504枚淋巴结中,54.5%转移淋巴结的L<10 mm,22.6%非转移淋巴结的L>10 mm。本研究中,虽然转移淋巴结的L显著大于非转移淋巴结,但二者重叠较大,以此鉴别淋巴结是否转移的特异性及敏感性较低。以S=8.03 mm作为诊断宫颈癌盆腔淋巴结转移的阈值,敏感性和特异性分别为73.0%和86.0%,诊断效能优于淋巴结L,与以往研究结果类似。Koh等[9]认为原发肿瘤不同、淋巴结所在的位置不同,判断淋巴结转移的标准应有所不同,并推荐盆腔淋巴结S>8 mm、腹膜后淋巴结S>10 mm为诊断淋巴结转移的形态学标准。但无论诊断标准如何,发生微小转移的淋巴结可表现为正常大小,非转移淋巴结也可因炎性反应而增大[10],这种本质上的局限性,导致通过淋巴结大小判断淋巴结转移的敏感性较低。
淋巴结的形状也有助于判断淋巴结的性质,良性淋巴结通常呈卵圆形,转移性淋巴结由于S/L比例增加,形态上较良性淋巴结更圆[11]。Fukuya等[12]研究发现,胃癌转移淋巴结的平均S/L为0.81±0.15,明显高于非转移淋巴结的 0.57 ± 0.15。Choi等[13]发现宫颈癌转移淋巴结的L/S(1.32±0.34)显著小于非转移淋巴结的 (1.49±0.39),L/S诊断淋巴结转移的Az为0.652。本研究中以S/L≥0.770做为诊断盆腔淋巴结的阈值,特异性和敏感性分别为78.4%和63.5%,与其他形态学参数类似,诊断效能不高。
ADC值不同于形态学参数,它通过不同状态下水分子弥散速度不同,判断病变组织的性质。本研究中转移淋巴结的ADC显著低于非转移淋巴结,与以往研究结果类似[5,13-16]。Chen 等[16]通过观察根治术后宫颈癌患者淋巴结病理切片发现,转移淋巴结“癌巢”内的细胞密度增加,细胞体积增大,细胞核大而深染,核浆比增高,这些病理改变均可引起细胞内、外间隙变小,进而导致ADC值减低;非转移淋巴结表现为次级淋巴滤泡增大、数目增多,髓窦扩大,次级淋巴滤泡的生发中心体积较大,包绕生发中心的外套层细胞密度较高,这些改变可引起细胞外间隙变小,水分子弥散受限,然而扩大的髓窦使细胞外间隙扩大,在二者的综合作用下,非转移淋巴结的ADC值仍高于转移淋巴结。
本研究中虽然转移与非转移淋巴结的ADC值有显著差异,但ADC值范围存在不同程度的重叠,ADCmin相对重叠最小。Liu等[17]认为转移的淋巴结,可能不是全部被肿瘤组织取代,当部分被取代时,转移区域的水分子扩散受限ADC值较低,非转移区域ADC值较高,因而测量ADCmean可能会减小转移淋巴结与非转移淋巴结之间的差异,而测量转移淋巴结的“热点区域”即ADCmin,则更有利于发现那些仅有少数肿瘤细胞浸润的转移性淋巴结,在其研究中也证实了ADCmin鉴别宫颈癌淋巴结转移的 Az(0.990)最大,选取0.881×10-3mm2/s做为鉴别的阈值,敏感性和特异性分别为95.7%和96.5%。本研究中,ADCmin鉴别淋巴结转移的能力在统计学上并没有优于其他类型的ADC值,可能与本研究中淋巴结径线较小有关,因为保证每个ROI不少于15 mm2,难免扩大了弥散最受限的区域,因而可能高估了ADCmin,降低了转移及非转移淋巴结ADCmin之间的差异。为了缩小转移及非转移淋巴结ADC值之间的重叠性,有学者尝试利用rADC值提高鉴别淋巴结转移的能力。Park等[15]以多个腹部实质脏器、臀大肌、腰椎、腰髓为参照部位计算淋巴结的rADCmean,ROC曲线分析结果表明,相对于肾皮质的rADCmean鉴别宫颈癌淋巴结转移的Az(0.914) 显著大于 ADCmean(0.872),以 rADCmean=0.423做为鉴别转移与非转移淋巴结的阈值,敏感性和特异性分别为86%和93%。但笔者认为肾皮质血流灌注丰富,以单指数衰减模型计算的ADC值,反映水分子的弥散特征不准确,此外患者的年龄、肾功、不同的生理状态等因素均可影响肾皮质的血流灌注,进而影响ADC值。因此,计算淋巴结的rADC值,选择受不可控制因素影响较少的部位更合适。本研究选用宫颈癌原发病灶为参照部位计算淋巴结的rADC值,原因在于理论上转移淋巴结与原发肿瘤的病理特征相似,以此计算的rADC值可以减少或消除不同病理类型及分化程度对淋巴结ADC值的影响,然而本研究中rADC值与ADC值诊断淋巴结转移的能力,无统计学差异,这可能与并非所有淋巴结完全被肿瘤细胞浸润有关,这一推论需要在单个淋巴结水平上的病理对照研究来进一步证实。
本研究具有以下局限性:(1)样本量小,转移淋巴结占所有切除淋巴结的比例较低,因而可能低估了MRI诊断淋巴结转移的敏感性; (2)仅纳入了S≥5 mm的淋巴结,不排除发生微小转移淋巴结的S<5 mm;(3)将MR图像上S最大的1个或n(≥2)个淋巴结视为转移淋巴结,造成样本选择偏倚,然而实际操作中,几乎不可能将MR图像上的淋巴结与病理结果进行一对一的对照研究。
综上,本研究结果表明,对于宫颈癌患者,DWI序列ADC值较常规MRI形态学指标能更好的鉴别转移及非转移淋巴结。
[1]Scheidler J,Hricak H,Yu KK,et al.Radiological evaluation of lymph node metastases in patients with cervical cancer.A meta-analysis[J].JAMA,1997,278(13):1096-1101.
[2]Rockall AG,Sohaib SA,Harisinghani MG,et al.Diagnostic performance of nanoparticle-enhanced magnetic resonance imaging in the diagnosis of lymphnode metastases in patients with endometrial and cervical cancer [J].J Clin Oncol,2005,23(12):2813-2821.
[3]Choi HJ,Kim SH,Seo SS,et al.MRI for pretreatment lymph node staging in uterine cervical cancer[J].AJR Am J Roentgenol,2006,187(5):W538-W543.
[4]Bipat S,Glas AS,van der Velden J,et al.Computed tomography and magnetic resonance imaging in staging of uterine cervical carcinoma:a systematic review [J].Gynecol Oncol,2003,91(1):59-66.
[5]Chung HH,Kang KW,Cho JY,et al.Role of magnetic resonance imaging and positron emission tomography/computed tomography in preoperative lymph node detection of uterine cervical cancer[J].Am J Obstet Gynecol,2010,203(2):156.e1-e5.doi:10.1016/j.ajog.2010.02.041.
[6]Klerkx WM,Veldhuis WB,Spi jkerboer AM,et al.The value of 3.0 Tesla diffusion-weighted MRI for pelvic nodal staging in patients with early stage cervical cancer[J].Eur J Cancer,2012,48(18):3414-3421.
[7]Benedetti-Panici P,Maneschi F,Scambia G,et al.Lymphatic spread of cervical cancer:an anatomical and pathological study based on 225 radical hysterectomies with systematic pelvic and aortic lymphadenectomy [J].Gynecol Oncol,1996,62(1):19-24.
[8]Williams AD,Cousins C,Soutter WP,et al.Detection of pelvic lymph node metastases in gynecologic malignancy:a comparison of CT,MR imaging,and positron emission tomography[J].AJR Am J Roentgenol,2001,177(2):343-348.
[9]Koh DM,Hughes M,Husband JE,et al.Cross-sectional imaging of nodal metastases in the abdomen and pelvis[J].Abdom Imaging,2006,31(6):632-643.
[10]Thoeny HC,Forstner R,De Keyzer F,et al.Genitourinary applications of diffusion-weighted MR imaging in the pelvis[J].Radiology,2012,263(2):326-342.
[11]Lai G,Rockall AG.Lymph node imaging in gynecologic malignancy [J] .Semin Ultrasound CT MR,2010,31(5):363-376.
[12]Fukuya T,Honda H,Hayashi T,et al.Lymph-node metastases:efficacy for detection with helical CT in patients with gastric cancer[J].Radiology,1995,197(3):705-711.
[13]Choi EK,Kim JK,Choi HJ,et al.Node-by-node correlation between MR and PET/CT in patients with uterine cervical cancer:diffusion-weighted imaging versus size-based criteria on T2WI[J].Eur Radiol,2009,19(8):2024-2032.
[14]Kim JK,Kim KA,Park BW,et al.Feasibility of diffusionweighted imaging in the differentiation of metastatic from nonmetastatic lymph nodes:early experience [J].J Magn Reson Imaging,2008,28(3):714-719.
[15]Park SO,Kim JK,Kim KA,et al.Relative apparent diffusion coefficient:determination of reference site and validation of benefit for detecting metastatic lymph nodes in uterine cervical cancer[J].J Magn Reson Imaging,2009,29(2):383-390.
[16]Chen YB,Liao J,Xie R,et al.Discrimination of metastatic from hyperplastic pelvic lymph nodes in patients with cervical cancer by diffusion-weighted magnetic resonance imaging[J].Abdom Imaging,2011,36(1):102-109.
[17]Liu Y,Liu H,Bai X,et al.Differentiation of metastatic from non-metastatic lymph nodes in patients with uterine cervical cancer using diffusion-weighted imaging[J].Gynecol Oncol,2011,122(1):19-24.
Value of Diffusion-weighted Imaging in Diagnosis of Lymph Node Metastasis in Patients with Cervical Cancer
ZHANG Jie,REN Cui,XUE Hua-dan,ZHOU Hai-long,SUN Zhao-yong,JIN Zheng-yu
Department of Radiology,PUMC Hospital,CAMS and PUMC,Beijing 100730,China
JIN Zheng-yu Tel:010-69155441,E-mail:jin_zhengyu@163.com
ObjectiveTo investigate the value of diffusion-weighted imaging(DWI)in the differentiation of metastatic lymph nodes from non-metastatic lymph nodes in cervical cancer.MethodsIn 65 patients who underwent lymph node dissection for cervical cancer,conventional MRI and DWI examinations were performed before surgery.Of the 1590 total dissected pelvic lymph nodes,392 enlarged nodes with a short-axis diameter(S)of 5 mm or greater were included for further analysis.Each of the size-based criteria [i.e.,S,long-axis diameter(L),and S/L ratio] and apparent diffusion coefficient(ADC)-based criteria(i.e.,ADCmin,ADCmean,rADCmin,rADCmean) were compared between metastatic lymph nodes and non-metastatic lymph nodes.ResultsThere were statistically significant differences between metastatic and non-metastatic lymph nodes in S,L,S/L ratio,ADCmin,ADCmean,rADCmin,and rADCmean(all P < 0.0001).The Az of the ADCmin(0.956)was greater than that of the other ADC-based criteria and all size-based criteria.Using ADCmin=759.0 ×10-6mm2/s,the sensitivity and specificity for differentiating metastatic from non-metastatic lymph nodes were 95.2%and 92.1% ,respectively.ConclusionDWI,particularly ADCmin,is feasible for differentiating metastatic from non-metastatic pelvic lymph nodes in patients with cervical cancer.
cervical cancer;lymph node metastasis;diffusion-weighted imaging
金征宇 电话:010-69155441,电子邮件:jin_zhengyu@163.com
R445.2
A
1000-503X(2014)01-0073-06
10.3881/j.issn.1000-503X.2014.01.014
2013-07-03)

