索拉非尼联合经肝动脉化疗栓塞术治疗原发性肝细胞癌的疗效和安全性
陈路锋,苏洪英,徐 克,邵海波,梁松年,刘 静
中国医科大学附属第一医院介入放射科辽宁省影像诊断与介入治疗重点实验室辽宁省肝癌转化医学研究中心,沈阳 110001
·论 著·
索拉非尼联合经肝动脉化疗栓塞术治疗原发性肝细胞癌的疗效和安全性
陈路锋,苏洪英,徐 克,邵海波,梁松年,刘 静
中国医科大学附属第一医院介入放射科辽宁省影像诊断与介入治疗重点实验室辽宁省肝癌转化医学研究中心,沈阳 110001
目的评估索拉非尼联合经肝动脉化疗栓塞术 (TACE)治疗原发性肝癌的疗效和安全性。方法回顾性分析在中国医科大学附属第一医院介入放射科行索拉非尼系统治疗并联合TACE治疗的10例不可切除肝癌患者的临床资料,按照修订的实体瘤疗效评估标准评价疗效,采用Kaplan-Meier法分析患者生存情况,采用美国国立癌症研究所常见毒性反应分级标准3.0版评价安全性。结果10例患者中,2例为完全缓解,3例为部分缓解,3例为疾病稳定,2例为疾病进展,中位总生存期为29.5个月。有9例出现不同程度的不良反应,均为3级或以下级别,最常见的不良反应为手足皮肤反应 (7/10)和腹泻 (6/10)。结论索拉非尼联合TACE治疗原发性肝癌是一种安全、有效的治疗方法。
肝细胞癌;索拉非尼;化学栓塞;治疗结果;存活率
Acta Acad Med Sin,2014,36(1):33-36
原发性肝癌是我国常见的恶性肿瘤之一,为我国第2位肿瘤相关死亡原因[1]。肝癌发病隐匿,大多数病例在发现时已失去手术时机,经肝动脉化疗栓塞术(transarterial chemoembolization,TACE)目前已成为中晚期肝癌最主要的姑息性局部治疗手段。然而,反复多次的TACE治疗可以加重肝脏损害,并且由于一般不能造成肿瘤组织彻底坏死,反而诱发局部缺血、缺氧环境,导致残余肿瘤组织中缺氧诱导因子、血管内皮生长因子等表达增加[2],最终引起肿瘤复发,因此TACE治疗的远期疗效并不理想。索拉非尼是一种口服的多激酶抑制剂,同时具有抑制肿瘤细胞增殖和血管生成的双重作用。SHARP[3]和 ORIENTAL[4]两项全球多中心、随机对照临床试验研究表明,索拉非尼可以延长晚期肝癌患者的中位生存期,使索拉非尼成为第1个可以延长晚期肝癌患者生存期的系统性治疗药物,因此如何综合应用不同的方法治疗肝癌成为目前研究的热点。本研究回顾性分析了中国医科大学附属第一医院采用索拉非尼联合TACE治疗的10例原发性肝癌患者的临床资料,探讨了联合治疗的疗效和安全性。
资料和方法
资料来源 2009年9月21日至2012年7月25日在中国医科大学附属第一医院介入放射科行索拉非尼系统治疗并联合TACE治疗的不可切除肝癌患者10例,其中,男9例,女1例,中位年龄54.5岁(29~84岁);基础病因为乙型肝炎病毒 (hepatitis B virus,HBV)感染者7例,丙型肝炎病毒 (hepatitis B virus,HCV)感染者2例,不明者1例;根据巴塞罗那分期标准 (Barcelona Clinic Liver Cancer stage,BCLC),A期3例,B期4例,C期3例;4例既往曾行外科手术治疗。肝内肿瘤中位数:2个;肿瘤中位最大径5.9 cm;有门静脉侵犯者11例;有淋巴结转移者3例;远处转移者4例;有腹水者3例;肝功Child-pugh分级A级9例,B级1例;美国东部肿瘤协作组活动状态评分(Eastern Cooperative Oncology Group performance status,ECOG PS)0分4例,1分4例,2分2例。入选标准:(1)经病理组织学确诊或根据欧洲肝病学会 (European Association for the Study of the Liver,EASL) 标准[5]临床诊断为原发性肝细胞癌; (2)肝功能Chil-Pugh分级为A级或B级; (3)ECOG PS评分为0~2分;(4)预计生存期大于3个月;(5)肝内存在至少1个可由CT或MRI评估的病灶; (6)不适合外科手术治疗。
索拉非尼治疗方法索拉非尼 (多吉美,德国拜耳医药保健集团)400 mg每日2次口服,如出现严重不良反应[美国国立癌症研究所常见毒性反应分级标准3.0 版 (the National Cancer Institute Common Toxicity Criteria for Adverse Events,NCI-CTCAE Version 3.0)3~4级]则减量为200 mg每日2次口服或停药,待不良反应减轻后恢复标准剂量。治疗时间为直至患者死亡或出现严重不良反应在减量或停药后不能恢复者。治疗期间肿瘤评价为疾病进展时,继续服用索拉非尼。
TACE治疗方法在索拉非尼治疗开始后10 d左右进行联合TACE治疗,TACE术后3 d内暂停索拉非尼治疗,而后继续。TACE治疗方法为常规经股动脉穿刺,选择性或者超选择性插管至肿瘤供血动脉后,经导管注入1000 mg 5-氟尿嘧啶、20 mg表阿霉素、10 mg丝裂霉素及适量超液化碘油的混合物,碘化油根据肿瘤大小及肿瘤染色情况确定用量多少 (0.5~20 ml)。重复TACE治疗的时间间隔视影像学复查而定,当影像学发现有强化的残存病灶或新发病灶时,再次给予TACE治疗。
疗效评价 入组后每4周行增强CT或增强MRI检查及血清甲胎蛋白 (alpha fetoprotein,AFP)水平检测,3个月后改为每8周进行检查。根据修订的实体瘤疗效评价标准 (the modified Response Evaluation Criteria in Solid Tumors,mRECIST)进行疗效评价,分为完全缓解 (complete response,CR)、部分缓解 (partial response,PR)、疾病稳定 (stable disease,SD)和疾病进展 (progressive disease,PD)。总生存期 (overall survival,OS)为入组开始直至患者死亡或末次随访时间。患者生存时间随访至2013年11月25日。不良反应评价按照NCI-CTCAE 3.0版[6]进行评价,分为0~5级。
统计学处理采用SPSS 17.0统计软件,生存期分析及生存曲线绘制采用Kaplan-Meier法。
结 果
疗效 10例患者中,2例因严重腹泻而调整索拉非尼剂量减半,1~3周后均恢复标准剂量。行联合TACE的中位次数为1次 (1~6次)。根据mRECIST标准进行疗效评价,2例为CR,3例为PR,3例为SD,2例PD。至随访截止日,死亡5例,中位总生存期(median overall survival,mOS)为 29.5 个月 (3.7 ~46.8 个月)(图1)。
不良反应 10例患者中,仅1例未出现明显的不良反应;9例出现不同程度不良反应,均为3级或以下级别,包括手足皮肤反应 (hand-foot skin reaction,HFSR)7例,腹泻6例,高血压2例,脱发2例,皮疹2例,乏力1例,腹痛1例。出现的3级不良反应是HFSR和腹泻,分别为3例和2例。
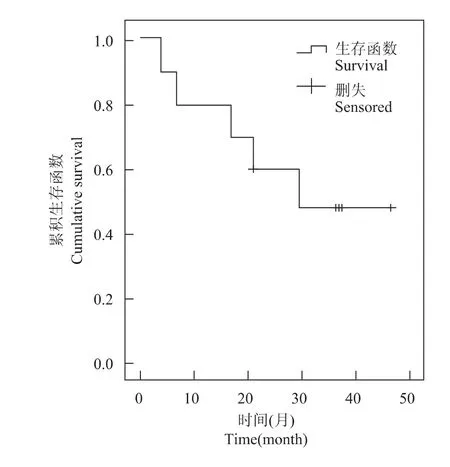
图1 索拉非尼联合经肝动脉化疗栓塞术治疗原发性肝癌患者的生存曲线Fig 1 Survival time of the 10 patients with primary hepatocellular carcinoma treated by combination of sorafenib and transarterial chemoembolization
讨 论
我国原发性肝癌发病率与病死率均居世界首位,已成为严重的疾病负担。肝癌起病隐匿,早期大多无明显临床症状,因此发现时多为中晚期,已失去外科手术治疗机会。目前中晚期肝癌的主要治疗方法为TACE介入治疗和索拉非尼药物治疗,但二者对生存期的延长幅度均有限。
TACE是BCLC B期原发性肝癌的标准治疗,但其很难使肿瘤组织彻底坏死,栓塞后残留肿瘤组织处于缺血、缺氧的微环境,可以通过表达缺氧诱导因子等,诱导血管内皮生长因子等表达增高,继而促进肿瘤血管新生,导致肿瘤复发[7-8]。索拉非尼是一种多激酶抑制剂,是第1个被证明可以延长晚期原发性肝癌生存期的系统性治疗药物,为BCLC C期原发性肝癌的一线标准治疗。索拉非尼是Raf激酶和受体酪氨酸激酶抑制剂,同时具有抑制肿瘤细胞增殖和血管生成的双重作用[9]。两项全球多中心三期随机对照研究显示,索拉非尼可以延长晚期原发性肝癌患者中位生存期,然而其抗肝癌的疗效大多为SD,很少能使肿瘤明显缩小或消失,与对照组相比生存期仅延长2.9个月[3]和2.3个月[4]。由于 TACE 虽可以使肿瘤坏死缩小,但又主要通过肿瘤血管新生发生复发和进展,而索拉非尼是一种有效的抗血管生成药物,但却很少能使肿瘤缩小,理论上二者应该具有互补的抗肿瘤作用,因此将二者联合应用治疗原发性肝癌是临床研究的热点。
本研究10例接受联合治疗的患者中,仅有2例患者因严重腹泻而减少索拉非尼剂量,且之后均恢复正常剂量;有9例出现不同程度的不良反应,总体发生率与文献报道接近[10],均为3级或以下级别,最常见的为手足皮肤反应和腹泻,没有出现4级不良反应。联合TACE没有增加索拉非尼治疗的不良反应发生,说明索拉非尼联合TACE治疗是安全可行的。本研究近期疗效结果显示,10例患者中,2例为CR,3例为PR,3例为SD,2例为PD。而SHARP研究[3]和ORIENTAL研究[4]均无CR,PR仅分别为2%和3%,远低于本组病例中的CR和PR比例,推测这可能主要得益于联合TACE。本组患者的中位总生存期为29.5个月,明显优于SHARP研究中索拉非尼单独治疗的10.7个月。联合治疗方面,国内崔瀚之等[11]报道索拉非尼联合TACE治疗BCLC C期肝癌的中位生存期为20个月,本组资料略优于该数据,这可能是由于本组病例的肿瘤整体分期情况更早。
综上,本研究结果显示,索拉非尼联合TACE治疗原发性肝癌是一种安全、有效的治疗方法,可能会成为不可切除肝癌的一种新的治疗模式。本研究的局限性在于样本量小,没有设置对照,因此进一步证实有待大样本的随机对照研究。
[1]赫捷,陈万青.国家癌症中心和卫生部疾病预防与控制局:中国癌症登记年报2012[M].北京:军事医学科学出版社,2012:30.
[2]Wang B,Xu H,Gao ZQ,et al.Increased expression of vascular endothelial growth factor in hepatocellular carcinoma after transcatheter arterial chemoem-bolization [J].Acta Radiol,2008,49(5):523-529.
[3]Llovet JM,Ricci S,Mazzaferro V,et al.Sorafenib in advanced hepatocellular carcinoma [J].N Engl J Med,2008,359(4):378-390.
[4]Cheng AL,Kang YK,Chen Z,et al.Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma:a phaseⅢrandomised,double-blind,placebo-controlled trial[J].Lancet Oncol,2009,10(1):25-34.
[5]European Association For The Study Of The Liver,European Organisation For Research And Treatment Of Cancer.EASLEORTC clinical practice guidelines:management of hepatocellular carcinoma [J].J Hepatol,2012,56(4):908-943.
[6]Trotti A,Colevas AD,Setser A,et al.CTCAE v3.0:development of a comprehensive grading system for the adverse effects of cancer treatment[J].Semin Radiat Oncol,2003,13(3):176-181.
[7]Liang B,Zheng CS,Feng GS,et al.Correlation of hypoxiainducible factor 1alpha with angiogenesis in liver tumors after transcatheter arterial embolization in an animal model[J].Cardiovasc Intervent Radiol,2010,33(4):806-812.
[8]倪嘉延,黄康华,许林锋.TACE治疗原发性肝癌后HIF-1α表达与肿瘤复发及转移的关系[J].国际医学放射学杂志,2012,35(4):349-352.
[9]Gauthier A,Ho M.Role of sorafenib in the treatment of advanced hepatocellular carcinoma:An update [J].Hepatol Res,2013,43(2):147-154.
[10]Zhao Y,Wang WJ,Guan S,et al.Sorafenib combined with transarterial chemoembolization for the treatment of advanced hepatocellular carcinoma:a large-scale multicenter study of 222 patients[J].Ann Oncol,2013,24(7):1786-1792.
[11] 崔瀚之,戴广海,石燕,等.索拉非尼联合TACE治疗晚期原发性肝癌的临床观察[J].军医进修学院学报,2012,33(4):319-321,324.
Efficacy and Safety of Combination of Sorafenib and Transarterial Chemoembolization in Treating Primary Hepatocellular Carcinoma
CHEN Lu-feng,SU Hong-ying,XU Ke,SHAO Hai-bo,LIANG Song-nian,LIU Jing
Translational Medicine Research Center on Liver Cancer of Liaoning Province,Key Laboratory of Medical Imaging and Interventional Therapy,Department of Radiology,the First Hospital of China Medical University,Shenyang 110001,China
XU Ke Tel:024-83282730,Fax:024-83282629,E-mail:kexu@vip.sina.com
ObjectiveTo evaluate the efficacy and safety of the combination of sorafenib and transarterial chemoembolization(TACE)in the treatment of primary hepatocellular carcinoma(HCC).MethodsThe clinical data of 10 patients with unresectable HCC treated by sorafenib combined with TACE in the Department of Radiology,the First Hospital of China Medical University were retrospectively analyzed.The efficacy was evaluated according to the modified Response Evaluation Criteria in Solid Tumors assessment.Survival was analyzed by Kaplan-Meier method.Safety was evaluated according to the National Cancer Institute Common Toxicity Criteria for Adverse Events version 3.0.ResultsAmong the 10 patients,2 achieved complete response,3 achieved partial response,3 achieved stable disease,and 2 experienced progressive disease.The median overall survival of the cohort was 29.5 months.Different degree of adverse drug reactions(ADRs)occurred in 9 patients but all were at grade 3 or lower.The most common ADRs were hand-foot skin reaction(7/10)and diarrhea(6/10).Conclusion The combination of sorafenib and TACE is an effective and safe treatment for HCC.
hepatocellular carcinoma;sorafenib;chemoembolization;treatment outcome;survival rate
徐 克 电话:024-83282730,传真:024-83282629,电子邮件:kexu@vip.sina.com
R459.9
A
1000-503X(2014)01-0033-04
10.3881/j.issn.1000-503X.2014.01.006
国家高技术研究发展计划 (863计划)(2012AA022701)和辽宁省科学技术计划项目 (2013225585)Supported by the National High Technology Research and Development Program(863 Program)of China(2012AA022701)and the Science and Technology Project of Liaoning Province(2013225585)
2013-12-11)

