炎症因子对类胰岛素样生长因子1沉默表达人冠状动脉平滑肌细胞增殖和凋亡的影响
刘红升,赵晓东,苏 琴,王 琼,姚咏明
中国人民解放军总医院 第一附属医院 1急救部 2超声科,北京 100048
炎症因子对类胰岛素样生长因子1沉默表达人冠状动脉平滑肌细胞增殖和凋亡的影响
刘红升1,赵晓东1,苏 琴1,王 琼2,姚咏明1
中国人民解放军总医院 第一附属医院1急救部2超声科,北京 100048
目的研究炎症因子对类胰岛素样生长因子1(IGF1)沉默表达的人冠状动脉平滑肌细胞 (hCASMCs)增殖和凋亡的影响。方法应用慢病毒RNA干扰技术沉默hCASMCs的IGF1表达。分别用未感染病毒载体的细胞和感染阴性对照病毒载体的hCASMCs作为空白对照和阴性对照。肿瘤坏死因子-α 50 ng/ml与白细胞介素-1β 40 ng/ml共同刺激细胞8 h。采用酶联免疫吸附试验检测细胞培养上清液中IGF1浓度,MTT法及流式细胞术检测细胞的增殖及凋亡。结果炎症因子刺激后,IGF1沉默表达的hCASMCs上清液中IGF1的浓度显著低于空白对照组和阴性对照组 [(426.35±120.96)比(1 030.69 ±54.69) 和 (992.82 ±26.90)pg/ml,P=0.000]; 细胞的增殖活性显著低于两个对照组 (0.302 ± 0.011 比0.401 ±0.028 和0.393 ±0.017,F=37.628,P=0.000),凋亡率显著高于对照组 [(10.57 ±0.99)%比 (0.19 ±0.13)%和 (1.31±0.30)%,P=0.001]。结论炎症因子可能具有抑制IGF1敲减后的hCASMCs增殖和促进凋亡的作用。
类胰岛素样生长因子1;炎症因子;人冠状动脉平滑肌细胞;RNA干扰;增殖;凋亡
Acta Acad Med Sin,2014,36(2):176-179
类胰岛素样生长因子1(insulin-like grown factor 1,IGF1)具有调节血管平滑肌细胞增殖、定向迁移、分化和凋亡的作用。机体中IGF1可通过旁分泌或自分泌方式发挥生物学功能[1]。Okura等[2]认为在动脉粥样硬化斑块进展期,巨噬细胞浸润的内膜的IGF1含量明显少于斑块的其他部位,表明IGF1水平低下伴巨噬细胞浸润是晚期易损斑块破裂的原因之一。本研究用IGF1慢病毒干扰载体转染人冠状动脉平滑肌细胞 (human coronary artery smooth muscle cells,hCASMCs),沉默hCASMCs的IGF1表达[3-4],模拟易损斑块血管平滑肌细胞自分泌IGF1减少的情况,用致炎症前细胞因子肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α) 和白细胞介素-1β (interleukin-1β,IL-1β) 共同刺激hCASMCs,探讨炎症因子对IGF1沉默表达的hCASMCs增殖及凋亡的影响。
材料和方法
hCASMCs培养及分组hCASMCs(Casecade生物制剂公司,俄勒冈州,美国)在加入培养液添加剂的231完全培养液 (Casecade生物制剂公司)中,于37℃、50 ml/L CO2培养箱中培养。用第4代细胞实验。我课题组采用慢病毒RNA干扰技术构建了IGF1慢病毒表达载体,该载体能显著敲减hCASMCs的IGF1基因表达,敲减效率大于70%[3]。
将hCASMCs分为3组:未感染病毒载体的细胞组(空白对照),阴性对照病毒载体PSC-NC-pGCSIL-GFP感染的细胞组 (阴性对照),IGF1慢病毒表达载体感染的细胞组;每组3个复孔。慢病毒载体系统购自上海吉凯公司。3组的病毒感染滴度分别为0、(1.5×107)、 (1.4 ×107)TU/ml。TNF-α 50 ng/ml与 IL-1β 40 ng/ml共同刺激各组细胞8 h后,研究炎症因子刺激对各组细胞表达IGF1、细胞增殖和调亡的影响。
酶联免疫吸附试验检测IGF1的表达IGF1为分泌型蛋白,采用双抗夹心酶联免疫吸附试验检测细胞培养上清液IGF1的浓度[3-4]。酶联免疫吸附试验检测试剂盒购自RayBiotech公司 (佐治亚州,美国)。
MTT法检测细胞增殖收集对数生长期的细胞,取细胞悬液200 μl以1×105/ml的密度接种于24孔培养板,每组设3个复孔,培养24 h。每孔加入0.01 mmol/L MTT(Sigma公司,加利福尼亚州,美国)20 μl,孵育4 h。弃上清,加入二甲基亚砜150 μl,室温下振荡5 min,Bio-Rad酶标仪 (Beckman Coulter公司,加利福尼亚州,美国)测定570 nm处吸光值。
流式细胞仪检测细胞凋亡细胞经冷PBS洗涤2次后,用-20℃预冷的70%乙醇4℃固定过夜。120×g离心4 min,弃上清,PBS洗涤3次,加100 μl PBS重悬,加40 μl含10 mg/ml Rnase的碘化丙啶染液 (Sigma公司),4℃避光染色0.5 h,流式细胞仪 (BeckmanCoulter公司 加利福尼亚州,美国)测定荧光强度,采用CellQuest分析软件进行细胞周期DNA含量分析,确定细胞周期分布。流式细胞仪在激发波长为488 nm,每次计数5 000个细胞。
统计学处理采用SPSS 10.0统计软件。计量资料用均数±标准差表示,两样本均数的比较采用Student’s t检验,3组间均数差异的比较采用随机区组设计的方差分析。P<0.05为差异有统计学意义。
结 果
炎症因子降低IGF1沉默表达的hCASMCs表达IGF1酶联免疫吸附试验结果显示,未用炎症因子刺激的空白对照组、阴性对照组和IGF1慢病毒表达载体感染的细胞组细胞培养上清液中IGF1的浓度分别为(1 137.99 ± 44.17)、(1 096.30 ± 94.20) 和 (753.30 ±152.06)pg/ml,IGF1慢病毒表达载体感染细胞组细胞培养上清液中IGF1的浓度显著低于另外两组 (P=0.008)。炎症因子刺激的3组细胞上清液中IGF1的浓度分别为 (1 030.69 ±54.69)、 (992.82 ±26.90) 和(426.35 ±120.96)pg/ml,IGF1 慢病毒表达载体感染细胞组细胞培养上清液中IGF1的浓度显著低于另外两组 (P=0.000)。炎症因子刺激后两个对照组细胞上清液中IGF1的浓度较炎症因子刺激前有降低趋势,但差异无统计学意义 (P>0.05);而IGF1慢病毒表达载体感染细胞的上清液中IGF1的浓度较炎症因子刺激前显著降低 (P=0.001)。
炎症因子抑制IGF1沉默表达的hCASMCs增殖析因设计的方差分析显示,对未经炎症因子刺激的hCASMCs,干扰 RNA转染细胞的活力为 0.341±0.020,显著低于空白对照组 (0.417 ±0.035) 和阴性对照组 (0.401 ±0.019)(F=12.077,P=0.001);两个对照组的细胞活力相近。炎症因子刺激后,干扰RNA转染细胞的活力为0.302±0.011,显著低于空白对照组 (0.401 ±0.028) 和阴性对照组 (0.393 ±0.017)(F=37.628,P=0.000); 两个对照组的细胞活力相近。两个对照组炎症因子刺激均未显著降低细胞的活力 (P>0.05)。在炎症因子刺激下,IGF1慢病毒表达载体感染细胞的活力显著降低 (P=0.000)。
炎症因子促进IGF1沉默表达的hCASMCs凋亡不论经炎症因子刺激与否,IGF1沉默表达的hCASMCs的凋亡率均显著高于两个对照组 (P=0.000)。两个对照组炎症因子刺激均未显著促进细胞凋亡 (P>0.05)。在炎症因子刺激下,IGF1沉默表达的hCASMCs的凋亡率显著增加 (P=0.001)(表1)。
讨 论
目前,尚不能确定IGF1是抑制急性冠脉综合征斑块形成的保护因子,还是斑块进展的促进因子[5-7]。本研究在沉默hCASMCs中IGF1表达的基础上,模拟易损斑块血管平滑肌IGF1表达减少的情况,用致炎症前细胞因子TNF-α和IL-1β共同刺激hCASMCs,探讨炎症因子对IGF1沉默表达的hCASMCs增殖及凋亡的影响。研究表明血管平滑肌细胞中存在抗凋亡机制,TNF-α单独刺激不能使血管平滑肌细胞凋亡[8-9],在易损斑块中血管平滑肌细胞同时受到两种以上的致炎症前细胞因子刺激,因此本研究选取TNF-α和IL-1β共同刺激hCASMCs。结果显示TNF-α+IL-1β对空白对照组hCASMCs上清液中IGF1的浓度有下调作用,但与非炎症因子处理组比较差异无统计学意义。由于酶联免疫吸附试验方法测定的是细胞培养上清中IGF1的浓度,而不仅是hCASMCs IGF1的表达量;此外,IGF1慢病毒表达载体感染细胞的上清液中IGF1的浓度较炎症因子刺激前显著降低,由此笔者推测当hCASMCs自分泌或旁分泌IGF1减少时,TNF-α+IL-1β能进一步下调hCASMCs表达IGF1,具体机制需要进一步研究。
当TNF-α+IL-1β刺激hCASMCs时,IGF1慢病毒表达载体感染细胞的增殖活力显著低于两个对照组,凋亡率显著高于其他两组;表明在IGF1自分泌或旁分泌减少时,炎症因子促进血管平滑肌细胞增殖的作用被减弱,此外,局部的炎性刺激将促进hCASMCs凋亡。Shai等[10]研究显示过度表达 IGF1基因能提高ApoE基因-/-小鼠粥样硬化斑块的稳定性。这可能是易损斑块内炎症细胞释放的致炎症因子对斑块内血管平滑肌细胞损害加重的原因之一。这一结尚需进一步证实。
表1 各组hCASMCs的细胞周期与凋亡的比较 (n=3,±s,%)Table 1 Comparison of cell cycle and apoptosis in hCASMCs in different groups(n=3,x-±s,%)
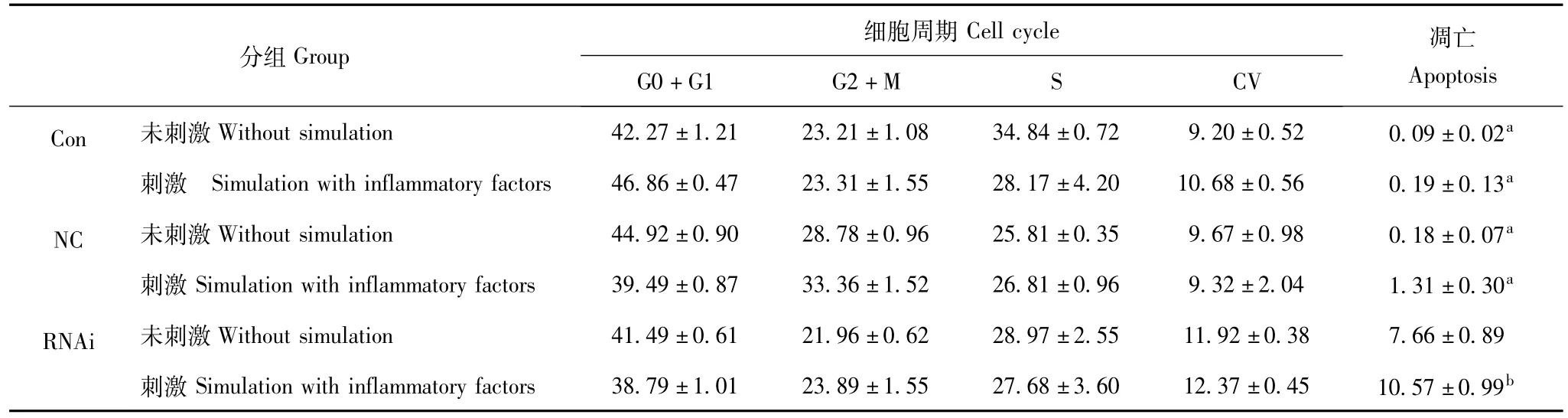
表1 各组hCASMCs的细胞周期与凋亡的比较 (n=3,±s,%)Table 1 Comparison of cell cycle and apoptosis in hCASMCs in different groups(n=3,x-±s,%)
hCASMCs:人冠状动脉平滑肌细胞;Con:空白对照组;NC:阴性对照组;RNAi:类胰岛素样生长因子1慢病毒表达载体感染细胞组;CV:变异系数; 与 RNAi组比较,aP<0.01; 与未刺激组比较,bP<0.01hCASMCs:human coronary artery smooth muscle cells;Con:blank control;NC:negative control;RNAi:hCASMCs transfected with lentiviral vector carrying insulin-like grown factor gene 1;CV:coefficient of variance;aP < 0.01 compared with RNAi group;bP < 0.01 compared with insulin-like grown factor gene 1-slienced hCASMCs without simulation of inflammatory factors
Cell cycle 凋亡分组Group 细胞周期Apoptosis Con 未刺激 Without simulation 42.27 ±1.21 23.21 ±1.08 34.84 ±0.72 9.20 ±0.52 0.09 ±0.02a刺激 Simulation with inflammatory factors 46.86 ±0.47 23.31 ±1.55 28.17 ±4.20 10.68 ±0.56 0.19 ±0.13 G0+G1 G2+M S CV a NC 未刺激 Without simulation 44.92 ±0.90 28.78 ±0.96 25.81 ±0.35 9.67 ±0.98 0.18 ±0.07a刺激 Simulation with inflammatory factors 39.49 ±0.87 33.36 ±1.52 26.81 ±0.96 9.32 ±2.04 1.31 ±0.30a RNAi 未刺激 Without simulation 41.49 ±0.61 21.96 ±0.62 28.97 ±2.55 11.92 ±0.38 7.66 ±0.89刺激 Simulation with inflammatory factors 38.79 ±1.01 23.89 ±1.55 27.68 ±3.60 12.37 ±0.45 10.57 ±0.99b
综上,炎症因子可能具有抑制IGF1敲减后的hCASMCs增殖和促进凋亡的作用。
[1]Bayes-Genis A,Conover CA,Schwartz RS.The insulin-like growth factor axis:a review of atherosclerosis and restenosis[J].Circ Res,2000,86(2):125-130.
[2]Okura Y,Brink M,Zahid AA,et al.Decreased expression of insulin-like growth factor-1 and apoptosis of vascular smooth muscle cells in human atherosclerotic plaque[J].J Mol Cek Cardiol,2001,33(10):1777-1789.
[3] 刘红升,赵晓东,苏琴.人IGF-I基因慢病毒介导RNA干扰有效靶点的设计及筛选[J].中国急救医学,2012,32(9):799-803.
[4] 刘红升,赵晓东,苏琴.靶向IGF-I慢病毒介导RNA干扰对hCASMC生物学功能影响 [J].中国急救医学,2012,32(5):434-437.
[5]Higashi Y,Sukhanov S,Anwar A,et al.Aging,atherosclerosis,and IGF-1 [J].J Gerontol A Biol Sci Med Sci,2012,67(6):626-639.
[6]Mason EJ.Grell JA,Wan J,et al.Insulin-like growth factor(IGF)-Ⅰand IGF-Ⅱ contribute differentially to the phenotype of pregnancy associated plasma protein-A knock-out mice[J].Growth Horm IGF Res,2011,21(5):243-247.
[7]Gaidamauskas E,Gyru PC,Boldt HB,et al.IGF dependent modulation of IGF binding protein(IGFBP)proteolysis by pregnancy-associated plasma protein-A(PAPP-A):multiple PAPP-A-IGFBP interaction sites[J].Biochim Biophys Acta,2013,1830(3):2701-2709.
[8]Woelfle J,Roth CL,Wunsch R,et al.Pregnancy-associated plasma protein A in obese children:relationship to markers and risk factors of atherosclerosis and members of the IGF system [J].Eur J Endocrinol,2011,165(4):613-622.
[9]Conover CA,Mason MA,Bale LK,et al.Transgenic overexpression of pregnancy-associated plasma protein-A in murine arterial smooth muscle accelerates atherosclerotic lesion development[J].Am J Physiol Heart Circ Physiol,2010,299(2):H284-H291.
[10]Shai SY,Sukhanov S,Higashi Y,et al.Smooth muscle cellspecific insulin-like growth factor-1 overexpression in Apoe-/-mice does not alteratherosclerotic plaque burden but increases features of plaque stability[J].Arterioscler Thromb Vasc Biol,2010,30(10):1916-1924.
Effect of Inflammatory Factors on Cell Proliferation and Apoptosis in Insulin-like Grown Factor 1-slienced Human Coronary Artery Smooth Muscle Cells
LIU Hong-sheng1,ZHAO Xiao-dong1,SU Qin1,WANG Qiong2,YAO Yong-ming1
1Deparment of Emergency,2Deparment of Ultrasound,First Affiliated Hospital of Chinese PLA General Hospital,Beijing 100048,China
ZHAO Xiao-dong Tel:010-66867371,E-mail:zxd63715@126.com
ObjectiveTo study the effect of inflammatory factors on cell proliferation and apoptosis in insulin-like grown factor 1(IGF1)-slienced human coronary artery smooth muscle cells(hCASMCs).MethodsWe silenced the expression of IGF1 in hCASMCs using the lentivirus-mediated RNA interference technology.Blank control group and negative control group were set using the hCASMCs without the infection of a virus vector and the hCASMCs with the infection of a negative control virus vector,respectively.After the treatment of these cells with both tumor necrosis factor-α 50 ng/ml and interleukin-1β 40 ng/ml,the concentration of IGF1 in cell-culture medium was detected by enzyme-linked immunosorbent assay,and the proliferation and apoptosis were evaluated by MTT assay and flow cytometry.ResultsAfter the simulation with inflammatory factors,the concentration of IGF1 in the supernatant fluid of cultured IGF1-slienced hCASMCs was significantly lower than those in the blank control group and negative control group [(426.35 ±120.96)vs.(1 030.69 ±54.69)and(992.82 ± 26.90)pg/ml,P=0.000) .The proliferation of IGF1-slienced hCASMCs was substantially much less than the two control groups(0.302 ± 0.011 vs.0.401 ± 0.028 and 0.302 ± 0.011,F=37.628,P=0.000),and the apoptosis rate of IGF1-slienced hCASMCs was significant increased compared with the other two groups [(10.57 ±0.99)%vs.(0.19 ±0.13)%and(1.31 ±0.30)% ,P=0.001] .Conclusion Inflammatory factors can inhibit the cell proliferation and promote apoptosis after the knock-down of IGF1 in hCASMCs.
insulin-like grown factor 1;inflammation factors;human coronary artery smooth muscle cells;RNA interference;proliferation;apoptosis
赵晓东 电话:010-66867371,电子邮件:zxd63715@126.com
R392.12
A
1000-503X(2014)02-0176-04
10.3881/j.issn.1000-503X.2014.02.011
国家杰出青年科学基金 (30125020)Supported by the National Sciences Foundation for Outstanding Youth of China(30125020)
2013-09-26)
·论 著·

