基于rDNA部分序列的亚洲小车蝗遗传多样性分析
韩海斌,周晓榕,庞保平,常 静
(内蒙古农业大学农学院,内蒙古 呼和浩特 010019)
0 引言
亚洲小车蝗Oedaleus asiaticus(Bienko)是我国北方蝗虫的优势种[1],同时也是内蒙古草原蝗虫的优势种.亚洲小车蝗在内蒙古的主要分布地区为锡林郭勒盟中西部至鄂尔多斯市东部的典型草原和荒漠草原地区,发生数量是所有蝗虫的50%~60%,严重的时候甚至可以达到90%以上,是草原上最严重的成灾蝗虫[2].亚洲小车蝗发生为害早、且发生数量大的特点对受害作物危害严重,可导致受害作物减少50%以上的产量,甚至颗粒无收[3].亚洲小车蝗对草原的危害更为严重,可破坏草原的自然生态平衡,使草场退化、沙化的速度加快,目前,已经被认定为草原退化的指示灾害种群[4].因此,人们对亚洲小车蝗的遗传多样性进行了大量研究[5-12].
核糖体DNA(rDNA)是目前广泛使用的细胞核DNA分子标记,其编码区的序列高度保守,间隔区的进化速度大约与物种形成的进程相仿[13-15].rDNA中的内转录间隔区(rDNA-ITS)序列的进化速率较快,可以提供较丰富的变异位点和信息位点[16].前人已经对许多物种的ITS序列做过研究[17].王莉萍等对美洲斑潜蝇Liriomyza sativae Blanchard不同地理种群的ITS1序列进行了分析研究[16];李正西和沈佐锐(2002)对松毛虫赤眼蜂Trichogramma dendrolimi Matsumura的不同地理种群的ITS2序列进行了研究分析[18],探讨了它们之间的系统发生关系.
本文对内蒙古地区15个地点亚洲小车蝗的一段rDNA序列进行了扩增、测序和比较分析.希望从分子水平阐述同种蝗虫不同自然种群遗传分化的机制,为其利用与综合防治提供遗传学方面的依据,从而为重灾蝗区蝗虫的防治工作提供基础资料.
1 材料与方法
1.1 蝗虫样本
本实验所用的亚洲小车蝗15个不同地点的样本均为内蒙古的自然种群(见表1),选取成虫个体进行捕捉,然后用养虫笼活体带回实验室中,用液氮速冻处理后放入-40℃的冰箱中保存.每个地理种群取5只蝗虫进行测序.
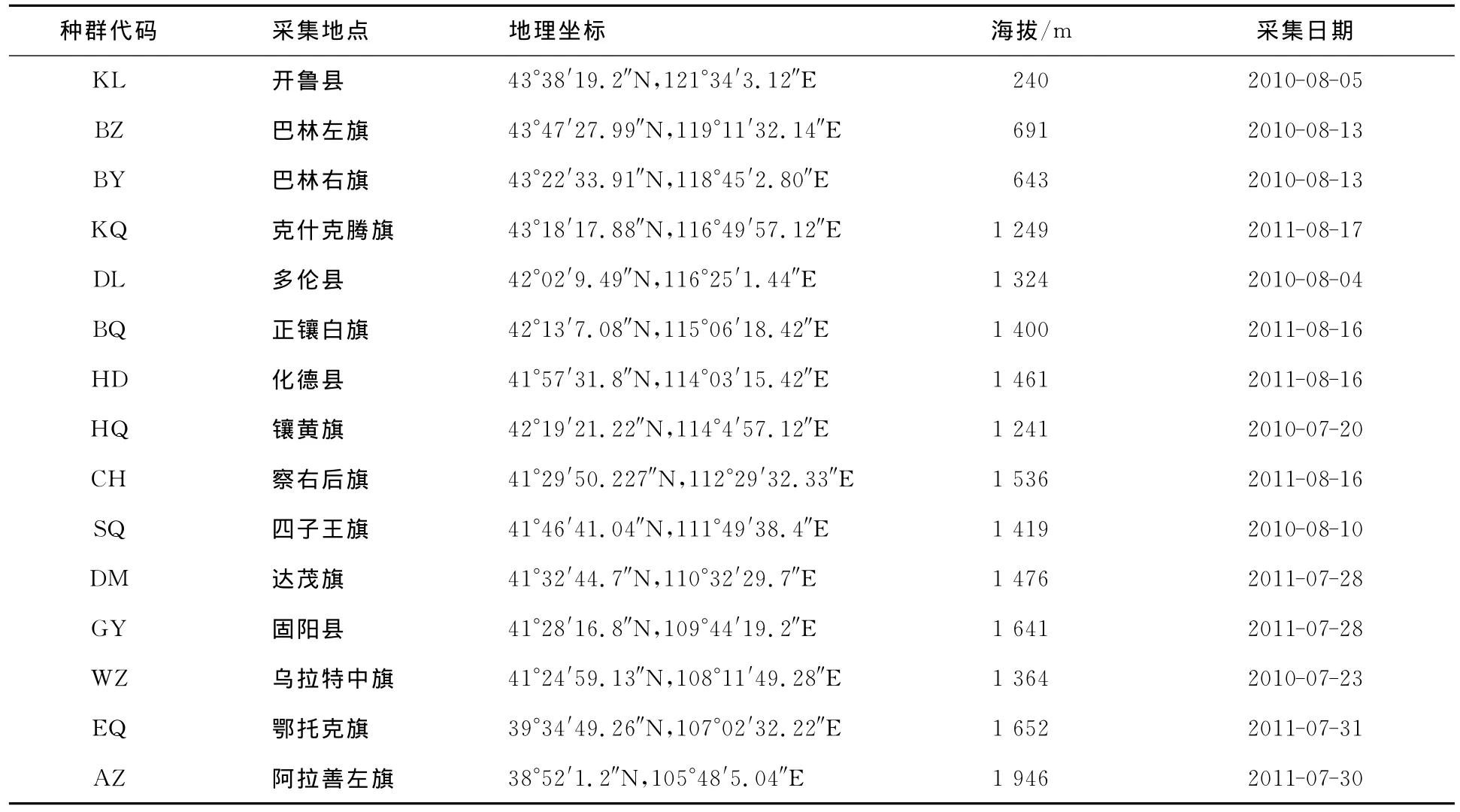
表1 亚洲小车蝗采集信息
1.2 蝗虫基因组DNA提取
取亚洲小车蝗后足股节(<50g),研磨成粉状后放入离心管中备用.使用天根dp304动物基因组DNA提取试剂盒对研磨成粉的样本进行DNA的提取,放入-40℃冰箱中备用.
1.3 PCR扩增及产物检测
PCR扩增体系总体积为50μL,其中2μL模板DNA,5μL 10×PCR Buffer,4μL的dNTP mix,2μL引物(10μmol/L),0.6μL TaKaRa Taq(5U/μL)(大连宝生物工程有限公司),最后用ddH2O补至50μL.
引物序列参考文献[15],由上海生工生物工程股份有限公司合成(见表2).
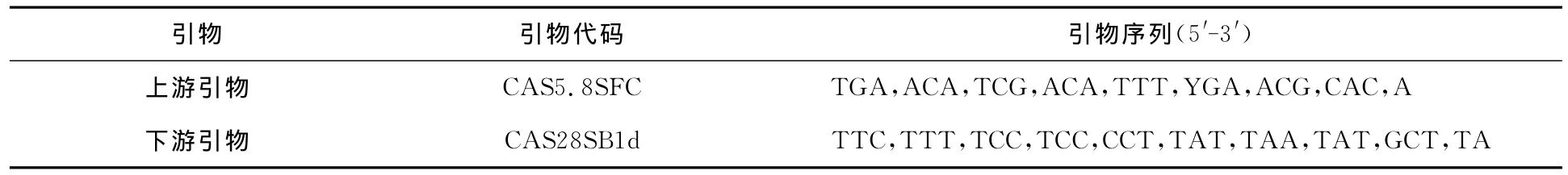
表2 引物序列
PCR反应用BIO-RAD PCR仪进行,反应程序为:95℃预变性3min;95℃变性1min—55℃退火1min—72℃延伸1.5min,35个循环;72℃延伸10min;4℃保存.
通过ADVANCE水平电泳仪,选用2%的琼脂糖凝胶对PCR产物进行电泳检测.
1.4 产物序列测定及序列分析
委托上海生工生物工程股份有限公司对产物进行测序.序列测定的结果与GenBank中已知的蝗虫:中华稻蝗Oxya chinensis formosana(登录号为F385193.1),Chorthippus parallelus(登录号为AY585651.1),小稻蝗Oxya hyla intricata(登录号为 AF385196.1)、日本稻蝗Oxyajaponica japonica(登录号为AF385194.1),台湾小稻蝗Oxyapodisma(登录号为AF385195.1)的rDNA序列进行比对.用Clustal X软件对rDNA序列进行测定;用MEGA 4.0软件[19]对序列特征和遗传距离进行计算;使用DNASP 5.10.1[20]和Excel软件计算单倍型多样性(Hd)、种群遗传分化系数(FST)、基因流(Nm)、核苷酸多样性(Pi)、平均核苷酸差异数(K);采用Distance软件计算地理距离;使用TFPGA进行Mantel检测;使用TCS对单倍型进行分析并构建网络图[21].
2 结果与分析
2.1 序列碱基组成分析
测序结果经与GenBank中已知蝗虫序列的比较、剪切得到部分5.8S、全部ITS2和部分28S共288bp的rDNA序列.测试的15个种群的75个个体序列中,共有19个变异位点,其中包括16个碱基的替换(5个转换和11个颠换)和3个碱基插入,占所测序列的6.60%;19个多态性位点中包括6个单变异多态性位点和13个简约信息位点.序列中T、A、C和G碱基平均含量分别为19.9%,27.6%,19.3%和33.2%,G+C(60.8%)含量高于A+T(39.2%)含量,与已知GenBank中5种蝗虫的对比序列碱基组成特点基本一致(平均碱基含量G+C为63.8%,A+T为36.2%).
2.2 亚洲小车蝗种群内遗传多样性分析
15个亚洲小车蝗种群的遗传多样性指数见表3.结果表明,15个种群的单倍型多样性(Hd)在0.000~0.800之间,四子王旗和乌拉特中旗种群最高,察右后旗、巴林右旗和达茂旗种群最低;平均核苷酸差异数(K)在0.000~8.000之间,其中正镶白旗种群最高,察右后旗、巴林右旗和达茂旗种群最低;核苷酸多样性(Pi)在0.0000~0.0280之间,正镶白旗种群最高,察右后旗、巴林右旗和达茂旗种群最低.说明在察右后旗、巴林右旗和达茂旗种群中没有基因变异发生,四子王旗和乌拉特中旗种群变异产生的单倍型最多,正镶白旗种群发生的变异位点最多.
2.3 亚洲小车蝗种群间遗传多样性分析
由表3可知,亚洲小车蝗15个地理种群的遗传分化系数(FST)为0.0506~0.4028,正镶白旗种群检测到的FST值最小,乌拉特中旗种群检测到的FST值最大,均值为0.1495;基因流(Nm)在0.2312~5.9336之间,固阳种群检测到的值最大,察右后旗、巴林右旗和达茂旗种群检测到的值最小,均值为1.9880.结果表明,15个种群之间存在一定的基因交流和遗传分化.

表3 内蒙古亚洲小车蝗15个地理种群遗传多样性指数
2.4 单倍型分析
本文的75条序列中鉴定出8个单倍型(见表4),其中有3个共享单倍型和5个独享单倍型.Hap1被除乌拉特中旗种群以外的其他14个种群所共享,频率为0.6800;Hap2被固阳种群与乌拉特中旗种群共享,频率为0.0400;Hap3为克什克腾旗种群等9个种群所共享,频率为0.2133;其他5个单倍型分别被乌拉特中旗种群、四子王旗种群、阿左旗种群和正镶白旗种群独享,频率均为0.0133.四子王旗种群共有4个单倍型,在15个种群中最多;其次为乌拉特中旗种群,有3个单倍型;察右后旗、巴林右旗和达茂旗种群均只检测出1个单倍型,结果表明在各种群内存在一定的遗传分化.
由单倍型网络图(见图1)可知,由四子王旗种群和正镶白旗种群独享的单倍型Hap5和Hap8分离出其他单倍型而存在,说明四子王旗种群和正镶白旗种群较其他种群变异程度大.Hap5经6次变异形成Hap8,Hap6突变3次形成Hap3,Hap4和Hap7经过4次突变均可形成Hap2.

表4 各单倍型频率及在种群中的分布
2.5 遗传距离和地理距离的相关性分析
使用TFPGA软件对亚洲小车蝗15个种群的遗传距离和地理距离进行Mantel测定,结果见图2、表5,回归方程为y=-8045.4 x+565.8,相关系数r=-0.1554(P=0.8080>0.05).由此可见,本实验研究的亚洲小车蝗15个种群间的遗传距离与其地理距离间无显著的相关关系.

图1 单倍型网络图

图2 内蒙古亚洲小车蝗15个种群的遗传距离与地理距离间的回归分析
3 讨论
本文测定的rDNA的288bp序列中G+C含量高于A+T含量,与GenBank中已知蝗虫的rDNA序列的碱基组成一致,但是与赤眼蜂[18]、褐飞虱、白背飞虱、灰飞虱[22]、米尔顿姬小蜂[23]的rDNA序列的碱基组成相反,与亚洲小车蝗线粒体基因[24]的碱基组成也相反,说明不同物种之间的rDNA序列碱基组成存在差异,且同一物种不同基因的碱基组成同样存在差异.
种群遗传分化系数FST是种群间遗传分化的重要指标.Wright指出,FST<0.05,说明种群间分化很弱;0.05<FST<0.15,表示种群中等分化;0.15<FST<0.25,表示种群遗传分化较大[25].本文中FST平均值为0.1495,说明15个种群间的遗传分化处于中等水平,群体中有14.95%的变异来自种群间,而有85.05%的变异来源于不同个体之间,个体间的变异大于种群间变异,这与李东伟等[5]运用RAPD和韩海斌等[12]运用微卫星标记对不同地点亚洲小车蝗遗传多样性研究的结果相似.
Whitlock和Mccauley认为,种群间基因相互交流的增加会导致种群间遗传分化的减小[26],所以,基因流Nm的存在是影响种群间遗传分化的重要因素;Slatkin认为,种群间的基因流可以阻止完全的基因固定和遗传分化[27].本文中Nm平均值为1.9880(1<Nm<4),15个种群间基因交流处于中等水平.
本文的研究结果表明,内蒙古15个亚洲小车蝗种群的遗传距离与地理距离无显著相关性,这一结果与任竹梅等 对不同区域日本稻蝗Cytb基因序列和高书晶等 对亚洲小车蝗mtDNA ND1基因序列的研究结果一致.造成这一结果的原因可能是,本文所选的rDNA序列在遗传上相对较为保守,进化较慢,在不同地理区域的亚洲小车蝗间没有达到足够的变异;也可能是亚洲小车蝗的迁移能力较强,在不同地理种群间存在较强的基因交流.这一推论符合本实验对基因流的研究结果.李东伟等[5]和韩海斌等[12]运用RAPD和微卫星标记对不同地点亚洲小车蝗遗传多样性研究的结果显示,不同地点的亚洲小车蝗种群的遗传距离与地理距离具有显著的相关性,说明单一的基因序列所涵盖的信息量难以实际反应遗传多样性的全部规律[5,12].因此,在下一步的研究中,应该增加研究内容所涵盖的信息量和样本量,对分子系统学的研究进行更深入的探讨.
[1]张龙,严毓骅,王贵强,等.蝗虫微孢子虫病田间流行的初步调查[J].草地学报,1995,3(3):223-229.
[2]陈素华,乌兰巴特尔,吴向东.内蒙古草地蝗虫生存与繁殖对气候变化的响应[J].自然灾害学报,2007,16(3):66-69.
[3]许富祯,孟正平,郭永华,等.乌兰察布市农牧交错区亚洲小车蝗发生与防治[J].内蒙古农业科技,2005,(7):384-387.
[4]KANG L,CHEN Y L.Dynamics of grasshopper communities under different grazing intensities in Inner Mongolia steppes[J].Entomologia Sinica,1995(2):265-281.
[5]李东伟,高书晶,庞保平,等.内蒙古地区亚洲小车蝗不同地理种群的 RAPD分析[J].昆虫知识,2010,47(3):472-478.
[6]高书晶,李东伟,刘爱萍,等.亚洲小车蝗不同地理种群遗传多样性的等位酶分析[J].生态学杂志,2010,29(10):1967-1972.
[7]高书晶,韩靖玲,刘爱萍,等.亚洲小车蝗和黄胫小车蝗不同地理种群的RAPD遗传分化研究[J].华北农学报,2011,26(2):94-100.
[8]高书晶,李东伟,刘爱萍,等.不同地理种群的亚洲小车蝗mtDNA COⅠ基因序列及其相互关系[J].草地学报,2011,19(5):846-851.
[9]高书晶,刘爱萍,韩静玲,等.不同地理种群的亚洲小车蝗mtDNA ND1基因序列及其相互关系[J].应用昆虫学报,2011,48(4):811-819.
[10]邰丽华,贾建宇,王塔娜,等.内蒙古中东部地区亚洲小车蝗3个种群的遗传多样性分析[J].华北农学报,2011,26(1):122-126.
[11]BERTHIER K,LOISESU A,STREIFE R,et al.Eleven polymorphic microsatellite markers for Oedaleusdecorus(Orthoptera:Acrididae),an endangered grasshopper in Central Europe[J].Molecular Ecology Resources,2008(8):1363-1366.
[12]韩海斌,周晓蓉,庞保平,等.内蒙古亚洲小车蝗种群遗传多样性的微卫星分析[J].昆虫学报,2013,56(1):79-87.
[13]张仁利,耿艺介,黄达娜,等.深圳市白纹伊蚊rDNA-ITS2区克隆及SNP分析[J].中国热带医学,2007,7(1):8-11.
[14]MILLER B R,CRABTREE M B,SAVAGE H M.Phylogeny offourteen Culex mosquito species,including the Culex pipiens complex,inferred from the internal transcribed spacers of ribosomal DNA[J].Insect Molecular Biology,1996,5(2):93-107.
[15]JI Y J,ZHANG D X,HE L J.Evolutionary conservation and versatility of a new set of primers for amplifying the ribosomal intermal transcribed spacer(ITS)regions in sects and other invertebrates[J].Molecular Ecology Notes,2003,3(4):581-585.
[16]王莉萍,杜予州,何雅婷,等.不同地理种群美洲斑潜蝇及近缘种的rDNA-ITS1序列分析和比较[J].昆虫学报,2007,50(6):597-603.
[17]唐伯平,周开亚,宋大祥.核rDNA ITS区序列在无脊椎动物分子系统学研究中的应用[J].动物学杂志,2002,37(4):67-73.
[18]李正西,沈佐锐.赤眼蜂分子鉴定技术研究[J].昆虫学报,2002,45(5):559-566.
[19]KUMAR S,TAMURA K,NEI M.MEGA3:integrated software for molecular evolutionary genetics analysis and sequence alignment[J].Briefings in Bioinformatics,2004,5(2):150-163.
[20]ROZAS J,SÁNCHEZ-DELBARRIO J C,MESSEGUER X,et al.DnaSP,DNA polymorphism analyses by the coalescent and other methods[J].Bioinformatics,2003,19(18):2496-2497.
[21]CLEMENT M,POSADA D,CRANDALL K A.TCS:a computer program to estimate gene genealogies[J].Molecular ecology,2000,9(10):1657-1659.
[22]刘玉娣,林克剑,韩兰芝,等.基于rDNA ITS1和ITS2序列的褐飞虱、白背飞虱和灰飞虱的分子鉴定[J].昆虫学报,2009,52(11):1266-1272.
[23]黄蓬英,廖富荣,林玲玲,等.米尔顿姬小蜂rDNA ITS1和ITS2的序列分析及其分子鉴定[J].应用昆虫学报,2012,49(2):448-453.
[24]MA C,LIU C X,YANG P C,et al.The complete mitochondrial genomes of two band-winged grasshoppers,Gastrimargus marmoratus and Oedaleus asiaticus[J].BMC Genomics,2009,10:1-12.
[25]WRIGHT S.Evolution and the genetics of populations(Vol.4):variability within and among natural populations[M].Chicago and London:University of Chicago Press,1978.
[26]WHITLOCK M C,MCCAULEY D E.Indirect measures of gene flow and migration:FST≠1/(4 Nm+1)[J].Heredity,1999,82:117-125.
[27]SLATKIN M.Gene flow and the geographic structure of natural population[J].Science,1987,236:787-792.
[28]任竹梅,马恩波,郭亚平.不同区域日本稻蝗Cytb基因序列及相互关系[J].山西大学学报,2002,25(3):244-248.

