腺苷钴胺治疗奥沙利铂所致神经毒性的临床观察
朱 晓 邬晓敏 徐永萍
奥沙利铂是治疗消化道肿瘤最基本的化疗药物之一,在临床上广泛应用,其最主要的不良反应是神经系统毒性。根据国内外报道奥沙利铂急性神经系统毒性的发生率为85%~96%[1-2],表现为冷刺激诱发或加剧肢体末端或口周区感觉障碍,咽喉部感觉麻木、紧缩感等;慢性神经系统毒性主要表现为上下肢麻木,末梢神经减退或感觉缺失等,严重者甚至可影响肢体功能,严重影响了患者的生存和生活质量。我们利用腺苷钴胺治疗奥沙利铂化疗所致的神经毒性,有较好的临床疗效,现报告如下。
1 资料与方法
1.1 一般资料
收集本院2010年3月-2012年12月收治的消化道肿瘤患者,均以奥沙利铂第1天滴注为基础用药的方案化疗。经病理组织学和(或) 细胞学确诊为胃癌、结肠癌、直肠癌,卡氏评分均>60分,生存期>3个月,均无心、肺、肝功能障碍,无糖尿病及脑血管疾病后遗症等引起周围神经毒性的原因及临床表现。其中治疗组28例,男性18例,女性10例,年龄40~65岁,中位年龄56岁;对照组30例,男性17例,女性13例,年龄38~63岁,中位年龄55岁。2组一般资料:年龄、性别、病程、肿瘤分期及病理类型,差异无统计学意义(P>0.05) 。
1.2 治疗方法
治疗组:奥沙利铂化疗当天开始,给予腺苷钴胺1.5 mg肌注,每天1次,连续7天。对照组:奥沙利铂化疗,不联合任何改善神经毒性的药物(维生素B12、甲钴胺、中药等)。1个月后观察神经毒性发生情况。
1.3 评价标准
神经毒性采用1992年Levi 标准分级,记录各阶段末梢神经毒性的发生和程度。0级:无感觉异常;1级:感觉异常或感觉迟钝(遇冷引起),7天内完全消退;2级:感觉异常或感觉迟钝,21天内可完全消退;3级:感觉异常或感觉迟钝,21天内不能完全消退;4级:感觉异常或感觉迟钝,伴有功能障碍。
1.4 统计学方法
采用SPSS13.0统计软件进行系统分析,发生率比较采用χ2检验,平均持续时间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 神经毒性发生情况
58例患者神经毒性的总发生率为60.34%,其中治疗组共发生13例,发生率为46.43%;对照组共发生22例,发生率为73.33%。周围神经毒性发生率2组比较,差异有统计学意义(χ2=4.381,P=0.036)。神经毒性平均持续时间治疗组和对照组分别为(4.03±5.24)天和(7.93±7.86)天,2组比较,差异有统计学意义(t=2.204,P=0.03)。见表1。
表1 2组神经毒性发生情况 (例,%)
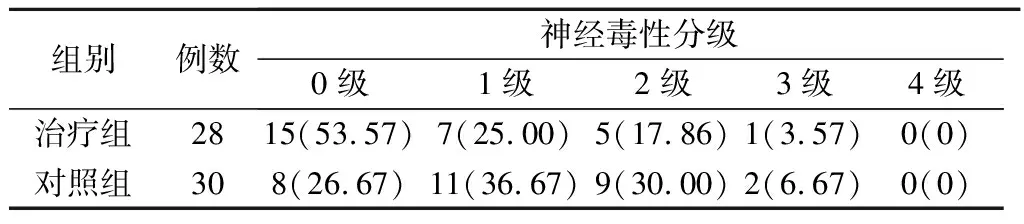
组别例数神经毒性分级0级1级2级3级4级治疗组2815(53.57)7(25.00)5(17.86)1(3.57)0(0)对照组308(26.67)11(36.67)9(30.00)2(6.67)0(0)
2.2 安全性评价
腺苷钴胺没有明显的不良反应。本研究28例治疗组中只有2例患者有注射部位的疼痛,出现小硬结,经过热敷护理后完全消退,无任何后遗症。
3 讨论
目前奥沙利铂神经毒性的发生机制尚未明确。Holmes等[3]提出,铂引起的神经毒性是由于其在外周神经系统蓄积所致,主要的损伤部位可能在脊髓背根中心神经元,这与铂中毒的蓄积研究相一致。另外有研究发现,奥沙利铂引起的1种突出表现是传导亢进的感觉-运动神经症状,其导致1种混合动作电位幅度和时程的增加,是通过代谢产物草酸盐对钙离子的螯合作用来改变神经元的电压依赖的钠离子通道,从而延长了外周神经的不应期[4]。因此根据不同的发生机制,临床上出现了较多防治方法[5]。除了一般护理方面包括告知患者保暖的重要性,用温开水刷牙,漱口、沐浴均用热水,饮食温软;化疗当天开始戴手套,以免接触金属器物有冷感而加重肢端麻木;严格控制输液速度和尽量选择中心静脉输注药物,重视健康教育,落实各项护理措施,出现周围神经毒性症状要积极给予对症处理[6-7]。药物方面临床上应用较多的有谷胱甘肽[8]以及钙镁合剂[9],钠离子通道阻滞剂[10],促红细胞生成素[11]等。另外祖国医学防治对化疗后神经毒性的研究也取得了一定的成就[12-13]。然而这些都没有显著的疗效。
腺苷钴胺,又称腺苷辅酶维生素B12,是维生素B12的活性辅酶形式之一,能抑制神经髓鞘异常脂肪合成,阻断神经纤维脱髓鞘的发生和发展,修复受损神经,促进三大物质代谢,维护细胞正常功能,使谷光甘肽含量正常化,保护神经细胞,参与血红素合成。因此腺苷钴胺在应用初期主要用于治疗贫血,随着应用范围不断扩大,逐渐用于多发性神经炎、末梢神经炎、三叉神经痛及糖尿病周围神经病变等。但临床上针对化疗所致的神经毒性应用腺苷钴胺十分少见。针对腺苷钴胺对神经的保护、修复作用,本研究除了一般护理外,用腺苷钴胺治疗奥沙利铂所致的神经毒性取得了较好的疗效。
因此,腺苷钴胺治疗奥沙利铂产生的神经毒性疗效较好,且安全性较高,同时因其可改善肿瘤患者的贫血,提高了肿瘤患者的生活质量,所以值得在临床上推广。
[1] Wilson RH,Lehky T,Thomas RR,et al.Acute oxaliplatin induced peripheral nerve Hyperexcitability〔J〕.Clin Oncol,2002,20(7):1767-1774.
[2] 黄彩萍,林朝春,叶珠赛.奥沙利铂治疗消化道肿瘤的临床观察与护理〔J〕.实用肿瘤学杂志,2008,22(1):55-56.
[3] Holmes J,Stanko J,Varchenko M,et al.Comparative neurotoxici-ty of oxaliplatin,cisplatin,and ormaplatin in a Wistar rat mode1〔J〕.Toxicol Sci,1998,46(2):342-351.
[4] 李明颖,徐建明,宋三泰.奥沙利铂的神经毒性机理与防治方法研究进展〔J〕.中华医学杂志,2006,86(19):1365-1367.
[5] 赵国光,何友兼.草酸铂的神经毒性及其预防和治疗〔J〕.实用癌症杂志,2005,20(6):668-672.
[6] 王 艳,黎 贵,张淑香,等.消化道肿瘤患者应用奥沙利铂引起周围神经毒性的护理进展〔J〕.中国肿瘤临床与康复,2012,19(5):475-476.
[7] 俞春娣.奥沙利铂化疗致病人神经毒性反应的护理〔J〕.护理学杂志,2004,19(5):71.
[8] Cascinu S,Catalano V,Cordella L,et al.Neuroprotective effect of reduced glutathione on oxaliplatin-based chemotherapy in advanced colorectal cancer:a random ized,double-blind,placebo-controlled trial〔J〕.J Clin Oncol,2002,20(16):3478-3483.
[9] Ao R,Wang YH,Li RW,et al.Effects of calcium and magnesium on acute and chronic neurotoxicity caused by oxaliplatin:A meta-analysis〔J〕.Exp Ther Med,2012,4(5):933-937.
[10] Eckel F,Schmelz R,Adelsberger H,et al.Prevention of oxaliplatin-induced neuropathy by carbamazepine.A pilot study〔J〕.Dtsch Med Wochenschr,2002,127 (3):78-82.
[11] Beijers AJ,Jongen JL,Vreugdenhil G.Chemotherapy-induced neurotoxicity:the value of neuroprotective strategies〔J〕.Neth J Med,2012,70(1):18-25.
[12] Xu WR,Hua BJ,Hou W,et al.Clinical randomized controlled study on acupuncture for treatment of peripheral neuropathy induced by chemotherapeutic drugs〔J〕.Zhongguo Zhen Jiu,2010,30(6):457-460.
[13] 阎丽珠,周 洁.益气温阳活血法治疗奥沙利铂神经毒性42例〔J〕.世界中西医结合杂志,2007,2(5):287-290.

