局灶性脑缺血大鼠VEGF/Notch1信号分子的表达及脑泰方的调节作用
陈 懿 葛金文 廖 君 苏 浩
(湖南中医药大学生理学教研室,湖南 长沙 410208)
近年来,血管新生在缺血性脑梗死中的修复作用已引起广泛关注。近年来许多研究表明,脑缺血时,血管内皮细胞生长因子(VEGF)作为最重要的血管生成因素之一,表达增加,促使血管形成。在血管生成过程中,VEGF诱导Notch信号系统的表达。Notch信号通路是生物体进化中高度保守的信号转导通路,作用具有多样性,参与了正常血管生成、缺血后损伤血管的修复等过程,为脑缺血治疗新的生物学靶点〔1,2〕。益气活血法是临床上治疗缺血性脑卒中常用的中医治法。以往研究已证实益气活血中药脑泰方促进局灶性缺血脑组织VEGF的表达,有治疗性血管新生样作用〔3〕。本实验采用线栓法制作局灶性脑缺血大鼠模型,观察脑泰方对局灶性脑缺血大鼠缺血半暗带区Notch信号转导通路的影响,探讨其促进脑缺血损伤后治疗性血管新生样作用的分子机制。
1 材料与方法
1.1药物、主要试剂及仪器 脑泰方由黄芪、川芎、地龙等药物组成,经水煎、醇提后制成浸膏粉(由湖南中医药大学药学院制剂教研室提取,每1 g浸膏粉含生药4 g);Trizol 购自美国INVITROGEN公司, RT-PCR试剂盒购自美国MBI公司。重组人血管内皮抑制素(ED)购自湖南中医药大学第一附属医院。VEGF、Fk-1、Notch1抗体购自Santa Cruz公司。日本Olympus公司BX51光学显微镜及Motic Image Advanced 3.0 图像分析系统,Biomatra公司Tgradient PCR仪。
1.2动物分组与给药 65只雄性清洁级成年SD大鼠,体重250~280 g,购自上海西普尔-必凯实验动物有限公司,许可证号SCXK(沪) 2008-0016。按随机数字表法抽取5只大鼠为假手术组(灌胃生理盐水),只分离血管,不插入线栓,饲养28 d后取材。其余60只大鼠按随机数字表法分为模型组(MCAO组,灌胃生理盐水)、脑泰方提取物组(NTF组,灌胃脑泰方提取物,0.72 g/ml)及NTF+ED(血管内皮抑制素)组,每组20只。参照Longa等〔4〕的方法并加以改进制备大鼠左侧大脑中动脉阻塞模型(MCAO)。模型成功的分级标准参考Bederson等〔5〕对栓塞后大鼠的评分标准作神经功能缺失评分,分值在1~3分者入选,死亡不足动物随机替补。模型成功后24 h腹腔注射恩度(2.5 mg/kg,前3 d每天1次,之后每周2次)。各组再按不同时间点以随机数字表法再分成4组,每组5只,分别于脑缺血后1、7、14、28 d取材。
1.3RT-PCR法检测VEGF、Flk-1、Notch1 mRNA的含量 ①引物合成:引物设计,参考电脑基因库核苷酸序列资料,由上海生工生物工程公司合成纯化。VEGF的引物序列:正义链引物:5'-CGCCAAGCCCGGAAGATTAG-3',反义链引物:5'-CCAGGGATGGGTTTGTCGTG-3'。Flk-1的引物序列:正义链引物:5'-CTGTGCTGTTTCCTACCCTAATC-3',反义链引物:5'- CTTTACCGTCGCCACTTGAC-3'。Notch1的引物序列: 正义链引物: 5'- AATGGAGGGAGGTGCGAAG-3',反义链引物:5'-ATGGTGTGCTGAGGCAAGG -3'。GAPDH的引物序列:正义链引物:5'-AACTCCCTCAAGATTGTCAG-3',反义链引物:5'-GGGAGTTGCTTGAAGTCACA-3'。②脑组织总RNA的提取,采用异硫氰酸胍法。③PCR产物分析:取5 μl PCR扩增产物,在2.5%的琼脂糖凝胶电泳上做扩增产物检测分析,电压50V,30~45 m,溴乙啶染色。紫外灯下拍摄观测电泳条带,激光密度扫描仪扫描底片。计算曲线下峰面积作为PCR产物含量。用下列公式计算VEGF、Flk-1、Notch1 mRNA的表达水平。产物的含量=Notch1(VEGF、Flk-1)扩增产物的光密度值/参照系统GAPDH扩增产物的光密度值。
1.4Western 印迹法检测VEGF、Flk-1、Notch1蛋白的表达 Western印迹法检测VEGF、Flk-1、Notchl的表达:按照总蛋白提取试剂盒进行,提取总蛋白并进行蛋白定量。变性后取40 μg蛋白上样,经10%SDS-PAGE电泳并电转膜到PVDF,5%脱脂奶粉封闭1 h后加入相应一抗:小鼠抗大鼠Notchl抗体(浓度1∶100),兔抗大鼠Flk-1抗体(浓度1∶200)和兔抗大鼠VEGF抗体(浓度1∶200),4℃过夜,洗膜后加入二抗孵育1 h,ECL显影,X光片暗室中感光,图像分析系统进行扫描并记录光密度强度。设β-actin作为内参对照,结果以IOD值表示。以假手术组的相对灰度值作为标准,其他各组的IOD值分别进行标化,再进行统计学分析。
2 结 果
2.1大鼠缺血周边区VEGF、Flk-1、Notch1 mRNA的表达 假手术组中,VEGF、Flk-1、Notch1 mRNA均呈低水平的表达;MCAO组中,VEGF、Flk-1、Notch1 mRNA表达在术后7 d开始升高,14 d 达高峰;NTF组中,同样在术后7 d VEGF、Flk-1、Notch1 mRNA表达开始升高,14 d 达高峰,并且各时间点比同时相MCAO组升高更明显(P<0.05);而在NTF+ED干预组中,VEGF、Flk-1和Notch1 mRNA的表达低于NTF组(P<0.05或P<0.01)。见表1。
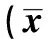
表1 脑泰方提取物对局灶性脑缺血大鼠VEGF mRNA、Flk-1 mRNA和 Notch1 mRNA 表达的影响±s,n=5)
2.2大鼠脑缺血周边区VEGF、Flk-1、Notch1的蛋白表达 MCAO组VEGF蛋白在术后7 d表达开始升高, 14 d达高峰;NTF治疗组中,VEGF蛋白表达同样在术后7 d开始升高,14 d达高峰,且与同时相MCAO组比较,差异有统计学意义(P<0.05);而与NTF组比较,NTF+ED组各时相的VEGF蛋白表达水平明显降低(P<0.05)。见表2。
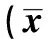
表2 脑泰方对缺血脑组织VEGF 蛋白含量的影响±s,n=5)
2.2.1各组Flk-1蛋白表达情况 MCAO组Flk-1蛋白在14 d 表达开始升高,NTF组在术后7、14和28 d Flk-1蛋白表达高于同时相MCAO组,但差异无统计学意义(P>0.05);而与NTF组比较,NTF+ED组各时相的Flk-1蛋白表达水平明显降低(P<0.05),尤其是术后7 d (P<0.01)。见表3。
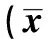
表3 脑泰方提取物对缺血脑组织Flk-1蛋白含量的影响±s,n=5)
2.2.2各组Notch1蛋白表达情况 MCAO组Notch1蛋白表达在7 d 表达开始升高, 14 d达高峰;NTF治疗组中,Notch1蛋白表达在各时相升高显著,与MCAO组比较,差异有统计学意义(P<0.05);与NTF组比较, NTF+ED干预组各时相的VEGF蛋白表达水平明显降低(P<0.01)。见表4。
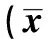
表4 脑泰方提取物对缺血脑组织Notch1蛋白含量的影响±s,n=5)
3 讨 论
缺血性脑损伤是一系列复杂的病理生理过程,其机制尚未完全阐明。MCAO动物模型显示,血管新生在缺血1~2 w明显可见,在缺血半暗带区最为明显〔6〕。Marti 等〔7〕的研究表明,MCAO 后24 h 血管内皮细胞开始增生,血管样结构从软脑膜和脑实质的血管向缺血区发展。本课题组前期研究亦证实,脑缺血后,缺血组织血管新生明显。血管的新生及调控涉及多种细胞因子和信号通路。近年来认为最重要的是VEGF及Notch信号通路。永久性局灶性脑缺血半暗带区的VEGF表达于缺血后2~14 d内持续增高,新血管的形成始于缺血后6~24 h,并一直延续28 d〔8〕。炎症反应及一些药物可通过VEGF及其受体促进血管发生及损伤后的恢复〔9,10〕。而VEGF亦可诱导动脉内皮细胞中Notch信号基因表达。研究也发现Notch信号通路对血管的发生发展,包括细胞增殖、迁移、平滑肌分化、血管生成、动静脉分化等多个方面有重要调控功能〔11〕。Notch信号家族包括Notch受体、配体及其相应的细胞内信号分子。在脊椎动物中目前共发现了4种Notch蛋白的同源体:Notchl、Notch2、Notch3和Notch4。Notch具有多种配体,哺乳动物中有Delta1、Delta-like3(Dll3)、Delta-like4(Dll4)、Jaggedl、Jagged2。在血管系统中,Notch1受体及Dll4主要表达在动脉内皮细胞上。有研究证明,当VEGF信号途径被阻断后,小鼠血管内皮细胞中Dll4的表达减少,从而使血管分支发育过程受阻〔12〕。
本研究前期研究发现脑泰方可促进缺血侧脑组织VEGF的表达,但其是否能进一步上调Notch信号通路的表达,尚不清楚。本实验结果显示,提示脑泰方确有促进脑缺血周边区VEGF-Notch信号通路表达的作用。
4 参考文献
1Angeliki L,Spyros AT.Notch and disease:a growing field〔J〕.Semi Cell dev Biol,2012;23(4):473-80.
2L-K P,Holher G.Angiogenesis:a team effort coordinated by notch〔J〕.Dev Cell,2009;16(2):196-208.
3陈 懿,王国佐,葛金文.脑泰方提取物对局灶性脑缺血大鼠血管内皮细胞生长因子表达的影响〔J〕.中华中医药杂志,2009;24(2):205-7.
4Longa EZ,Weinstein PR,Carlson S,etal.Reversible middle cerebral artery occlusion without craniectomy in rats〔J〕.Stroke,1989;20(1):84-94.
5Bederson JB,Pitts LH,Tsuji M,etal.Rat middle cerebral artery occlusion: evaluation of the model and development of a neurologic examination〔J〕.Stroke,1986;17(3): 472-6.
6Chen HH,Chen CH,Liu HM.Correlation between angiogenesis and basic fibroblast growth factor expression in experimental brain infarct〔J〕.Stroke,1994;25(8): 1651-7.
7Marti HJ,Bernaudin M,Bellail A,etal.Hypoxia-induced vascular endothelial growth factor expression precedes neovascularization after cerebral ischemia〔J〕.Am J Pathol,2000;156 (3): 965-76.
8Zhang ZG,Zhang L ,Tsang W,etal.Correlation of VEGF and angiopoietin expression with disruption of blood-brain barrier and angiogenesis after focal cerebral ischemia 〔J〕.J Cereb Blood Flow Metab,2002;22 (4): 379-92.
9Pillai A,Mahadik SP.Differential effects of haloperidol and olanzapine on levels of vascular endothelial growth factor and angiogenesis in rat hippocampus〔J〕.Schizophr Res,2006;87 (1-3): 48-59.
10Chen J,Zhang C,Jiang H,etal.Atorvastatin induction of VEGF and BDNF promotes brain plasticity after stroke in mice〔J〕.J Cereb Blood Flow Metab,2005,25(2): 281-90.
11Ehebauer M,Hayward P,Arias AM.Notch a universal arbiter of cell fate decisions〔J〕.Science,2006,314(5804): 1414-5.
12Suchting S,Freitas C,Noble F,etal.The Notch ligand Delta-like 4 negatively regulates endothelial tip cell formation and vessel branching〔J〕.Proc Natl Acad Sci,2007;104(9): 3225-30.

