同种异体骨植入联合倒置髓内钉内固定治疗老年股骨下段恶性肿瘤的临床预后及肢体功能
张衍敬 李 颂 漆知明
(奉新第二中医院,江西 奉新 330700)
异体骨在植入人体后有可能会被人体吸收,但较少发生。若仅少量吸收,不影响骨强度,只需要定期观察;若严重吸收,面积较大且影响骨强度,可能需要重新植骨〔1〕。所以,异体骨植骨患者需要严格定期随访,以便医生前后对比,判断有无异体骨吸收,以便及时做出处理。异体骨是重建肿瘤切除后骨缺损的重要方式之一〔2〕,异体骨再植入人体前会经过相应的处理,减少其抗原性,以减少排斥的发生。因为异体骨不是自身骨质,需要较长的愈合过程,愈合比自体骨慢,一般需要以12个月来判断异体骨是否愈合,一般在移植期间做化疗不会影响长骨的情况〔3〕。化疗一般是根据癌细胞的恶性程度,病程发展快慢,患者身体情况来决定,本研究采用同种异体骨植入联合倒置髓内钉内固定治疗老年股骨下段恶性肿瘤效果显著。
1 资料与方法
1.1一般资料 本组资料来自于2000年1月至2011年1月我院骨科收治的股骨远端恶性骨肿瘤患者50例,所有患者均经病理组织学诊断,病灶均经X线片、CT、ECT、Mill明确诊断,其中,男32例,女18例,年龄14~69〔平均(46.9±7.4)〕岁。左侧肢体22例,右侧肢体28例。病理类型:骨肉瘤21例,骨巨细胞瘤20例,软骨肉瘤9例。发病部位:股骨头颈5例,股骨粗隆间5例,粗隆下15例。从肢体出现症状(如酸痛、包块)至入院手术,时间为18 d~10年。根据治疗方法不同分为两组,观察组(28例)均采用术前化疗配合带关节同种异体骨植入及倒置髓内钉内固定治疗,对照组(22例)采用术前化疗配合带关节同种异体骨植入及倒置髓内钉内固定治疗,两组患者年龄、性别、病变部位等一般资料无统计学意义(P>0.05),具有可比性。所有患者均获得随访,平均随访时间(3.4±1.2)年(2.4~5.5年)。
1.2纳入标准 ①符合疾病的临床X线诊断标准,存在股骨缺损;②肿瘤无法行包膜内切除;③无并发其他严重疾患,无精神疾患;④有正常沟通能力;⑤预计生存期超过1年以上。以上条件需同时满足。
1.3排除标准 ①患者不愿参加本研究;②精神障碍或认知障碍者;③预计生存期小于1.5年;④肿瘤局限,发生转移。有以上任何一条均予以排除。
1.4治疗方法 所有患者术前常规取活检术,病理明确诊断后根据病理结果术前常规化疗2~3个疗程,采用卡铂静脉滴注5 mg·ml-1·min-1,3 w为一个周期,4~6个疗程为一个周期。全麻或连续硬膜外麻醉下,取患肢屈曲仰卧位。手术取膝关节髌骨上正中切口进入,沿髌韧带正中纵行切开后,暴露病灶并切除肿瘤、半月板,测量截骨长度及直径,植入预先处理好的同种异体骨或人工假体,采用倒置髓内钉内固定,以骨锥钻一骨洞并进入髓腔,插入导针,钉上端与瞄准器连接,术者握瞄准器把手顺髓腔插入髓内钉。当锁钉将要进入断端时,以断端处为中心取股前外侧切口,切口长短以可看见断端即可。先固定远端螺钉,后锁定近端螺钉。使用钢丝或不吸收线固定患者的四头肌腱、内外韧带、关节囊等以维持关节稳定性。采用术中断端保留的正常骨膜或者胫骨上端软组织进行移植骨的覆盖,留置负压引流管,关闭切口。预防感染使用抗生素5 d。
1.5术后功能锻炼〔3〕术后1 d开始指导股四头肌等长收缩锻炼,3 d开始使用CPM机进行膝关节的功能锻炼,先从屈曲30°开始锻炼,每天增加5°,防止伸膝装置粘连及患肢静脉血栓形成。连续使用10 d后视情况进行康复训练。A型10 d后可扶双拐部分负重行走,3 w后完全负重。B型2 w后可扶双拐部分负重行走,6 w后完全负重。C型3 w可扶双拐部分不负重行走,再根据愈合情况决定部分负重及完全负重的时间。
1.6观察指标〔4〕所有患者随访均2年以上,患者术后肢体功能按照国际保肢学会(ISOLS)功能评分标准,术后依疼痛程度、功能活动、心理接受程度、是否用外部支持行走能力和步态6个指标评价效果。每个指标分0、1、2、3、4、5分,共6级。总分30分,>24分为优,18~24分为良,<15分为差。另外观察两组患者膝关节主动活动度、骨愈合情况、生存情况、患者满意度及并发症发生情况。
1.7统计学方法 采用SPSS17.0统计软件进行t和χ2检验。
2 结 果
2.1临床指标比较 观察组患者术后愈合时间明显低于对照组(P<0.05);观察组患者术后膝关节主动活动度、ISOLS骨肿瘤术后功能重建评分明显高于对照组(P<0.05)。见表1。
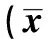
表1 两组患者术后临床指标比较±s)
2.2临床疗效比较 观察组患者术后复发率、1年生存率、2年生存率等指标与对照组比较差异无统计学意义(P>0.05);观察组患者满意度与对照组患者比较差异有统计学意义(P<0.05)。见表2。
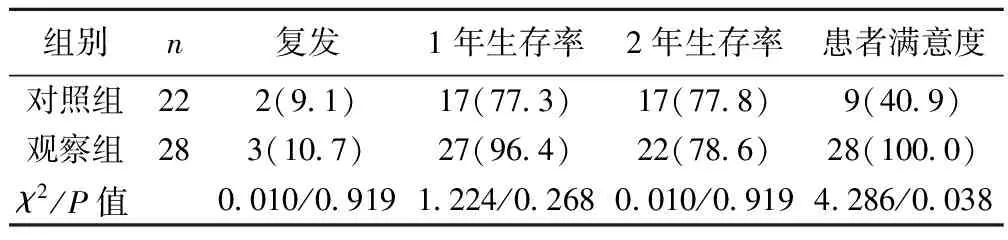
表2 两组患者术后临床疗效比较〔n(%)〕
2.3并发症情况比较 对照组患者术后并发症发生11例,发生率为50.0%,观察组患者术后发生并发症3例,并发症发生率为10.7%,两组患者并发症发生率差异显著(χ2=5.402,P=0.020),见表3。
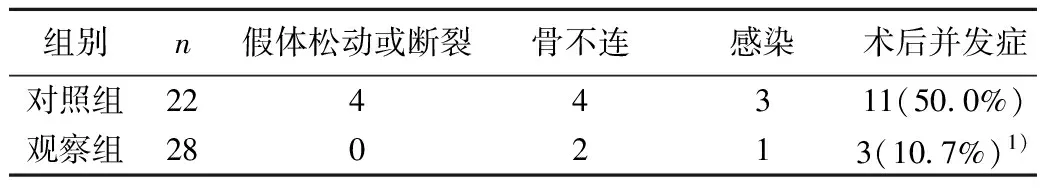
表3 两组患者术后并发症情况比较(n)
3 讨 论
股骨下段是恶性肿瘤的好发部位之一,且具有并发病理性骨折的风险。随着医疗技术的不断发展,此类患者的生存率有所提高。在关节外的骨切除中,可在切除同时给以植骨及内固定,恢复骨的连续性。对半关节或全关节切除者,可作功能位关节融合性〔5〕;当骨肿瘤未侵入软组织,仅为低度恶性时,可施行瘤骨切除、灭活再植术;年龄超过50岁者,可考虑人工半关节或全关节置换术,以保留关节功能〔6〕。骨切除后的植骨需要较长的皮质骨及较多的松骨质,自体骨难以供给,可采用同种异体骨。对于股骨下段人工假体重建,脱位,无菌性松动和聚乙烯衬垫磨损是最常见的假体相关并发症。早期人们使用金属人工假体进行股骨上段恶性肿瘤切除后的重建,但是人工假体重建有最明显的两个问题,最主要的就是肌肉无法重建至金属假体上,致使股骨上段人工假体置换后脱位的发生率较高,并且1/3患者因为外展肌力下降有明显的跛行〔7〕。此外,股骨上端假体常会产生应力遮挡,从而使股骨侧出现骨吸收。最早在1985年,Langlais为了避免这些金属假体缺点而带来的并发症,开始应用假体异体骨复合物进行股骨上段骨缺损重建。后来Langlais使用带肌腱的异体骨和人工假体复合物进行重建。所以当大转子及其周围组织被肿瘤累及时,可以用一段3~4 cm长的带肌腱异体骨和人工关节复合假体进行重建,这样可以使臀肌肌腱缝合至移植的异体骨的肌腱上。人们希望通过复合假体重建方法改善两点:第一、因为可以进行肌肉止点的重建,患者可以主动外展髋关节,行走时无跛行,术后有更好的功能,同时降低关节不稳。第二、通过异体骨传导应力至宿主骨,从而减少由于单纯人工假体重建的应力遮挡带来的骨质吸收。理论上增加假体与骨的接触面积可以降低股骨柄远端的表面应力,这样可以延长内固定物的使用寿命。复合假体重建后功能和假体寿命均好于单纯假体重建。
应用异体骨使得软组织可以早期附着至手术部位,可以保证假体有较好的稳定性〔8〕。假体重建的脱位率为10%~15%。相比之下,复合假体重建中远期随访的脱位率明显降低,为0%~5%。同时,使用复合假体并没有增加急性或慢性感染的概率,但是复合假体重建延长了手术时间和术前准备。当无法进行大转子截骨时,不应当进行不规范的肌肉韧带止点重建。这种情况下建议使用带肌腱的异体骨移植,将臀肌缝合至异体骨肌腱上简便而有效〔9〕。宿主骨和异体骨之间应当尽量避免过多的剪切力。“台阶式”截骨可以获得较好的稳定性。化疗可以抑制骨愈合。使用深低温冻存异体骨进行重建的结果要好于照射骨。复合假体重建术后的功能与标准髋关节相似。这较金属人工假体重建有着明显的改善,后者即使有最好的假体设计,仅有1/3的患者可以主动外展髋关节,并且没有跛行〔10〕。
随着人工关节近几年的发展,能够提供较好的术后功能和满意的远期随访结果。现在股骨下段进行带关节异体骨重建的数目逐渐减少。但股骨下段带关节异体骨重建仍然有前者无法取代的优点:它可以提供更为持久的生物重建,为再次手术提供了充足的骨量,重建肌腱韧带附着。理论上,从远期功能上看应当好于人工假体重建。但是单纯异体骨重建会出现骨性关节炎,特别是在带关节骨移植中更为常见,常见的并发症有异体骨骨折,骨不愈合以及潜在的传染性疾病的传播(如HCV,HIV等)和感染〔11〕。国内外研究证实新鲜同种异体骨能引起剧烈的免疫排斥反应,经深低温冷藏后则免疫排斥反应症状明显降低,但仍能从受体血清中检测到相应的抗体。清除骨髓和脂肪,应用合适的化学试剂消化残存的细胞膜、完全去掉了细胞基质、组织不相容抗原,其免疫原性大为下降,不仅使免疫排斥症状基本不出现,而且受体血清中不能检测到相应的免疫原抗体〔12〕。同时这些免疫原组织的清除,使植入骨能为宿主细胞所适应,使新骨形成过程加快,新骨形成能力增加;冷冻干燥和辐照灭菌因能改变材料的免疫原特征,使免疫原性进一步降低,大大减少免疫排斥症状。相对于膝关节周围人工假体重建的失败率,无论是金属假体还是异体骨重建,都有较低的并发症发生率。单纯人工假体和异体骨是该部位最为常用的两种重建方法,并且后者有着更好的功能预后。该部为假体常见的并发症有脱位,假体松动等,对关节囊及外展肌重建能够有效提高髋关节稳定性,改善患者术后功能。
4 参考文献
1Wang MQ,Dake MD,Wang ZP.Isolated lower extremity chemotherapeutic infusion for treatment of osteosarcoma:experimental study and preliminary clinical report〔J〕.J Vasc Interv Radiol,2001;12(6):731-7.
2李鼎锋,王 磊,崔 秋.皮下埋植式动脉化疗联合咖啡因治疗恶性骨肿瘤的临床观察〔J〕.中国肿瘤临床与康复,2004;11(5):413-5.
3Abe S,Tateishi A,Ogawa K,etal.Long-term local intensive preoperative chemotherapy and joint-preserving conservative surgery for osteosarcoma around the knee〔J〕.Orthopedics,2001;24(7):671-6.
4Wilkins RM,Cullen JW,Odom L,etal.Superior survival in treatment of primary nonmetastatic pediatric osteosarcoma of the extremity〔J〕.Ann Surg Oncol,2003;10(5):498-507.
5Cullen JW,Jamroz BA,Stevens SL,etal.The value of serial arteriography in osteosarcoma:delivery of chemotherapy,determination of therapy duration,and prediction of necrosis〔J〕.J Vasc Interv Radiol,2005;16(8):1107-19.
6李鼎锋,崔 秋,范海涛.可调节延长式人工假体研制及在股骨下段恶性骨肉瘤保肢术的初步应用〔J〕.中国修复重建外科杂志,2005;19(7):534-6.
7Li DF,Cui Q,Wang Q,etal.Application of I(125) brachytherapy combined artificial joint prosthesis in malignant osteo- and soft-tissue sarcoma〔J〕.Cancer Biother Radiopharm,2006;21(2):167-72.
8李鼎锋,崔 秋,王 磊.骨肉瘤合并病理性骨折的近期保肢治疗二例〔J〕.中国修复重建外科杂志,2006;20(1):30-2.
9Ebeid W,Amin S,Abdelmegid A.Limb salvage management of pathologic fractures of primary malignant bone tumors〔J〕.Cancer Control,2005;12(1):57-61.
10尚希福,周业金,胡 飞,等.定制型人工关节置换治疗成人股骨远端肿瘤〔J〕.实用骨科杂志,2008;14(2):88-91.
11Wu CC,Pritsch T,Shehadeh A,etal.The anterior popliteal approach for popliteal exploration,distal femoral resection,and endoprosthetic reconstruction〔J〕.J Arthroplasty,2008;23(2):254-62.
12Hugate RR,Wilkins RM,Kelly CM,etal.Intraarterial chemotherapy for extremity osteosarcoma and MFH in adults〔J〕.Clin Orthop Relat Res,2008;466(6):1292-301.

