CO2水合反应循环增压实验研究①
胡祥江 祁影霞 施军锞
(上海理工大学能源与动力工程学院)
在环境污染日益严重的形势下,由于新型合成制冷剂对环境污染问题的不确定性,考虑使用天然制冷剂成为制冷机替代工质的一个重要趋势[1]。CO2作为自然工质,其GDP值为1,ODP值为0,无毒、不易燃、压力损失小,特别是在CO2跨临界理论循环得到验证以后,使其完全符合节能减排的要求,成为最具潜能的新型制冷剂[2]。
CO2气体水合物是在一定的温度和压力条件下由水和CO2气体形成的一种较为特殊的包络化合物,其形成过程是多元多相的热流体水合反应动力学过程,其过程主要取决于水合物形成引导时间和生长速度。目前,对于CO2水合物的研究主要集中在两个方面:一是CO2气体对甲烷水合物分解的影响,其主要应用在利用CO2来置换天然气水合物以及CO2的海底填埋[3-5];二是对水合物促进技术的研究,其主要应用在利用CO2储能及利用水合物法来分离回收CO2[6-8]。在实验室研究阶段,用于合成CO2水合物的反应容器一般都使用不同形式的反应釜,而管式水合反应器的利用较少。管式水合反应器具有结构简单、造价低、工程化容易等优点,且气液两相在反应管内可以利用顺流和逆流的方式进行混合,达到不同程度的换热[9-10]。

该研究创新性地提出了利用CO2水合物水合反应来实现连续增压的设想,并进行了相应的实验验证。首先根据CO2水合物相平衡特性,如图1所示,利用其0 ℃附近的转折温度,在转折温度以下以较低的压力促成水合物合成,然后在高于此转折点的温度下令其分解,从而获得较高压力的CO2气体,然后分别用两个管式水合反应器交替运行来实现连续增压的效果,并获得了不错的实验效果,为其后续应用于制冷循环打下基础。
1 实验部分
1.1 实验装置
自行设计的实验装置主要由供气系统、温度控制系统、水合反应系统和数据采集系统等组成,图2为实验装置示意图。CO2气体由上海市伟创气体有限公司供应,纯度为99.9%(体积分数)。
套管式反应器内管管外径为12 mm,外管管外径为26 mm,壁厚为1 mm,管长为14.4 m。热源提供设备为THD-2010恒温槽,温度范围-10~100 ℃。冷源提供设备为DC-2030低温恒温循环器,温度范围-20~100 ℃。合成压力控制设备为不锈钢减压阀RW41,其压力控制范围为0~10 MPa,分解压力控制设备为TESCOM背压阀,其压力控制范围为0.7~5.5 MPa(G)。气体流量控制设备为221-GKASVBAA的气体质量流量控制器,流量范围为0~1 L/min,即在标准状态下,最大量程为1 m3/min,该型流量控制器的测量精度为±1%。温度测量设备为WZPK-173铂热电阻,该型铂热电阻测量范围是-40~350 ℃,测量精度为±0.5 ℃,压力测量设备由上海山涛自动化仪表有限公司提供,其量程为0~10 MPa,精度为±0.1%。该型压力变送器的输出信号可为4~20 mA的电流信号,也可为1~5 V的电压信号。实验数据由Agilent34972A输出,并记录于计算机中。
1.2 实验方法
具体的实验步骤根据系统图(图2)描述如下:
(1) 在套管式反应器1、2中的外套管上,充入含有添加剂的蒸馏水,然后打开两个恒温槽,设置低温恒温槽和高温恒温槽温度,待恒温槽温度达到设置温度后,打开阀门1、5,使低温恒温槽中的水进入套管式反应器1进行循环。
(2) 与此同时,在气路上,设置减压阀以及背压阀压力,紧接着打开阀门9、10,使得低压气体进入套管式反应器1,当套管的温度随着低温水循环温度的降低而降至合成温度时,外套管中水合物开始合成,并随着水合物的合成,低压CO2不断地进入到反应器。
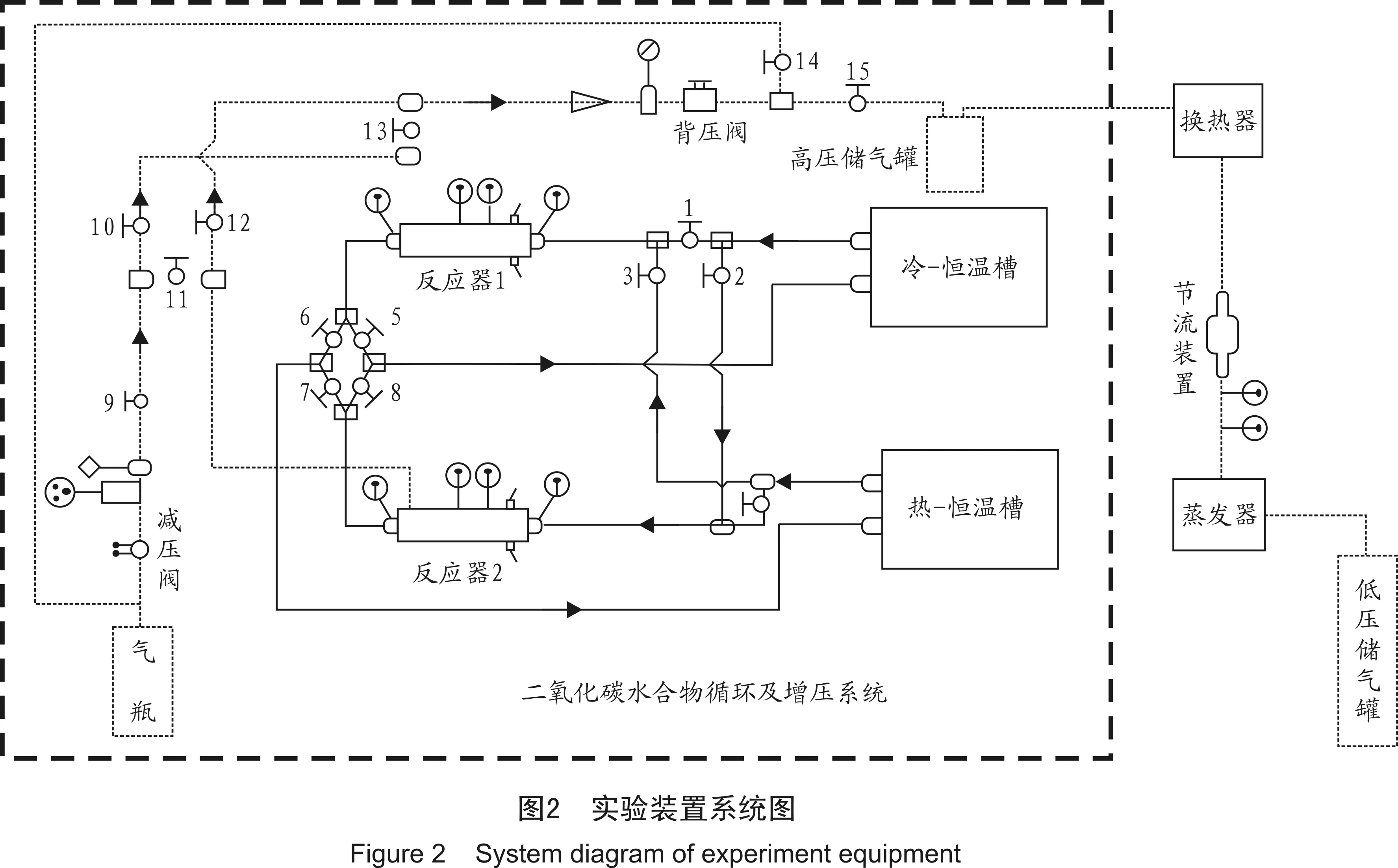
(3) 当反应器1外套管中的水完全生成水合物后,其压力维持在一个恒定值,低压CO2无法再进入。此时,关闭气阀10,打开气阀11、13、14,使得低压CO2进入反应器2中,在液体循环中,关闭阀门1、5,打开阀门2、8以及3、6,此时低温恒温水给反应器2进行降温,而高温恒温水使反应器1中的温度升高,从而使水合物分解,放出CO2气体,获得高压。
(4) 如此往复,当反应器2中水合物合成结束时,在气体循环中,关闭阀门11、13,打开阀门10、12,低压CO2进入反应器1,液体循环中,关闭阀门2、8、3、6,打开阀门1、5、4、7,使得低温循环水给反应器1降温,而高温循环水给反应器2升温分解,获得高压。
(5) 当实验结束时,打开阀门15将高压CO2储存至高压储气罐,然后依次关闭所有阀门及恒温槽,待反应器温度到达常温时,观察反应器中压力,如压力在管子耐压范围内,则可以停止所有操作,并且将Agilent中的数据输出。
2 结果及分析
2.1 添加剂对CO2水合物合成的影响
由于蒸馏水冰点在0 ℃左右,当温度在0 ℃以下时,蒸馏水易形成冰,从而会堵塞管道,使得CO2水合物受阻,根据文献[11]-[13]研究的结果可以得出,在热力学促进剂中最优的是THF,在表面促进剂中最优的是SDS,而这两种添加剂的最优质量分数为THF 4%, SDS 0.3%(以下同)。分别在蒸馏水中加入最优质量分数的THF及SDS,在压力1.4 MPa、温度-2 ℃的环境温度下进行了实验,其实验结果如图3、图4所示。
一般情况下对农作物影响较大的自然灾害有两种,分别是干旱和洪涝,发生干旱时,小型农田水利工程可以将事先储备的水源分流到下游保证农作物的及时灌溉,发生洪涝时,通过小型农田水利工程的有效调节排放能够减少农作物的损害程度,因此,小型农田水利工程建设能够对预防自然灾害起到调节作用,有效降低了自然灾害给农民带来的损失。
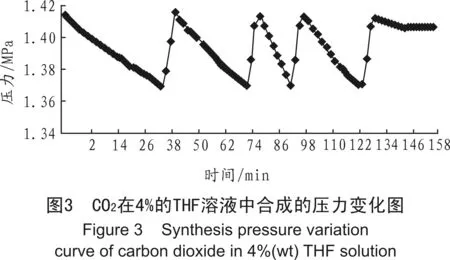

在套管式反应器中,经过多次重复实验,由图3可看出,在4%的THF溶液中生成CO2水合物所需的时间为150 min左右;而由图4可知,在0.3%的SDS溶液中生成CO2水合物所需的时间为60 min左右。通过两者的反应时间可得出,0.3%的SDS溶液更有利于缩短水合物合成的反应时间和在低压下生成CO2水合物。该实验结果与文献[11]在反应釜中所得结果相似,也验证了SDS溶液是最优的水合物促进剂。
2.2 合成温度对CO2水合物合成速率的影响
在合成CO2水合物时,合成温度过低会使溶液结冰,堵塞套管式换热器,使水合反应无法正常进行。因此,在不引起结冰的条件下,寻求最佳的合成温度来缩短合成时间是提高水合物生成效率的途径之一,其实验结果如图5~图7所示。
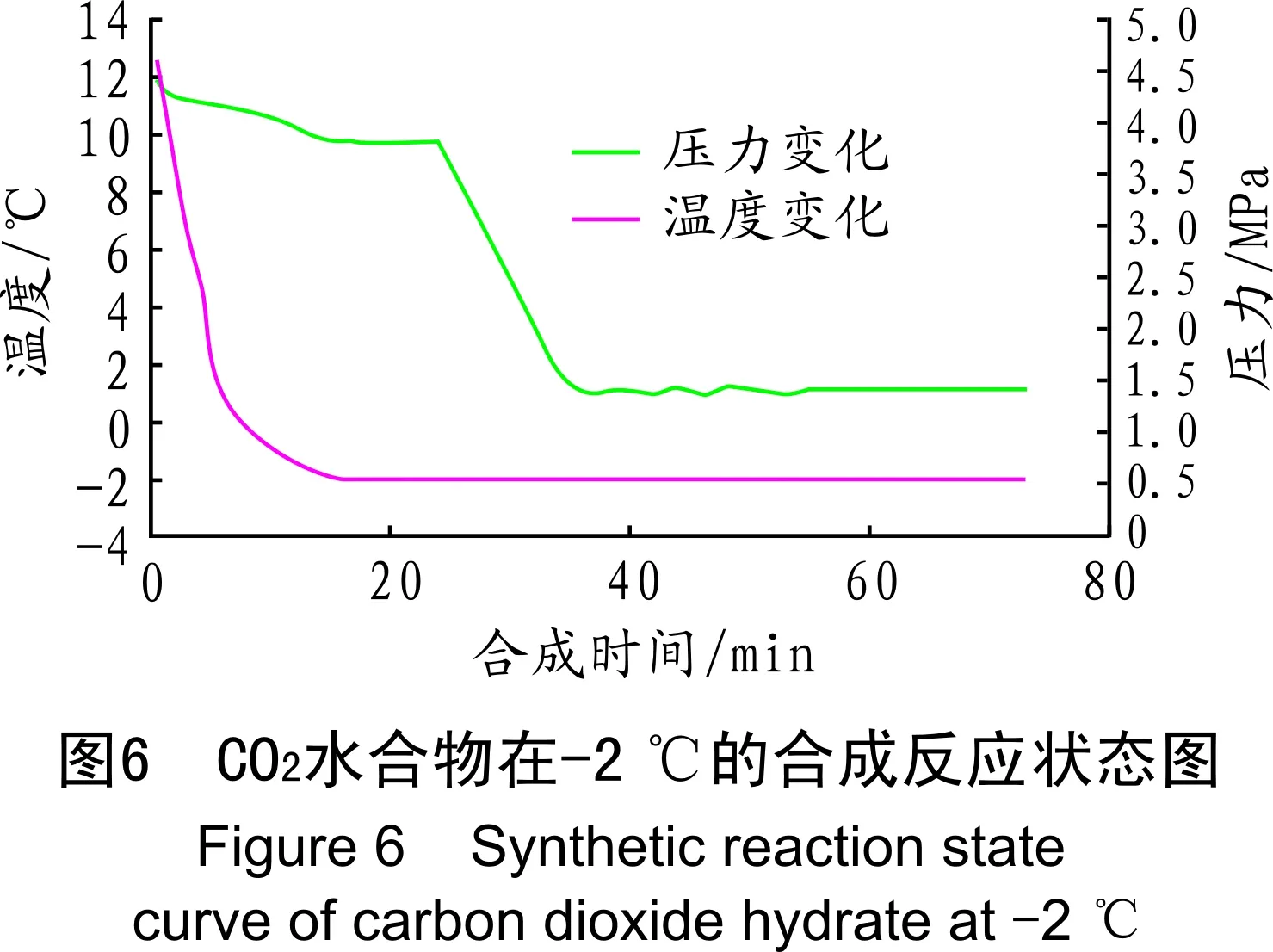
在相同组分的SDS(0.3%)溶液中,初始温度为12 ℃,初始压力为4.4 MPa。由图5可得,反应器中的压力随温度的降低而降低,直到降至-3 ℃后,压力始终保持不变,反应器中并无CO2水合物形成。由图6可以看出,在-2 ℃时合成CO2所需的时间为60 min;由图7可以看出,在-1 ℃时合成CO2所需的时间为95 min。根据以上实验现象可知,合成温度越高,CO2水合物越难以形成。在受限于反应溶液冰点约束的前提下,由实验结果可得,当小于-2 ℃时,初始压力降至3.719 MPa后保持不变,很难再形成CO2水合物,其原因可能是当温度在-3 ℃时,套管式换热器中SDS溶液开始形成冰,阻塞管道,使得管道内压力始终保持不变。由此可得,-2 ℃为0.5%的SDS溶液中CO2水合物的最佳合成温度。


2.3 分解温度对CO2水合物分解速率的影响
在不结冰的情况下,-2 ℃时CO2水合物的合成时间最短,大约在50~60 min之间。因此,为达到水合物合成与分解连续循环的目的,必须尽量使得分解速率与合成速率相互接近,且应满足在该分解温度下能得到所需的压力,如图8所示。
由实验结果发现,不同的分解温度,对CO2水合物分解速率存在很大的影响。当分解温度为8 ℃,压力增加到一稳定值所需的时间为50 min,且其最终压力为4.1 MPa左右,无法达到4.4 MPa的实验要求;当分解温度为10 ℃,压力增加到一稳定值所需的时间为30 min,当背压阀设定为4.4 MPa后,其最终压力可保持在4.4 MPa;而当分解温度为12 ℃,压力增加到一稳定值所需的时间为20 min,当背压阀设定为4.4 MPa后,其最终压力同样可保持在4.4 MPa。根据实验分析可得,当分解温度为8 ℃时,分解压力为4.1 MPa左右,无法达到设计要求,其原因可能是CO2在8 ℃时的液化压力为4.2 MPa,当将达到此温度时,CO2开始液化,压力随之开始下降,从而无法达到4.4 MPa。而分解温度为10 ℃和12 ℃都能达到设计要求的4.4 MPa,且分解时间都小于-2 ℃合成的时间。因此,均可作为分解温度。但考虑到应用于复叠制冷的低温级,分解温度越低越能提高制冷效率。因此,10 ℃为CO2水合物的最佳分解温度。

2.4 CO2水合物循环增压实验
根据所进行的前期实验,选择合适的添加剂,并且得到了最优的合成与分解的温度。在此基础上得到的循环实验结果如图9所示。

由图9可以看出,在实验第一阶段,当套管式反应器1降温合成时,套管中由于温度降低使压力下降,当温度稳定至-2 ℃时,压力先不变,其为CO2水合物的一部分诱导时间,然后再随之下降。当降至1.4 MPa后,低压气体从低压储气罐中进入,使CO2水合物持续合成,而套管式反应器2中保持高压;当实验进入第二阶段,给套管式反应器1提供热源,使其在10 ℃的温度下开始分解时,套管式反应器2中提供-2 ℃的冷源进行降温合成,如此往复进行,如图9所示,实现了CO2水合物的连续合成与分解的循环增压实验。
3 结 论
(1) 在套管式反应器中,在低压1.4 MPa下,添加剂0.3%(质量分数)SDS溶液要比4%(质量分数)THF溶液更能促进CO2水合物的合成,其合成时间约为60 min,这从另一方面说明,单组分的SDS添加剂可以大大缩短水合物的诱导时间,加快反应速率,单组分的THF对水合物形成速率的影响不大。
(3) 在0.3%SDS溶液中,合成温度-2 ℃,压力1.4 MPa,分解温度10 ℃,所得分解压力为4.4 MPa,在此前提下能很好地实现CO2水合物的循环增压,其循环时间为110~120 min,且分解后的高压CO2气体经冷凝节流后能达到-36 ℃,有利于将其应用于复叠制冷循环中的低温级。
参考文献
[1] 马一太,王景刚,魏东.自然工质在制冷空调领域里的应用分析[J].制冷学报,2002(1):1-5.
[2] Winkler H, Theobald B, Quack H . The extraordinary properties of CO2as secondary refrigerant[C] . The 22nd International Congress of Refrigeration.Beijing, China, August 21-26, 2007.
[3] 徐俊,张军营,潘霞,等.CO2储存技术的研究现状[J].煤炭转化,2005,29(3):80-86.
[4] Yamasaki A, Wakatsuki M, Teng H, et al. A new ocean disposal scenario for anthropogenic CO2:CO2hydrate formation in a submerged crystallizer and its disposal[J]. Energy,2000,25(1):85-96.
[5] Gabitto J, Tsouris C. Dissolution mechanisms of CO2hydrate droplets in deep seawaters[J]. Energy Conversion and Management, 2006,47(5):494-508.
[6] Hideo T, Akihiro Y, Fumio K. Energy consumption estimation for greenhouse gas separation processes by clathrate hydrate formation[J]. Energy, 2004,29(11):1713-1729.
[7] Viete D R, Ranjith P G. The mechanical behaviour of coal with respect to CO2sequestration in deep coal seams[J]. Fuel,2007,86(17-18):2667-2671.
[8] Bi Y H, Guo T W, Zhang L, et al. Experimental study on cool release process of gas-hydrate with additives[J]. Energy and Buildings, 2009,41(1):120-124.
[9] JEF Engineering Co. Manufacturing Method and Apparatus of Gas Hydrate. Jpn Kokai Tokkyo Koho: JP, 323751 A[P]. 2001.
[10] Mitsui Eng Ind Ltd. Method and System for Forming Hydrate. Jpn Kokai Tokkyo Koho: JP, 232301 A[P]. 2005.
[11] 龚果清,刘妮,刘道平,等.SDS和THF对CO2水合物形成的影响[C] //中国制冷学会2007学术年会,2007,810-814.
[12] Ganji H, Manteghian M, Zadeh K S, et al. Effect of different surfactants on methane hydrate formation rate, stability and storage capacity[J]. Fuel, 2007, 86(3):434-441.
[13] Zhong Y, Roger R E. Surfactant elects on gas hydrate formation[J]. Chemical Engineering Science, 2000,55(19):4175-4187.

