模拟荔枝酒体系中儿茶素非酶褐变的研究
万丽,蹇华丽,胡叶,杨幼慧
(华南农业大学食品学院,广东广州 510642)
模拟荔枝酒体系中儿茶素非酶褐变的研究
万丽†,蹇华丽†,胡叶,杨幼慧
(华南农业大学食品学院,广东广州 510642)
【目的】研究4种有机酸、pH、SO2以及金属离子Cu、Fe对荔枝酒贮藏期间非酶氧化褐变的影响.【方法】在模拟荔枝酒体系加速褐变条件下,研究酚类物质儿茶素的变化.【结果和结论】在模拟荔枝酒体系中,酒石酸和金属离子能够加剧非酶褐变的反应过程,其中Fe3+与模拟酒的褐变呈极显著的正相关,Y=0.179X-0.009X2,R2= 0.990.SO2添加量在40 mg/L以上时能在一定程度上延缓非酶褐变的发生,而当pH在3.2~4.0时,调整pH对抑制或延缓褐变效果不明显.
模拟荔枝酒;非酶褐变;儿茶素
1 材料与方法
1.1 仪器
UVmini-1240型分光光度计,HPLC-1525-2414-2487(美国Waters公司),水浴锅,PB-10酸度计等.
1.2 试剂
(+)-儿茶素(质量分数为98%),美国Sigma公司;乙腈(色谱纯),安徽时联;甲酸(色谱纯),天津科密欧;其余试剂均为分析纯试剂,广州化学试剂厂.
1.3 试验方法
1.3.1 模拟酒溶液的配制及加速褐变处理用于配制模拟酒的玻璃瓶及试管等用体积分数为10%的硝酸浸泡16 h,再用去离子水冲洗干净后备用.用去离子水配制乙醇水溶液(体积分数为13%),分别加入SO2、有机酸及金属盐、适量的儿茶素(100 mg/L),用1 mol/L的NaOH调节pH至3.8.将配制好的模拟酒按50%体积密封于螺口试管中,放于(55±0.2)℃水浴锅中避光加热[6].试验周期为8 d,每隔48 h取样,置于4℃条件下冷藏,供后续分析,所有试验均做3组平行.
1.3.2 褐变指数(D420nm)的测定采用分光光度计法:用1 cm比色皿,以蒸馏水为参比,在420 nm波长下,使用分光光度计测定其光密度(D420nm).用光密度的大小直接表示非酶褐变的褐变指数[7].
1.3.3 平均聚合度(mDP)的测定儿茶素作为原花青素类物质的单体之一,褐变后主要以聚合产物的形式存在,其平均聚合度可利用测定出的质量和物质量浓度求出[8],计算公式如下:
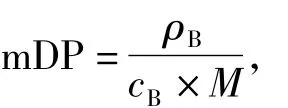
其中:M为儿茶素的摩尔质量(g/mol);ρB为原花青素的质量浓度;cB为原花青素的物质量浓度.质量浓度的测定参考魏冠红[9]的盐酸-香草醛乙醇法,物质量浓度的测定参考Butler等[8]的硫酸-香草醛乙酸法.
1.3.4 HPLC色谱条件参考钟慧臻等[10]的方法略作调整.色谱柱:Purospher STAR LP RP18,4.6 mm× 250 mm,5μm;检测波长:280 nm,440 nm;柱温:35℃;流速:1.0 mL/min;进样量:10 μL;流动相:流动相A为体积分数为100%的乙腈,流动相B为体积分数为0.4%的甲酸水溶液;梯度洗脱程序:0~40 min,5%~25%A;40~45 min,25%~35%A;45~50 min,35%~50%A.
2 结果与分析
2.1 不同有机酸对模拟酒体系非酶褐变的影响
2.1.1 单一有机酸对模拟酒体系非酶褐变的影响
荔枝果肉中主要含有苹果酸、酒石酸、柠檬酸和琥珀酸等,其中苹果酸含量最高[11-14].在荔枝酒酿造过程中,为保证发酵安全,需对荔枝汁进行调酸,同时酵母的代谢也影响着有机酸的含量.为了研究上述4种有机酸对模拟酒褐变的影响,本研究在各模拟酒溶液中分别添加苹果酸、酒石酸、柠檬酸、琥珀酸5 g/L,SO280 mg/L,Fe2+5 mg/L(以FeSO4形式添加),经加速褐变处理,各模拟酒样的褐变指数(D420nm)和mDP变化情况见图1.
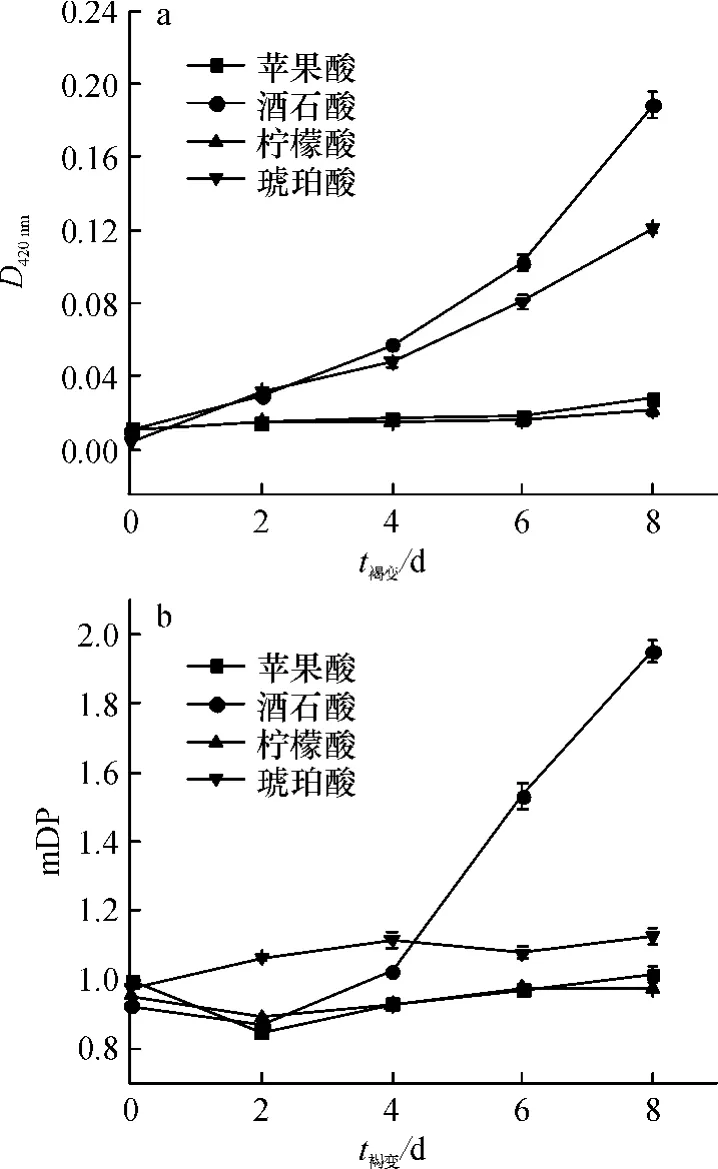
图1 不同有机酸对模拟酒体系D420nm和mDP的影响Fig.1 Effects of organic acids on D420nmand mDP of simulated litchi wine
由图1a可以看出,随着加速褐变时间的延长,添加酒石酸和琥珀酸的模拟酒的D420nm增加较快,而添加苹果酸和柠檬酸的模拟酒的D420nm变化不明显,在加速褐变第8天,添加酒石酸、琥珀酸模拟酒的D420nm与添加苹果酸、柠檬酸的D420nm差异达极显著(P<0.01);图1b表明:添加酒石酸的模拟酒的mDP显著增大,与其余组差异达显著水平(P<0.05),剩余几组的mDP在加速褐变试验过程中变化较小.
2.1.2 不同酒石酸与柠檬酸比例对模拟酒体系非酶褐变的影响分别配制含酒石酸(5 g/L)、柠檬酸(5 g/L)的模拟酒溶液,按1∶0、0∶1、1∶1、1∶2、2∶1、1∶3、3∶1的体积比混合,经加速褐变处理后,其D420nm和mDP变化情况见图2.
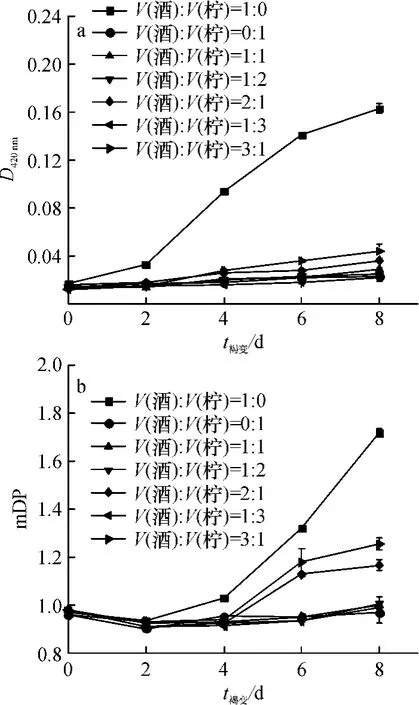
图2 酒石酸与柠檬酸的比例对模拟酒体系D420nm和mDP的影响Fig.2 Effects of different proportions of tartaric acid and citric acid on D420nmand mDP of simulated litchi wine
由图2可知,随着加速褐变时间的延长,不同酒石酸与柠檬酸配比的模拟酒其D420nm和mDP差异明显.在加速褐变第8天,只添加酒石酸的组别与其余组D420nm和mDP差异极显著(P<0.01),而随着酒石酸含量降低,D420nm和mDP的增幅也趋缓.这表明酒石酸的含量对儿茶素的氧化褐变有较大的影响,在一定范围内,酒石酸含量越高,褐变程度越严重.
2.2 不同pH对模拟酒体系非酶褐变的影响
考虑到荔枝酒生产过程中涉及的pH区间范围,模拟酒添加酒石酸5 g/L、SO280 mg/L、Fe2+3 mg/L后,用1 mol/L的NaOH调节pH分别至3.2、3.5、3.8和4.0,经加速褐变处理,其D420nm和mDP变化情况见图3.

图3 不同pH对模拟酒体系D420nm和mDP的影响Fig.3 Effects of pH on D420nmand mDP of simulated litchi wine
随着加速褐变时间的延长,不同pH的模拟酒D420nm和mDP虽不断增加(图3),但不同水平间差异不显著(P>0.05),说明在pH 3.2~4.0间,通过调整pH并不能达到抑制或延缓褐变的目的.
2.3 不同SO2添加量对模拟酒体系非酶褐变的影响
在各模拟酒溶液中添加酒石酸5 g/L、Fe2+3 mg/L,再分别添加SO240、80、120 mg/L,以未添加SO2为对照(CK),经加速褐变处理,其D420nm和mDP变化情况见图4.
由图4可知,在加速褐变的前期,未添加SO2的对照组其D420nm显著高于其余组(P<0.05);随着加速褐变的时间延长,到褐变的第8天添加SO280和120 mg/L的模拟酒D420nm显著高于40 mg/L和对照组(P<0.05),且80 mg/L添加量的D420nm最高;mDP的变化虽不如D420nm明显,但也有类似变化趋势.说明在褐变前期SO2能有效地抑制褐变反应,而在后期可能与SO2在褐变过程中参与的氧化还原反应相关:在SO2含量极低的时候,从Fe2+到Fe3+的氧化可能不够充分,从而限制了酚类物质的金属催化氧化的过程;SO2适量时一方面氧化金属离子,另一方面会提高酒中酚类对氧的消耗,加剧酚类的氧化褐变[15];而当SO2足够多时,可部分抑制酚类物质的氧化[16].
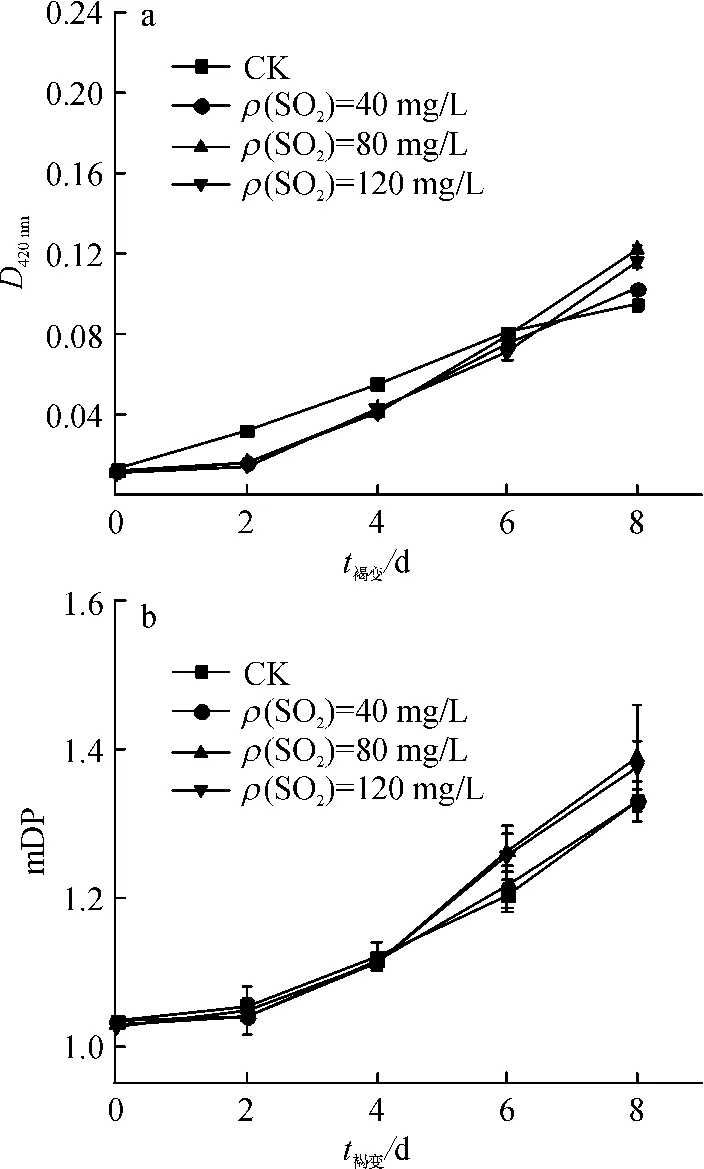
图4 不同SO2添加量对模拟酒体系D420nm和mDP的影响Fig.4 Effects of SO2on D420nmand mDP of simulated litchi wine
2.4 金属离子对模拟酒体系非酶褐变的影响
2.4.1 不同金属离子对模拟酒体系非酶褐变的影响在各模拟酒溶液中添加酒石酸5 g/L、SO280 mg/L,再分别添加Fe2+、Fe3+、Cu2+3 mg/L(以FeSO4、FeCl3、CuSO4形式添加),以未添加金属离子为对照(CK),经加速褐变处理其D420nm和mDP变化情况见图5.
如图5所示,所有添加了金属离子的试验组的褐变情况均显著高于对照组(P<0.05);其中Fe3+对褐变的影响最为突出,达极显著水平(P<0.01),而添加Fe2+和Cu2+模拟酒的褐变较添加Fe3+的酒轻微,两者之间无显著差异(P>0.05).说明金属离子的催化对于酚类的褐变起到了至关重要的作用,其中Fe3+催化效率最高.
2.4.2 不同Fe3+质量浓度对模拟酒体系非酶褐变的影响为进一步探讨Fe3+的影响,在各模拟酒溶液中分别添加Fe3+0、0.2、1.0、3.0、5.0、10.0 mg/L,经加速褐变处理8 d后其D420nm和mDP变化情况见图6.

图5 不同金属离子对模拟酒体系D420nm和mDP的影响Fig.5 Effects of different metal ions on D450nmand mDP of simulated litchi wine
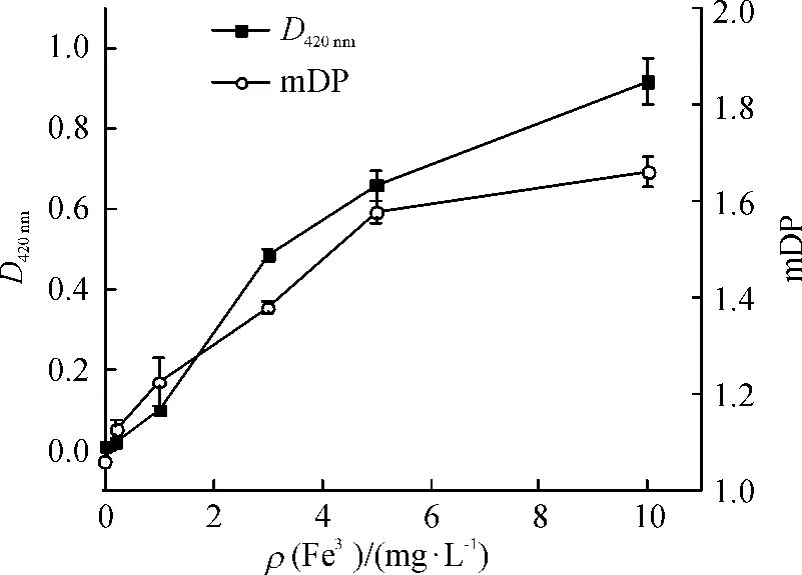
图6 不同Fe3+质量浓度对模拟酒体系D420nm和mDP的影响Fig.6 Effects of Fe3+on D420nmand mDP of simulated litchi wine
随着模拟酒中Fe3+质量浓度的增加,D420nm和mDP迅速增大(图6),Fe3+质量浓度与D420nm呈极显著的正相关(P<0.01);以模拟酒D420nm作为Y值,Fe3+质量浓度为X值,经SPSS 17.0对二者进行线性回归分析,两者间线性关系如下:Y=0.179X-0.009X2,R2=0.990.
2.5 模拟酒体系加速褐变处理后HPLC色谱分析
经过紫外可见分光光度计对加速褐变处理前后的模拟酒进行吸收光谱扫描分析,发现经加速褐变的模拟酒吸收波长除在280 nm外,在440 nm处也有较大吸收(图7),而未褐变的模拟酒在此处几乎没有吸收;同时,进行HPLC色谱分析发现模拟酒褐变后在440 nm的HPLC色谱峰比未褐变的模拟酒增加了一些未知峰(图8),其中a~e几个峰形与相关文献中研究结果类似,这些最大吸收波长在440 nm的物质经质谱分析发现为呫吨盐(Xanthylium salts)阳离子类物质[17],该类物质为原花青素单体形成的二聚物,说明该条件下模拟酒体系的褐变主要由儿茶素的氧化聚合反应造成;而其余未知峰因未进行进一步质谱分析难以判定其构成.
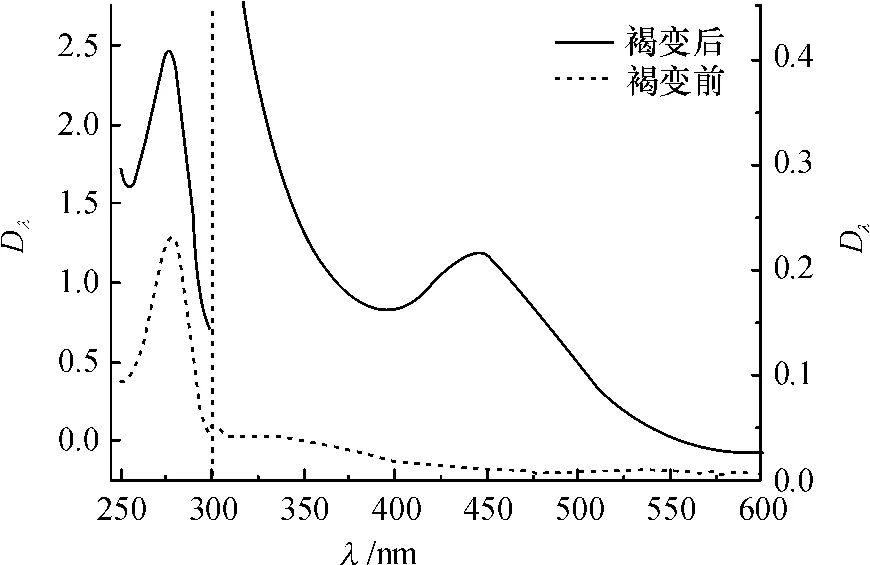
图7 模拟酒褐变前后吸收光谱比较Fig.7 Changes in the absorbance spectra of simulated litchi wine
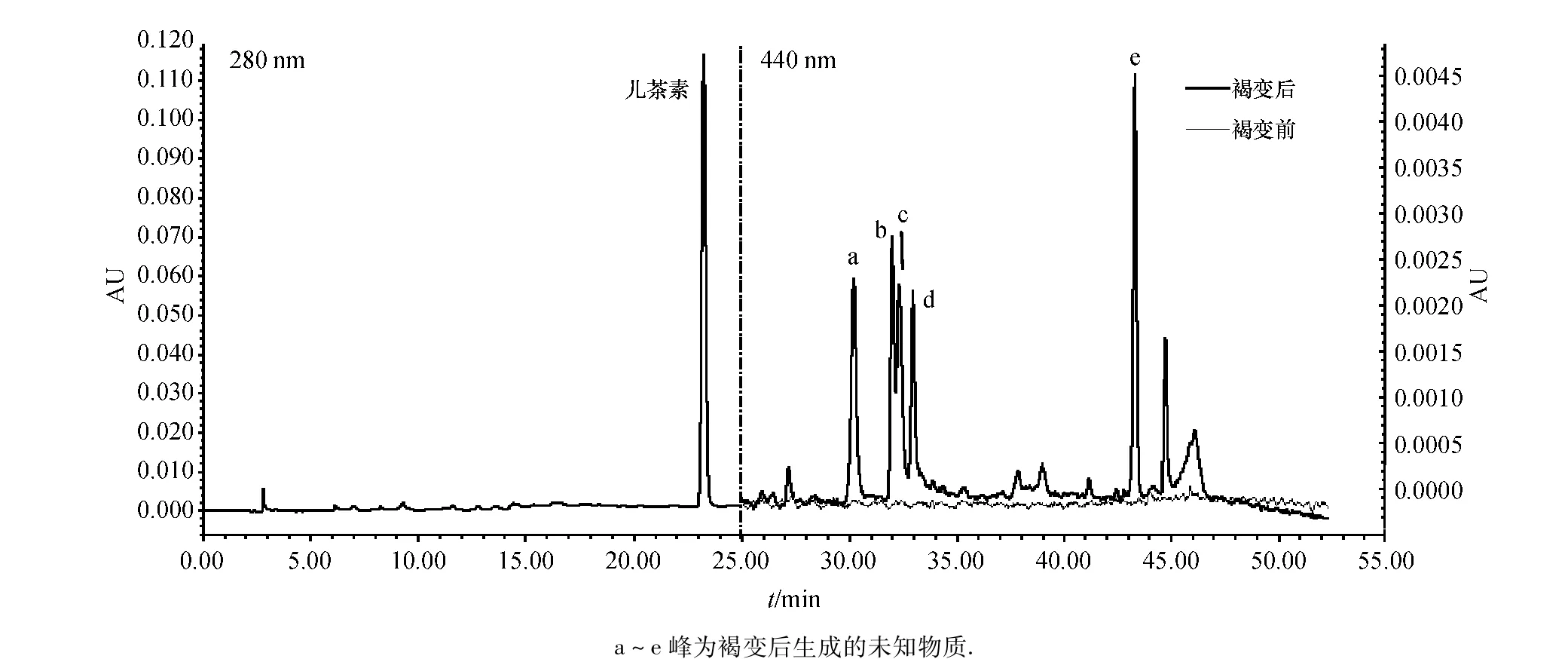
图8 模拟酒加速褐变前后HPLC色谱图Fig.8 The HPLC chromatogram of controlled and browned simulated litchi wine
3 讨论与结论
不同有机酸对模拟荔枝酒中儿茶素非酶褐变的影响有较大的差异,其中酒石酸对酚类的氧化褐变有较大的影响;SO2与酚类的氧化褐变存在先抑制后促进的关系;Fe、Cu等金属离子对非酶褐变有催化作用,其中Fe3+离子的催化作用最强,且催化褐变的程度与其含量呈显著的正相关.Merida等[18]研究认为,引起这一现象的原因可能是酒石酸在金属离子的催化作用下分解为乙醛酸,而乙醛酸在酚类聚合反应的过程中可作为黄烷-3-醇类物质之间的桥接,加剧聚合反应的进程.相关研究证实,Fe3+可催化酚类物质氧化生成醌类和H2O2,而H2O2可进一步催化低价态金属离子转化为高价态,并产生羟基自由基,其作为强氧化剂可进一步加剧整个体系中的氧化褐变反应[19-20].经HPLC色谱分析褐变后物质也初步推断,该条件下模拟酒体系的褐变主要由儿茶素的氧化聚合反应造成.
在荔枝酒生产中,可从选择酒石酸含量低的荔枝、控制荔枝酒中SO2添加量及金属离子几方面考虑工艺措施,以减少荔枝酒贮藏过程中非酶褐变的发生.
[1]陈坚生,杨幼慧,蹇华丽,等.荔枝酒贮藏过程中非酶褐变的因子解析[J].食品与发酵工业,2010,36(6):20-25.
[2]FERNANDEZ-ZURBANO P,FERREIRA V,ESCUDERO A,et al.Role of hydroxycinnamic acids and flavanols in the oxidation and browning of white wines[J].J Agric Food Chem,1998,46(12):4937-4944.
[3]OLIVEIRA C M,FERREIRA A C S,DE FREITAS V,et al.Oxidation mechanisms occurring in wines[J].Food Res Int,2011,44(5):1115-1126.
[4]李学伟.酚类物质对荔枝酒非酶褐变影响研究[D].广州:华南农业大学,2010.
[5]丁娟.荔枝酒瓶贮期间褐变的控制研究[D].广州:华南农业大学,2011.
[6]SIOUMIS N,KALLITHRAKA S,MAKRIS D P,et al.Kinetics of browning onset in white wines:Influence of principal redox-active polyphenols and impact on the reducing capacity[J].Food Chem,2006,94(1):98-104.
[7]SINGLETON V L,KRAMLINGA T E.Browning of white wines and an accelerated test for browning capacity[J].Am J Enol Vitic,1976,27(4):157-160.
[8]BUTLER L G,PRICE M L,BROTHERTON J E.Vanillin assay for proanthocyanidins(condensed tannins):Modification of the solvent for estimation of the degree of polymerization[J].J Agric Food Chem,1982,30(6):1087-1089.
[9]魏冠红.高聚原花青素的水解工艺研究[D].杭州:浙江大学,2006.
[10]钟慧臻,徐玉娟,李春美,等.高效液相色谱-电喷雾离子阱质谱法测定荔枝果肉中酚类物质[J].广东农业科学,2010,37(4):11-14.
[11]ALVES J A,DE OLIVEIRA L L C,NUNES C A,et al.Chemical,physical-chemical,and sensory characteristics of lychee(Litchi chinensisSonn.)wines[J].J Food Sci,2011,76(5):S330-S336.
[12]贾敏,黄丽,韦保耀,等.荔枝汁产品中有机酸、糖类和游离氨基酸的对比分析[J].食品科技,2010,35 (10):95-99.
[13]黄桂颖,白卫东,杨幼慧,等.反相高效液相色谱法测定荔枝肉中10种有机酸[J].现代食品科技,2009,25 (5):568-570.
[14]刘晓艳,白卫东,蒋爱民,等.荔枝果酒加工过程中有机酸的变化研究[J].中国酿造,2011,236(11):65-69.
[15]MANZOCCO L,MASTROCOLA D,NICOLI M C.Chainbreaking and oxygen scavenging properties of wine as affected by some technological procedures[J].Food Res Int,1998,31(9):673-678.
[16]GALUSKA S,MAKRIS D P,KEFALAS P.Browning development in wine-like liquid model matrices:Dependence on phenolic,Fe(Ⅲ)and SO2concentrations[J].J Food Proc Eng,2010,33(5):934-945.
[17]ES-SAFI N,CHEYNIER V,MOUTOUNET M.Effect of copper on oxidation of(+)-catechin in a model solution system[J].Int J Food Sci Technol,2003,38(2):153-163.
[18]MERIDA J,LOPEZ-TOLEDANO A,MEDINA M.Influence of aerobic and anaerobic conditions and yeasts on the reaction between(+)-catechin and glyoxylic acid[J].Eur Food Res Technol,2006,222(3/4):451-457.
[19]LI Hua,GUO Anque,WANG Hua.Mechanisms of oxidative browning of wine[J].Food Chem,2008,108(1):1-13.
[20]DANILEWICZ J C,WALLBRIDGE P J.Further studies on the mechanism of interaction of polyphenols,oxygen,and sulfite in wine[J].Am J Enol Vitic,2010,61(2):166-175.
【责任编辑李晓卉】
A study of non-enzymatic browning of(+)-catechin in a simulated litchi wine
WAN Li,JIAN Huali,HU Ye,YANG Youhui
(College of Food Science,South China Agricultural University,Guangzhou 510642,China)
【Objective】In order to determine the influence of organic acid,pH,SO2,copper and ferrous ion on non-enzymatic browning of litchi wine during the storage,the browning problem was studied in this paper.【Method】(+)-Catechin was investigated as representative substance in a simulated litchi wine in accelerating browning test.【Result and conclusion】It could be observed that tartaric acid,copper and ferrous iron increased the browning,in which the correlation between Fe3+and browning of simulated litchi wine was significant:Y=0.179X-0.009X2,R2=0.990.The content of SO2above 40 mg/L can delay the oxidation to some extent,while the pH adjusted between 3.2 and 4.0 has no obvious influence.
simulated litchi wine;non-enzymatic browning;(+)-catechin
TS262.7
A
1001-411X(2014)01-0100-06
万丽,蹇华丽,胡叶,等.模拟荔枝酒体系中儿茶素非酶褐变的研究[J].华南农业大学学报,2014,35(1):100-105.
荔枝酒在贮藏过程中极易发生褐变,严重影响色泽和风味,使其感官品质变劣.荔枝酒中的酚类物质是引起荔枝酒褐变的主要底物,包括酶促褐变和非酶褐变.由于荔枝酒酿造期间添加SO2及采用低温发酵,抑制了氧化酶的活性,因而主要表现为非酶褐变[1].近年来研究表明,含有邻羟基结构的酚类物质在非酶氧化过程中特别重要,其中黄烷醇类,特别是黄烷-3-醇类被认为是非酶褐变中最有效的底物,且褐变主要由其聚合反应引起[2-3].李学伟[4]和丁娟[5]的研究表明,黄烷-3-醇类,例如(-)-表儿茶素、原花青素B2等,是引起荔枝酒非酶褐变的重要酚类物质,引起褐变的最主要原因之一可能是黄烷-3-醇类的氧化聚合反应.由于荔枝酒中氧化褐变的反应过程及褐变产物组分复杂,直接研究各类因素对其褐变的影响及褐变机理难度较大[1,4].为探明不同因素对荔枝酒褐变的影响,本试验以引起荔枝酒褐变的主要酚类物质黄烷-3-醇类的代表物质儿茶素为研究对象,采用模拟荔枝酒体系,研究有机酸、SO2、金属离子等因素对其非酶氧化褐变的影响,为控制荔枝酒的褐变提供理论依据.
2013-04-07优先出版时间:2013-11-07
优先出版网址:http:∥www.cnki.net/kcms/detail/44.1110.S.20131107.1500.004.html
万丽(1989—),女,硕士研究生,E-mail:wanli7715@163.com;蹇华丽(1977—),女,讲师,博士,E-mail:hualij@ 163.com;†对本文贡献相同;通信作者:杨幼慧(1956—),女,教授,硕士,E-mail:yhyang@scau.edu.cn
科技部农业科技成果转化资金项目(2012E0002005);现代农业产业技术体系建设专项(CARS-33荔枝龙眼产业技术体系)

