重金属胁迫下外源钛铁试剂对冬珊瑚幼苗根系发育、生物量累积及其分配格局的影响
瞿静,吴楚
(长江大学园艺园林学院,湖北 荆州 434025)
自然界存在的90种元素中,有53种重金属(包括As在内),然而只有少数几种具有生理作用,为植物所必需的微量营养元素,如Cr、Mo和Co,但如果这些元素过量,则对植物产生有害影响。另外一些重金属元素,如Pb、Hg和Cd,它们对植物没有生理作用,而对植物产生有害影响[1-2]。这些影响包括水分关系[3]、光合作用与其他生理特性[4-9]、植物生长发育[10-12]。重金属对植物的有害影响与其引起的氧化胁迫有关[2,13-15]。因此,如何有效及时消除因重金属引起的氧自由基而保护植物,成为植物修复和促进植物生长发育的一个重要途径。
植物细胞含有各种抗氧化剂,如抗坏血酸、谷胱苷肽、α-生育酚以及各种酚类化合物。这些化合物协同抗氧化酶在清除氧自由基减缓氧化胁迫方面起着重要的作用。如果采用外源试剂,则能更好地清除氧自由基。钛铁试剂(Tiron,disodium 1,2-dihydroxybenzene-3,5-disulfonate)是一种水溶性的非毒性的自由基清除剂,可以透过细胞膜而起作用[16]。本研究试图利用钛铁试剂缓解重金属汞对常见栽培花卉冬珊瑚(Solanumpseudocapsicum)产生的有害影响,对其在根系发育和生物量分配方面进行初步研究,以为其在受到重金属污染的土地上恢复植被并促进植物生长发育提供参考。
1 材料与方法
1.1 试验材料培养
冬珊瑚种子采自长江大学植物园。将河沙清洗干净,然后装入塑料盆中(直径15cm,高15cm),将事先催芽的冬珊瑚种子均匀播种于河沙表面,然后以洗净的河沙覆盖。待种子萌发、幼苗长到3片真叶时,移植到装有1.5kg土壤(未经污染的园土)的塑料盆内(直径15cm,高15cm)中,每盆5株幼苗,自然光照培养。
1.2 氯化汞和钛铁试剂处理
将冬珊瑚幼苗移植于温室大棚中,培养20d后,每盆灌入等量的氯化汞溶液(100ml 5g·L-1)。2d后喷洒不同浓度的钛铁试剂:0(T0)、5 (T1)、10 (T2)、20μmol·L-1(T3)。自然条件下培养,每隔5d用0、5、10、20μmol·L-1的钛铁试剂溶液分别进行处理。35d后取样,测定各项指标。
1.3 根系分析
先把冬珊瑚苗木从塑料桶中小心地取出,保持根系完整,从根颈部位将幼苗分成地上和地下两部分,地下部分用水浸泡,洗净冬珊瑚苗木根系上面残留的泥土,使用WinRhizo根系分析系统对根系进行扫描和分析,取得总根长、总表面积、总投影面积、总体积以及根尖数等参数。在75℃下烘至衡重后用分析天平称量。
1.4 异速生长分析
异速生长分析按照吴楚等[17]的方法进行。
lgWr=a+KlgWs
式中,Wr和Ws分别是根干重和地上部分的干重,K为异速生长常数。
1.5 统计分析
利用SPSS V10.0软件进行统计分析,以P<0.05为标准判断各处理之间的差异显著性。
2 结果与分析
2.1 不同钛铁试剂浓度对汞胁迫下冬珊瑚幼苗根系发育的影响
图1 A结果表明,T1处理下,冬珊瑚幼苗根系根长比对照T0增加,差异性不显著(P>0.05,LSD);从T2至T3,冬珊瑚幼苗根系根长逐渐下降,但只有T0与T3之间存在显著差异(P<0.05,LSD)。总表面积和总投影面积的变化趋势与总根长度的变化趋势相似(图1B)。不同钛铁试剂浓度对汞胁迫下冬珊瑚幼苗根系总体积具有很重大的影响。总体上,根系体积随钛铁试剂处理浓度增加而增加
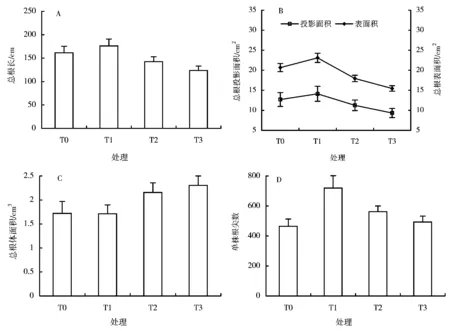
图1 汞胁迫下钛铁试剂对冬珊瑚幼苗根系形态参数的影响
(图1C)。T0、T12种浓度处理之间无显著差异,但它们与T3之间存在显著差异(P<0.05,LSD)。同时,T2处理与T3处理差异显著(P<0.05,LSD)。
不同钛铁试剂浓度对汞胁迫下冬珊瑚幼苗根系根尖数具有较大的影响。T1处理下,冬珊瑚幼苗根系根尖数显著多于对照T0(P<0.05,LSD,图1D);随着外加钛铁试剂浓度的升高,根系根尖数随着浓度的增加而减少。在T2或T3处理下,冬珊瑚幼苗根系根尖数比T0增加,差异性不显著(P>0.05,LSD);整个根系的根尖数量在T1时达到最大,与其他几种处理存在显著差异。
2.2 不同钛铁试剂浓度对汞胁迫下冬珊瑚幼苗生物量累积和异速生长的影响
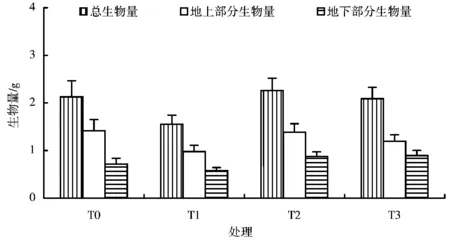
图2 汞胁迫下钛铁试剂对冬珊瑚幼苗生物量累积的影响
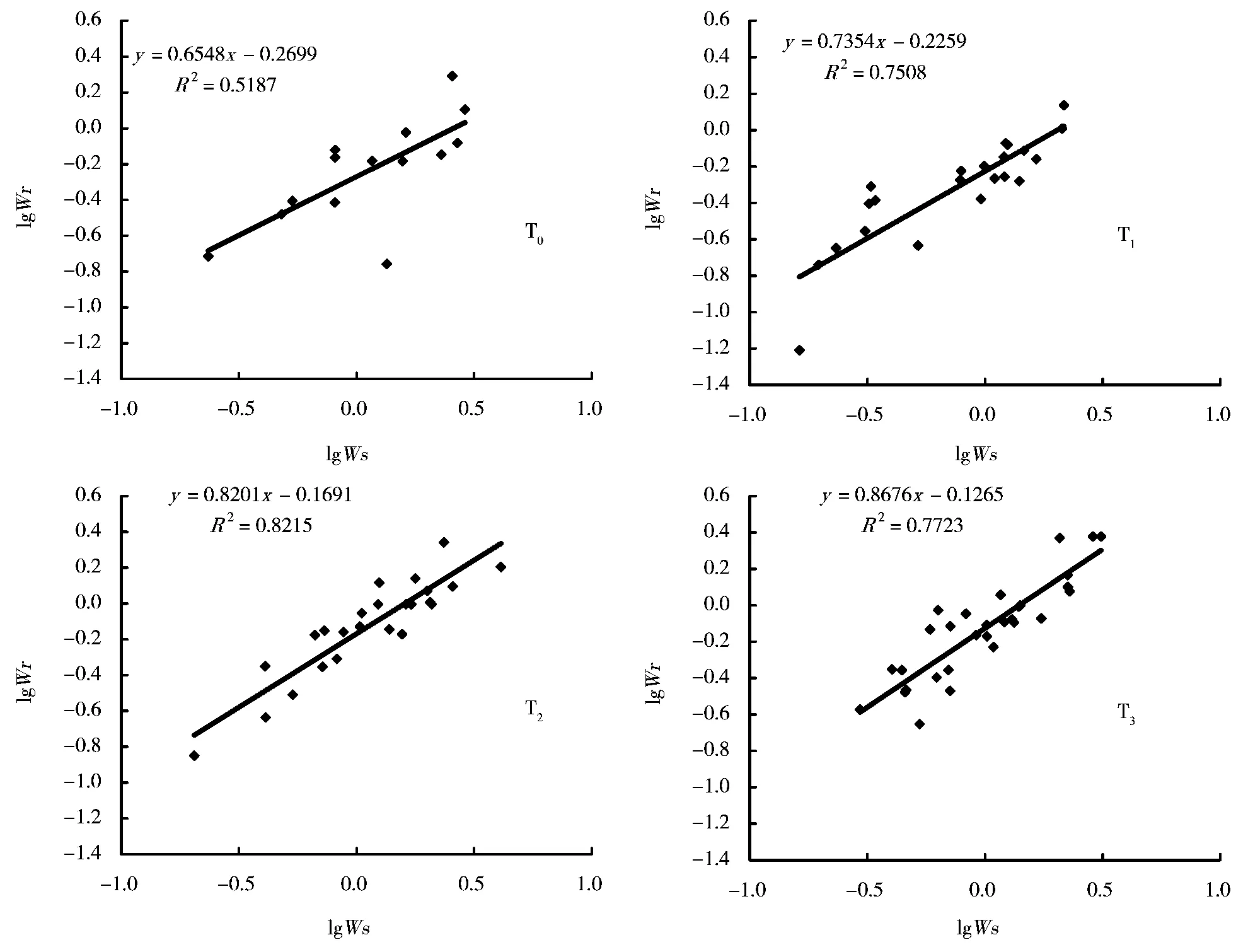
图3 汞胁迫下钛铁试剂对冬珊瑚幼苗生物量分配格局的影响
钛铁试剂处理对冬珊瑚幼苗总生物量的累积以及地上部分和地下部分生物量没有显著的影响(图2)。不同钛铁试剂浓度对汞胁迫下冬珊瑚幼苗异速生长具有影响(图3)。异速生长分析建立在根系生物量(Wr)和地上部分生物量(Ws)的对数之间的直线关系的基础上,其直线关系的斜率即为异速生长指数。从图3可以看出,无论钛铁试剂的处理浓度如何,异速生长指数都小于1,这表明在冬珊瑚幼苗阶段,生长偏向于地上部分,因此,这种生长特性引起生物量分配偏向于地上分配。随着外加钛铁试剂浓度的升高,异速生长指数随着浓度的增加而增大,这表明随着外源钛铁试剂的浓度增加,植物生物量的分配越向地下分配。
3 讨论与结论
3.1 讨论
3.1.1 钛铁试剂对汞胁迫下冬珊瑚幼苗根系的影响
汞是一种植物非必需元素,在植物体内积累到一定程度,可能对植物造成毒害[18-19]。汞是环境中的有毒重金属,能够影响植物细胞的正常分裂,导致膜脂过氧化水平提高,细胞超微结构发生变化,抑制植物的生长发育,对植物具有明显的毒害作用[20-22]。本研究中,5g·L-1的汞添加量对冬珊瑚幼苗的生长产生了毒害作用。
钛铁试剂是一种高效无毒的膜渗透性外源自由基清除剂[16],能透过细胞膜,可以清除细胞内的自由基。适当与适量的钛铁试剂能提高植物抗重金属污染胁迫的能力。植物的根是植物长期适应陆上生活而发展起来的一种向下生长的器官。植物通过根系和外界土壤中的物质进行交流。根系是植物吸收养分的主要器官,根的活力水平直接影响地上部分的生长和营养状况及产量水平,外源重金属进入土壤后,根是植物体中最重要的结合重金属的部位,也是最易受重金属毒性影响的部位。重金属能抑制根尖细胞核的分裂,根长的变化是一个重要的指示植物受重金属毒性影响的指标[23]。本研究中,加入5μmol·L-1钛铁试剂后,冬珊瑚幼苗总根长、总投影面积、总表面积增加,并达到最大值,说明5μmol·L-1的钛铁试剂可以在一定程度上缓解Hg对冬珊瑚幼苗造成的毒害。钛铁试剂和汞的联合作用可以缓解重金属汞对冬珊瑚幼苗根系的伤害。这种缓解作用随着外加钛铁试剂浓度的升高而呈现逐渐减弱的趋势,高浓度钛铁反而使冬珊瑚幼苗总根长、总投影面积、总表面积和根尖数下降,可能是高浓度钛铁试剂对植物产生了毒害作用。该结果与袁宇飞等[24]用锌处理汞胁迫下小麦幼苗的研究结果类似。
3.1.2 钛铁试剂对汞胁迫下冬珊瑚幼苗异速生长的影响
无论钛铁试剂的处理浓度如何,冬珊瑚幼苗的根系的异速生长指数都小于1(图3),这表明冬珊瑚在幼苗期间,生物量的分配都倾向于地上部分。随着外加钛铁浓度的升高,异速生长指数K随着浓度的增加而增大。由此可知,钛铁试剂对汞胁迫下的冬珊瑚幼苗生物量分配格局产生了重大作用。这可能与植物根系对汞胁迫的反应有关,而植物对汞胁迫的反应与植物生长素的再分配有关。因此,在外加钛铁试剂的条件下,汞胁迫下的冬珊瑚幼苗根系发育受到生长素再分配的影响较大,从而导致生物量向地上部分的分配超过了向地下部分的分配。
3.2 结论
0~5μmol·L-1Tiron可以在一定程度上缓解汞对冬珊瑚幼苗造成的毒害,因此,对于单一重金属汞污染,可以通过适当调节钛铁试剂的加入水平来提高修复汞污染的效率。但是高浓度的钛铁试剂会对植物产生毒害。
[参考文献]
[1]Hall J L.Cellular mechanisms for heavy metal detoxification and tolerance [J].J Exp Bot,2002,53:1-11.
[2]Schützendübel A,Polle A.Plant responses to abiotic stresses:heavy metal-induced oxidative stress and protection by mycorrhization [J].J Exp Bot,2002,53:1351-1365.
[3]Barcelóa J,Poschenriedera C.Plant water relations as affected by heavy metal stress:A review [J].J Plant Nutrition,1990,13:1-37.
[4]Clijsters H,Van Assche F.Inhibition of photosynthesis by heavy metals [J].Photosynthesis Research,1985,7:31-40.
[5]Prasad M N V,Strzalka K.Impact of heavy metals on photosynthesis [A].Prasad M N V,Hagemeyer J.Heavy Metal Stress in Plants:from Molecules to Ecosystems [C].Berlin Heidelberg :Springer,1999:117-138.
[7]Kranteva A,Yordanova R,Janda T,et al.Treatment with salicylic acid decreases the effect of cadmium on photosynthesis in maize plants [J].J Plant Physiol,2008,165:920-931.
[8]金美芳,周杨,卢瑛,等.镉胁迫对油菜根系生理特性的影响 [J].江西农业大学学报,2012,34(4) :664-670.
[9]曹毅,陆宁,孟建玉,等.汞胁迫对烤烟生理特性的影响 [J].西南农业学报,2011,24(6):52-54.
[10]Schwartz C,Morel J L,Saumier S,et al.Root development of the Zinc-hyperaccumulator plantThlaspicaerulescensas affected by metal origin,content and localization in soil [J].Plant Soil,1999,208:103-115.
[11]马成仓,洪法水.汞对小麦种子萌发和幼苗生长作用机制初探[ J]植物生态学报,1998,22(4):373-378.
[12]John R,Ahmad P,Gadgil K,et al.Heavy metal toxicity:effect on plant growth,biochemical parameters and metal accumulation byBrassicajunceaL [J].International Journal of Plant Production,2009,3:65-76.
[13]Gallego S M,Benavides M P,Tomaro M L.Effect of heavy metal ion excess on sunflower leaves:evidence for involvement of oxidative stress [J].Plant Science,1996,121:151-159.
[14]Zhang F-Q,Wang Y-S,Lou Z-P,et al.Effect of heavy metal stress on antioxidative enzymes and lipid peroxidation in leaves and roots of two mangrove plant seedlings (KandeliacandelandBruguieragymnorrhiza) [J].Chemosphere,2007,67:44-50.
[15]Lopez-Climent M F,Arbona V,Perez-Clemente R M,et al.Effect of cadmium and calcium treatments on phytochelatin and glutathione levels in citrus plants [J].Plant Biol,2014,16:79-87.
[16]Akita M,Ohta Y.The effect of Tiron,a water soluble radical scavenger,on growth,morphology and alkaloid content of adventitious roots inAtropabelladonna[J].Plant Cell Reports,2000,19:705-709.
[17]吴楚,范志强,王政权.磷胁迫对水曲柳幼苗叶绿素合成、光合作用和生物量分配格局的影响[ J ].应用生态学报,2004,15(6):935-940.
[18]Pralta J R,Gardea-Torresdey J L,Tiemann K J,et al.Study of the effects of heavy metals on seed germination and plant growth on alfalfa plant (Medicagosativa) grown in solid medial[A].Proceedings of the 2000 Conference on Hazardous Waste Research[C].Denver,CO,USA,2000,135-140.
[19]张志杰,吴秋芳,方芳.汞对小麦幼苗生长发育和生理功能的影响[J].环境科学,1989,10 (4):10-13.
[20]刘建新.Hg2+对豌豆幼苗生长和生理代谢的影响[J].宁夏大学学报( 自然科学版),2005,26(1):67-70.
[21]高大翔,郝建朝,李子芳,等. 汞胁迫对水稻生长及幼苗生理生化的影响[J].农业环境科学学报,2008,27(1) :58-61.
[22]袁彦婷,丁振华,张玲.汞胁迫对白骨壤(Avicenniamarina) 幼苗生理生态的影响[J].生态学杂志,2011,30(5):1013-1017.
[23]李锋民,熊治廷,王 狄,等.铜铁铅单一及复合污染对铜草幼苗生长的影响[J].农业环境保护,2001,20(2) :71-73.
[24]袁宇飞,韩晓梅,李光德,等.锌对汞胁迫下小麦幼苗生理特性的影响[J].应用与环境生物学报,2012,18(2) :212-217.

