左乙拉西坦治疗低龄难治性癫痫患儿临床研究
舒志刚 卫 国
湖北鄂州市中心医院神经内科 鄂州 436000
左乙拉西坦治疗低龄难治性癫痫患儿临床研究
舒志刚 卫 国△
湖北鄂州市中心医院神经内科 鄂州 436000
目的 探讨左乙拉西坦治疗低龄难治性癫痫患儿的疗效及安全性。方法 纳入我科2008-01-2013-01收治的≤5岁难治性癫痫患儿,随机均分为实验组与对照组,实验组口服左乙拉西坦,对照组口服卡马西平,评价2组患者治疗13周与26周的疗效以及治疗前后的实验室检查结果、不良反应。结果 用药26周后实验组有效率高于对照组、不良反应发生率低于对照组,差异有统计学意义(P<0.05),各项实验室检查结果比较差异无统计学意义(P>0.05)。结论 左乙拉西坦治疗低龄难治性癫痫患儿的疗效显著,安全性好,值得临床推广。
左乙拉西坦;难治性癫痫;低龄患儿;安全性
儿童癫痫发病率约为成人10倍,其中近30%患儿经抗癫痫药治疗后,在有效治疗期内难以终止其发作的,形成难治性癫痫(intractable epilepsy, IE)[1]。美国美国国立卫生研究院(National Institutes of Health, NIH)将IE定义为“对于已经确诊为癫痫的患儿,应用正规的抗癫痫药物(2种及以上),经6~12个月合理治疗后发作次数仍未能减少50%者”。IE严重危害着患儿的身心健康,传统抗癫痫药物疗效不甚确切、药物相互作用较多,且对于儿童不良反应较大,难以耐受[2];若行手术治疗又受限于难以对病灶明确定位,损伤性较大,不被患儿家属所接受[3],临床应用明显受限。因此,寻求积极有效控制IE发作的治疗手段成为当前临床研究的难点。
左乙拉西坦(levetiracetam, LEV)属于吡咯烷酮衍生物,是一种新近应用于临床的抗癫痫药物。于2000年经由美国食品和药物管理局(Food and Drug Administration, FDA)批准上市,起初用于16岁以上患儿部分性癫痫发作的添加治疗,该组织又于2005年将适应证扩大到5岁以上儿童癫痫部分性发作、全面强直-阵挛发作的治疗[4]。但该药对于儿童IE,尤其是低龄儿童的的应用尚缺乏足够临床经验[5]。我科近年来以卡马西平(carbamazepine, CBZ)为对照组,应用LEV单药治疗低龄IE患儿,取得不错疗效,现将具体情况汇总如下,并为下阶段的大样本、多中心、前瞻性研究提供初步理论依据。
1 资料和方法
1.1 研究对象 纳入我科2008-01-2013-01收治的≤5岁IE患儿,平均年龄(3.41±1.09)岁,平均病程(0.89±0.21) a;共48例,男31例,女17例。经由我院药理、伦理委员会批准,征求患儿监护人知情同意后,采用信封抽签方式随机均分为实验组和对照组。
实验组选用左乙拉西坦,起始剂量10 mg/(kg·d),bid,po,每周递增5~10 mg/(kg·d),直至目标剂30~40 mg/(kg·d),bid。对照组选用卡马西平,起始剂量5 mg/(kg·d),bid,po,每周递增5~10 mg/(kg·d),直至目标剂20~30 mg/(kg·d),bid。研究期间,1例患儿因经济原因(对照组),1例患儿对疗效不满意(实验组)退出治疗,最终46例患儿完成全程研究,进行统计分析。
1.2 排除标准 中枢神经系统实质性病变;颅内肿瘤;对常见抗癫痫药物过敏,如托吡酯、拉莫三嗪、卡马西平、左乙拉西坦等;合并严重器质性心脏病变;凝血功能异常及甲状腺功能异常;严重肝肾功能不全;无法坚持长期随访。
1.3 评价标准 结合长程动态脑电图检查,对比2组患儿治疗13周与26周的发作频率:以发作频率减少50%为界,分为有效组与无效组。其中未见明显发作为完全有效、发作频率减少≥75%为显效,发作频率减少50%~75%为疗效尚可,发作频率减少≤50%为疗效欠佳,发作频率增加≥25%为恶化。患儿接受治疗前及治疗26周时分别检验血常规、电解质、肾功能、肝功能,观察有无明显改变。详细记录2组患儿发生的不良反应,如有退出治疗则分析其原因。
1.4 统计学分析 采用SPSS 18.0统计软件包进行统计学分析。计量资料采用独立样本t检验,结果以均数±标准差表示;计数资料采用χ2检验,结果以率和构成比表示;以P<0.05为差异有统计学意义。
2 结果
2.1 疗效 经治疗13周后实验组有效14例,对照组有效16例,2组比较差异无统计学意义,除对照组显效明显多于实验组之外(P<0.05),其余患儿差异均无统计学意义(表1)。治疗26周后实验组有效15例,对照组20例,对照组有效明显多于对照组,无效明显低于实验组,差异具有统计学意义(P均<0.05),其中对照组患儿显效明显增加(P<0.05),疗效欠佳患儿明显减少(P<0.05),其余患儿差异无统计学意义(表2)。
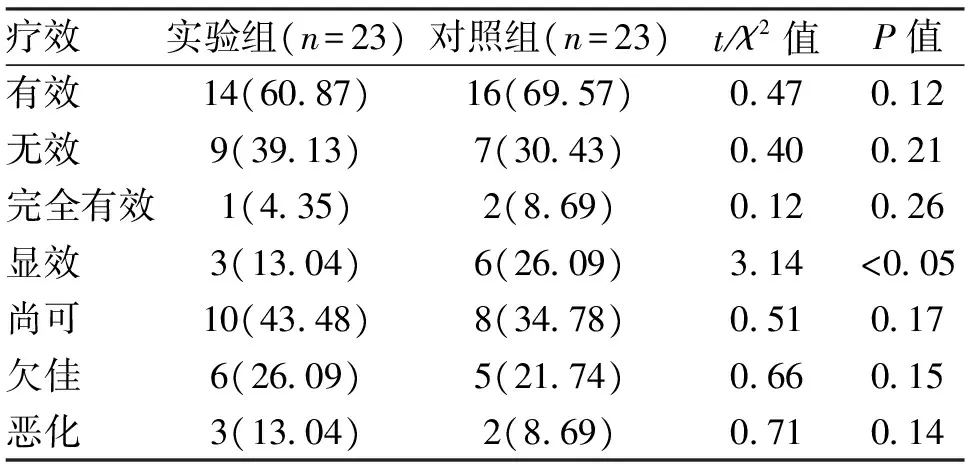
表1 2组患儿经治疗13周后疗效对比 [n(%)]
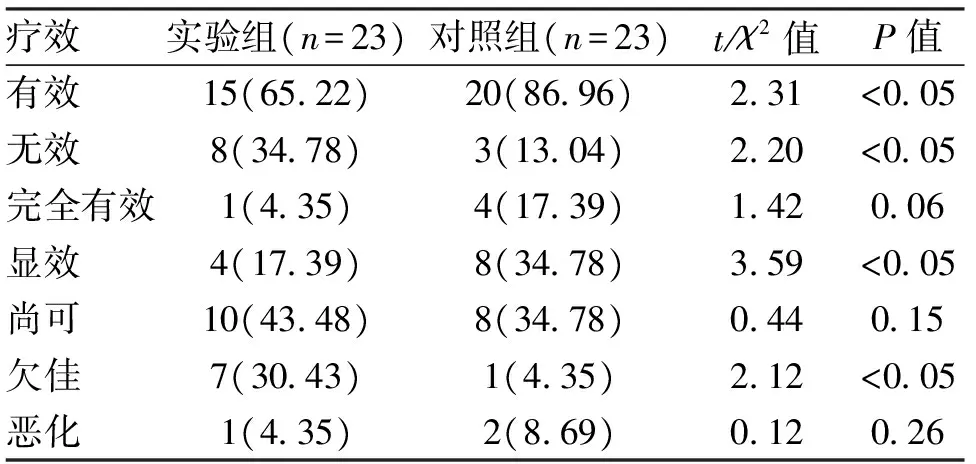
表2 2组患儿经治疗26周后疗效对比 [n(%)]
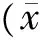
表3 2组患儿接受治疗前实验室检查结果对比±s)
2.2 安全性
2.2.1 实验室检查结果对比:2组患儿于接受治疗前及26周时分别检验血常规、电解质、肝功能、肾功能,因版面所限只列取主要指标:红细胞计数(WBC)、白细胞计数(RBC)、血小板计数(PLT)、血清钾离子(K+)、血清钠离子(Na+)、血肌酐(Scr)、尿素氮(BUN)、天门冬氨酸氨基转移酶(AST)、丙氨酸转氨酶(ALT),所有患儿指标比对均未见明显差异(表3~4)。此外实验组2例患儿于治疗前中性粒细胞百分比明显高于其他患儿,经抗炎治疗于1周后复查恢复正常;对照组1例患儿于治疗前γ-谷氨酰转移酶(γ-GT)轻度偏高,请消化内科会诊后行对症支持治疗,于2周后复查恢复正常。
2.2.2 不良反应对比:实验组3例出现不良反应:嗜睡1例(药物减量后症状缓解),皮疹1例(暂停用药2周并行皮肤科对症处理后症状缓解),恶心1例(坚持用药2日后症状缓解);对照组8例出现不良反应:一过性窦性心动过速1例(镇静吸氧药物减量后症状缓解),发热1例(对症处理后症状缓解),畏寒伴腹痛1例(对症处理并停药1周后症状缓解),烦躁2例(坚持用药1周未见缓解,停药2周后自行缓解),皮疹3例(暂停用药2周并行皮肤科对症处理后症状缓解)。2组患儿不良反应细节不相同,无法直接对比,但实验组总不良反应发生率明显低于对照组,差异有统计学意义(P<0.05) 。见表5。
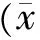
表4 2组患儿接受治疗26周时实验室检查结果对比±s)
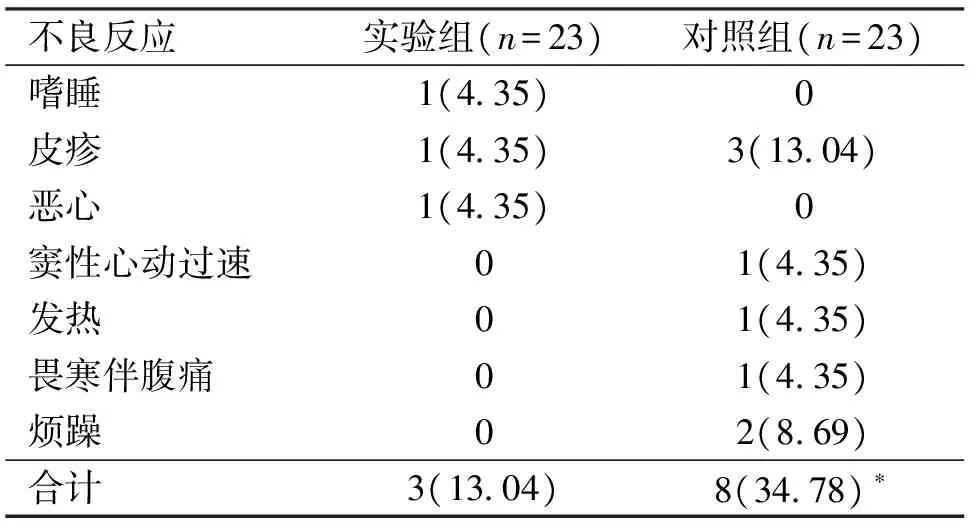
表5 2组患儿不良反应对比
与实验组对比,*P<0.05
3 讨论
低龄患儿沟通困难、表述障碍,不便于观察病情,易于漏诊,而IE患儿的家长对疗效要求迫切,一旦药物出现不良反应则表现的极为敏感,依从性差[6]。LEV具备治疗IE患儿药物所必须的多重优势:可迅速达到稳定血药浓度(血药浓度达峰值时间为1.5~5 h)[7]、呈线性药动学曲线、生物利用度接极高(接近95%)[8]、蛋白结合率低、氧化代谢率低、低神经毒性、无肝肾毒性[9]、无需监测血药浓度、与大部分抗癫痫药物均无药性干扰[10]。与传统抗癫痫药物机制不同,LEV具有独特的治疗机制:(1)LEV通过与中枢神经的突触囊泡蛋白结合,调控突触囊泡内神经递质释放,从而抑制神经元异常放电[11]。(2)LEV不仅能控制杏仁核点燃惊厥发作,而且能显著缩短点燃后放电时间[12],从而有效发挥抗癫痫作用。(3)LEV可抑制海马脑片CAI区锥体神经元高电压激活的N-型钙通道,虽不直接作用于γ-氨基丁酸(GABA)受体,但通过解除负性变构抑制剂对GABA能和甘氨酸能神经元的抑制[4],间接增强中枢抑制作用。(4)LEV可阻断大脑皮质GABA受体下调,并将已下调的受体留滞于海马回[13],以进一步增强GABA对神经元回路的抑制作用。
CBZ是最为常用的经典抗癫痫药,长时间以来被视为部分性发作癫痫、继发性全面性发作癫痫的首要治疗选择,因此常选择该药昨晚抗癫痫药物的临床对照,以判定其疗效及安全性[14]。本次研究选择CBZ作为LEV的临床对照,发现用药13周后,2组患儿的疗效尚未见明显差异,随着疗程延长,接受LEV治疗的患儿有效率明显增加。本次研究前后实验室检查结果均未见显著的临床指标异常变化,说明该药安全性较好。本研究使用LEV治疗的患儿总不良反应发生率明显更低,未出现共济失调、恶性心律失常、视物模糊等较为严重的不良反应。此外仅有2例患儿退出治疗,这也进一步验证了患儿对该药良好的耐受性,用药的依从性好,乐于被家长接受。但由于纳入患儿的年龄普遍偏小,部分患儿无法清晰表达自己主观感受,且本研究样本量偏少,结果真实性可能产生一定偏移,需要在后续研究中扩大样本总量进一步观察。
综上所述,LEV使用便捷、药效平稳、依从性良好、耐受性佳,对IE的疗效确切,故左乙拉西坦可作为低龄患儿难治性癫痫的一线用药,值得临床推广。
[1] Peake D, Mordekar S, Gosalakkal J, et al. Retention rate of Levetiracetam in children with intractable epilepsy at 1 year[J].Seizure,2007,4(16):185-189.
[2] Otoul C, von Rosenstiel P, Stockis A, et al. Evaluation of the pharmacokinetic interaction of brivaracetam on other antiepileptic drugs in adults with partial onset seizures[J].Epliepsia, 2007,48(6):334-335.
[3] 刘仕勇, 安宁, 杨辉, 等. 儿童难治性癫痫的外科治疗[J].中国神经外科杂志, 2009,25(5):399-402.
[4] Carunchio I, Pieri M, Ciotti MT, et al. Modulation of AMPA receptors in cultured cortical neurons induced by the antiepileptic drug levetiracetam[J].Epilepsia,2007,48(4):654-662.
[5] Lee YJ, Hoon CK, Joo HS, et al. Efficacy and tolerability of adjunctive therapy with zonisamide in childhood intractable epilepsy[J].Brain Dev, 2009, 5(2):3-4.
[6] 贾利芳, 陶拉娣, 李亚蕊,等. 左乙拉西坦添加治疗儿童难治性癫痫部分性发作的临床研究[J].中国药物与临床,2012,12(9):1 194-1 196.
[7] Rosenfeld W, Selim B, Pascal E, et al.Levetiracetam as add on therapy for idiopathic generalized epilepsy syndromes with onset during adolescence: analysis of two randomized,doubleblind, placebocontrolled studies[J].Epilepsy Res, 2009,13(2):16-17.
[8] Tai K, Truong DD. Brivaracetam is superior to levetiracetam in a rat model of posthypoxic myoclonus[J].J Neural Transm,2007,114(2):1 547-1 551.
[9] 程艳, 谭忠友, 何扬帆, 等. 左乙拉西坦单药治疗婴幼儿癫痫56例临床观察[J].重庆医科大学学报, 2012,37(11): 1 022-1 024.
[10] You SJ, Kang HC, Kim HD, et al. Vagus nerve in intractable childhood epilepsy:a Korean multicenter experience[J].J Korean Med Sci,2007, 22(3):442-445.
[11] Wolfgang L,Andrew J,Michael J,et al.Commentary:physical Approaches for the Treatment of Epilepsy: Electrical and Magnetic Stimulation and Cooling[J].Neurotherapeutics,2009,6(2):258-262.
[12] Rigo JM, Hans G, Nguyen L, et al.The anti-epileptic drug levetiracetam reverses the inhibition by negative allosteric modulators of neuronal GABA and glycinegated currents[J].Br J Pharmacol,2002,136(5):659-672.
[13] Gentile V, Brunetto D, Leo I, et al. Clinical and neuropsychological considerations in a case of unrecognized myoclonic epileptic jerks dramatically controlled by levetiracetam[J].Neuropediatrics,2010, 41(6):270-272.
[14] 昊洵昳, 洪震, 吴逊, 等. 多中心双盲、随机、安慰剂对照评价左乙拉西坦添加治疗难治性部分性癫痫发作的疗效及安全性[J].中华神经科杂志, 2007,40(3):149-153.
(收稿2013-09-20)
Clinical research levetiracetam treatment of intractable epilepsy in the low age children
ShuZhigang,WeiGuo
DepartmentofNeurology,theCentralHospitalofEzhou,Ezhou436000,China
Objective To investigate the efficacy and security of levetiracetam on intractable epilepsy in the low age children. Methods Children ≤5 years of old with intractable epilepsy in our department, from January 2008 to May 2013 were selected for the study , and were randomly divided into study group and the control group, the study group was treated with levetiracetam, while control group was treated carbamazepine, The clinical efficacy , laboratory test result and adverse reactions of two groups were compared.Results After 26 weeks of treatment, the efficacy of the study group was higher than that of the control group, and the incidence of adverse reactions of the study group than that of the control group, the difference was all statistically significant (P<0.05), while there was no significant difference in the results of the laboratory. Conclusion Levetiracetam has significant efficacy and goog security on low age children with intractable epilepsy, and is worthy of promotion.
Levetiracetam; Intractable epilepsy; The low age children; Security
R742.1
A
1673-5110(2014)02-0004-03
△通讯作者:卫国,E-mail:495274393@qq.com

