甲状腺包膜内乳头状癌的超声表现
刘利民 张韵华 王文平 袁海霞 俞清 夏罕生
(复旦大学附属中山医院超声诊断科,上海 200032)
甲状腺乳头状癌是最常见的一种甲状腺恶性肿瘤。甲状腺包膜内乳头状癌是甲状腺乳头状癌中较少见的一种亚型,病理特征主要为肿瘤完全被纤维包膜包裹,与周围正常甲状腺组织完全分隔[1]。甲状腺包膜内乳头状癌分为经典型及滤泡型[2]。临床上,甲状腺包膜内乳头状癌淋巴结转移少,预后较好,甲状腺手术后几乎无局部复发及死于甲状腺疾病者[3],但目前关于其超声表现的报道[4-6]较少。本研究旨在探讨甲状腺包膜内乳头状癌的超声表现,并根据甲状腺超声影像学报告及数据系统(thyroid imaging reporting and data system,TI-RADS)[7]进行超声诊断分级。
1 资料与方法
1.1 一般资料 2005年1月—2012年12月共3416例患者在复旦大学附属中山医院行甲状腺手术,其中115例患者经手术病理证实为甲状腺包膜内乳头状癌。115例甲状腺包膜内乳头状癌患者中95例入选本研究,其中女性54例,男性41例;年龄21~76岁,中位年龄46岁。另20例患者因病灶较小(2~4 mm)致超声检查漏诊或未行超声检查被本研究剔除。95例患者中11例行甲状腺全切术,66例行甲状腺一叶切除术,15例行甲状腺一叶部分切除术,3例行甲状腺一叶切除术或全甲状腺切除加颈部淋巴结清扫手术。术后病理显示67例患者68个病灶为经典型甲状腺包膜内乳头状癌,28例患者29个病灶为滤泡型甲状腺包膜内乳头状癌。95例患者中2例有颈部淋巴结转移。术后超声、CT及放射性核素检查均未发现淋巴结转移或局部复发。
1.2 检查方法 应用日本日立公司EUB-8500彩色超声诊断仪以及荷兰飞利浦公司EnVisor和iU22彩色超声诊断仪,采用频率为5~17 MHz的线阵宽频探头。观察甲状腺结节大小(最大径)、内部结构(实性或囊实性)、形态(圆形或卵圆形、纵横比>1或不规则)、边界(光滑、针刺状或边界模糊)、内部回声(极低回声、低回声、等回声及高回声)、钙化(微小钙化、粗大钙化或无钙化)及低回声声晕(有或无)[8]。甲状腺结节的彩色血流信号分为无血供(未见血流信号)、少血供(结节内可见少量血流,无周围环状血流)、中等血供(周围可见环状血流,内部无或可见中等血流)及丰富血供(内部可见丰富血流)[9]。检查颈部有无淋巴结肿大,观察淋巴结的内部回声。
根据TI-RADS[7],将甲状腺结节分为:(1)良性(1级):甲状腺结节具有3种及3种以上提示良性的超声表现,无提示恶性或不确定性的超声表现。提示良性的超声表现包括病灶卵圆形、等回声、边界光滑及周围可见血流信号;(2)良性可能(2级):甲状腺结节具有1~2种提示良性的超声表现,无提示恶性或不确定性的超声表现;(3)不确定性(3级):甲状腺结节具有1 种或多种提示不确定性的超声表现。提示不确定性的超声表现包括病灶低回声、病灶内部为主的血流信号、粗大钙化及边界模糊;(4)恶性可能(4级):甲状腺结节具有1 种提示恶性的超声表现。提示恶性的超声表现包括病灶极低回声、微小钙化、边缘针刺状、纵横比>1及淋巴结异常;(5)恶性(5级):甲状腺结节具有2 种或以上提示恶性的超声表现。
2 结 果
2.1 超声表现 经典型及滤泡型甲状腺包膜内乳头状癌的超声表现见表1。经典型甲状腺包膜内乳头状癌提示恶性的超声表现有微小钙化(41%)及边缘针刺状(15%);滤泡型甲状腺包膜内乳头状癌提示恶性的超声表现有微小钙化(14%)。
2.2 超声诊断分级 甲状腺包膜内乳头状癌诊断为良性、良性可能、不确定性、恶性可能、恶性的病灶数依次为21(22%)、17(17%)、26(27%)、23(24%)、10(10%),其中经典型甲状腺包膜内乳头状癌诊断为良性、良性可能、不确定性、恶性可能、恶性的病灶数依次为7(10%)、11(16%)、21(31%)、19(28%)及10(15%);滤泡型甲状腺包膜内乳头状癌诊断为良性、良性可能、不确定性、恶性可能、恶性的病灶数依次为14(48%)、6(21%)、5(17%)、4(14%)及0。甲状腺包膜内乳头状癌的典型超声影像图见图1~5。

表1 甲状腺经典型及滤泡型包膜内乳头状癌的超声表现

图1甲状腺包膜内乳头状癌,超声表现为卵圆形、囊实性团块,实性部分均匀,中等回声,边界清晰,有低回声声晕

图2甲状腺包膜内乳头状癌,超声表现为卵圆形、实性团块,欠均匀,中等回声,瘤内及周边可见稍丰富彩色血流信号

图3甲状腺包膜内乳头状癌,超声表现为结节内充满强回声钙化灶伴后方声影
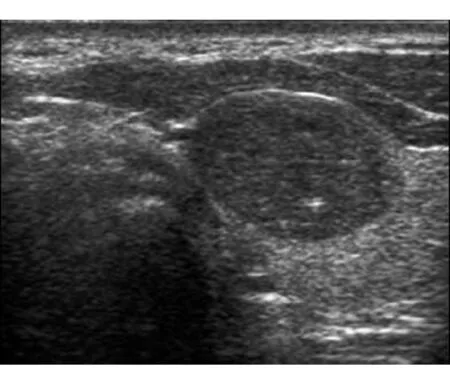
图4甲状腺包膜内乳头状癌,超声表现为卵圆形、边界清晰的均匀、低回声团块,内见1个微小钙化

图5甲状腺包膜内乳头状癌,超声表现为圆形、囊实性团块,实性部分形态不规则,内见数个微小钙化
TI-RADS分级为恶性可能的经典型包膜内乳头状癌共19个结节,其中18个结节仅有微小钙化,1个结节仅有针刺状边界;滤泡型包膜内乳头状癌4个结节均仅有微小钙化。TI-RADS分级为恶性的经典型包膜内乳头状癌10个结节中9个结节同时有微小钙化及边缘针刺状,1个结节同时有微小钙化及颈部淋巴结异常;滤泡型包膜内乳头状癌无同时具有2种或2种以上恶性超声表现的结节。
3 讨 论
甲状腺高频超声检查被广泛应用于甲状腺结节的诊断和鉴别诊断中。研究[9-10]显示,经典型甲状腺乳头状癌的超声表现包括病灶极低回声、边缘针刺状、微小钙化、纵横比>1及淋巴结异常。滤泡型甲状腺乳头状癌病灶较大,多呈良性超声表现[8]。
文献[4]报道甲状腺包膜内乳头状癌提示恶性的超声表现为边缘针刺状(64%)及微小钙化(39%)。囊性甲状腺包膜内乳头状癌提示恶性的超声表现为实质部分呈分叶状(6%),内见微小钙化(18%)[11]。滤泡型甲状腺包膜内乳头状癌的超声表现多为边界清晰,圆形及卵圆形,实性或实性为主,均匀等回声或稍低回声伴低回声声晕,唯一提示恶性的超声表现为微小钙化(15%)[5]。目前,尚无关于甲状腺包膜内乳头状癌经典型与滤泡型的对比研究的文献。
本研究显示,经典型甲状腺包膜内乳头状癌提示恶性的超声表现为微小钙化(41%)及边缘针刺状(15%);滤泡型甲状腺包膜内乳头状癌提示恶性的超声表现仅为微小钙化(14%)。本研究中未见极低回声及纵横比>1等提示恶性的超声表现。
颈部淋巴结内见微小钙化及囊性变是甲状腺乳头状癌提示恶性的超声表现之一[12]。文献[1,3-5]报道的甲状腺包膜内乳头状癌颈部淋巴结转移率为0~61%,其肿瘤最大径的平均值或中位数为1.6~3.1 cm。本研究中,颈部淋巴结转移率为2.1%(2/95),肿瘤最大径的平均值为2.2 cm。肿瘤大小与甲状腺包膜内乳头状癌淋巴结转移可能有关。
甲状腺结节提示恶性的超声表现越多,其恶性可能性也越大[13]。Kim等[7]报告,甲状腺恶性肿瘤超声分级为良性、良性可能、不确定性、恶性可能、恶性的比例依次为5%、9%、9%、20%、57%;但是甲状腺包膜内乳头状癌较少呈现提示恶性的超声表现,本研究中,包膜内乳头状癌超声分级为良性、良性可能、不确定性、恶性可能、恶性比例依次为22%、17%、27%、24%、10%,其中经典型依次为10%、16%、31%、28%、15%,滤泡型依次为48%、21%、17%、14%、0%。
根据TI-RADS分级[7,13],对甲状腺肿瘤应采取如下诊治措施:良性及良性可能组,推荐长期超声随访,随访期间,肿瘤增大或有提示恶性的超声表现,即行穿刺抽吸检查;不确定性组,推荐穿刺抽吸检查,如细胞学检查无诊断意义,应短期随访(6 个月);恶性可能及恶性组,推荐穿刺抽吸检查,如细胞学检查无诊断意义,立即重复穿刺抽吸检查。但是,目前甲状腺包膜内乳头状癌的术前诊断仍有一些问题:(1)良性及良性可能组患者比例较高,如推荐长期超声随访,有相对较多的患者不能得到及时的手术治疗。由于大于3.0 cm肿瘤的淋巴结转移率较高[1,4],因此大于3.0 cm的肿瘤应推荐行穿刺抽吸检查;(2)部分结节内布满钙化,不能进行穿刺抽吸检查,应根据超声表现选择合适的手术患者;(3)滤泡型包膜内乳头状癌的细胞学诊断较困难,Yang等[5]报告,该类型肿瘤细胞学诊断常提示为滤泡型乳头状癌(32%),不典型增生(49%),滤泡型肿瘤(19%)。因此,超声可为细胞学诊断不明确的病例提供辅助诊断依据。
综上所述,甲状腺包膜内乳头状癌尤其是滤泡型包膜内乳头状癌超声分级多为良性、良性可能或不确定性,少数为恶性及恶性可能。了解甲状腺包膜内乳头状癌的超声表现,密切超声随访及穿刺抽吸细胞学检查有助于甲状腺包膜内乳头状癌的诊断及治疗。
[1]Schröder S,Böcker W,Dralle H,et al.The encapsulated papillary carcinoma of the thyroid.A morphologic subtype of the papillary thyroid carcinoma[J]. Cancer,1984,54(1):90-93.
[2]Rivera M,Tuttle RM,Patel S,et al.Encapsulated papillary thyroid carcinoma:a clinico-pathologic study of 106 cases with emphasis on its morphologic subtypes (histologic growth pattern)[J].Thyroid,2009,19(2):119-127.
[3]Gupta S,Ajise O,Dultz L,et al.Follicular variant of papillary thyroid cancer: encapsulated,nonencapsulated,and diffuse:distinct biologic and clinical entities[J].Arch Otolaryngol Head Neck Surg,2012,138(3):227-233.
[4]Kobayashi K,Jikuzono T,Fukata S,et al.Characteristic ultrasonographic features of the encapsulated variant of papillary carcinoma of the thyroid[J].J Med Ultrasonics,2007,34(3):145-150.
[5]Yang GC,Fried K,Yakoushina TV,et al.Encapsulated follicular variant of papillary thyroid carcinoma:fine-needle aspiration with ultrasound and histologic correlation of 41 cases[J].Acta Cytol,2013,57(1):26-32.
[6]原韶玲,薛改琴,杜晨翔,等.包膜内型甲状腺乳头状癌的超声表现[J].中华耳鼻咽喉头颈外科杂志,2011,46(4):338-340.
[7]Kim DW,Park JS,In HS,et al.Ultrasound-based diagnostic classification for solid and partially cystic thyroid nodules[J].Am J Neuroradiol,2012,33(6):1144-1149.
[8]Kim DS,Kim JH,Na DG,et al.Sonographic features of follicular variant papillary thyroid carcinomas in comparison with conventional papillary thyroid carcinomas[J].J Ultrasound Med,2009,28(12):1685-1692.
[9]Frates MC,Benson CB,Doubilet PM,et al.Can color Doppler sonography aid in the prediction of malignancy of thyroid nodules?[J].J Ultrasound Med, 2003,22(2):127-131.
[10]Moon WJ,Jung SL,Lee JH,et al.Benign and malignant thyroid nodules:US differentiation--multicenter retrospective study[J].Radiology,2008,247 (3):762-770.
[11]Yang GC,Stern CM,Messina AV.Cystic papillary thyroid carcinoma in fine needle aspiration may represent a subset of the encapsulated variant in WHO classification[J].Diagn Cytopathol,2010,38(10):721-726.
[12]Kessler A,Rappaport Y,Blank A,et al.Cystic appearance of cervical lymph nodes is characteristic of metastatic papillary thyroid carcinoma[J].J Clin Ultrasound,2003,31(1):21-25.
[13]Kwak JY,Han KH,Yoon JH,et al.Thyroid imaging reporting and data system for US features of nodules:a step in establishing better stratification of cancer risk[J].Radiology,2011,260(3):892-899.

