中下段食管癌三维适形放疗并发放射性肺损伤的相关因素分析
高彩霞 乔田奎 张彬 雷林杰
(复旦大学附属金山医院肿瘤科,上海 201508)
近年来,三维适形放疗(three-dimensional conformal radiotherapy,3DCRT)已广泛应用于食管癌的治疗。3DCRT能使肿瘤靶区和肿瘤周围正常组织的照射剂量更为精确,且可以在正常组织耐受的前提下通过增加射野来改善肿瘤靶区的照射。对于局部晚期食管癌患者的放疗,一方面,为了提高放疗局控率,需提高放疗剂量;另一方面,放疗的同时应注意保护肺组织,减少放射性肺损伤。本研究旨在探讨中下段食管癌患者行3DCRT的临床物理参数及患者的免疫学指标与发生放射性肺损伤的相关性。
1 资料与方法
1.1 一般资料 选择2010年3月—2011年12月在我院行3DCRT的46例中下段食管癌患者,均为初治食管癌患者,均经胃镜病理确诊为鳞癌;其中男性36例,女性10例;年龄55~90岁,平均(69±6.8)岁;均无器质性心肺疾病史,均为首程放疗,放疗前均签署知情同意书;食管癌分期Ⅰ、Ⅱ期患者15例,Ⅲ、Ⅳ期患者31例;KPS评分均在70分以上;肿瘤起始部位距门齿23~27 cm;钡剂X线透视下食管病变长度为4~8 cm,平均6.4 cm。46例患者中,16例患者完成了2个周期的同步化疗,分别在放疗前1周和放疗第4周进行,化疗当天暂停放疗;化疗方案为紫杉醇(135~175 mg/m2,d1)+顺铂(20 mg/d,d1~5)或5-Fu(500 mg/d,d1~5)+顺铂(20 mg,d1~5);同步化疗过程中,及时给予对症处理;16例患者中,6例放疗期间因白细胞降低暂停放疗,经治疗使白细胞上升后继续放疗,其余10例患者按原放疗计划顺利完成治疗。
1.2 放射治疗
1.2.1 体膜制作和定位 患者裸露胸部,去枕平卧于体架上,双手交叉上举置于头顶,将热塑模固定于患者颈胸部并使其紧贴颈胸部皮肤,之后使膜自然冷却,嘱患者在整个过程中平静呼吸;在激光线下选择胸部的适当位置放置金属标记并固定,准备CT定位。46例患者均进行CT增强扫描,范围从胸廓入口到L2椎体水平,层厚为4 mm,扫描过程中患者保持平静呼吸。将扫描图像经网络传送至3DCRT计划系统,采用拓能计划系统完成计划设计和优化。
1.2.2 靶区的定义和勾画 根据ICRU50号报告指导原则进行靶区勾画。CT影像显示食管肿瘤靶区(gross tumor volume,GTV),GTV1为明确诊断的纵膈内(3、4、5、7、8、10区)转移的肿大淋巴结(直径≥10 mm);GTV左右、前后各外放5 mm作为临床靶区(clinical target volume,CTV),在GTV的上下界各外扩2~2.5 cm作为CTV的上下界,同时确认靶区GTV1完全被CTV所包绕;未发生纵膈淋巴结转移者,则将上述淋巴结区作为亚临床淋巴引流区并被CTV覆盖,CTV外放5 mm作为计划靶区(planning target volume,PTV)。系统自动勾画危及器官,包括脊髓、双肺、心脏。靶区勾画及确认至少由2名放疗医师完成。
1.2.3 放疗方法 46例患者均行6MV的3DCRT。其中21例患者为全程等中心三野适形放疗(一前野+两后斜野),以95%剂量线包绕PTV,单次剂量200 cGy/次,处方剂量56~66 Gy/28~33次,中位治疗剂量60.4 Gy。其余25例患者前半程为四野等中心适形放疗(前后野+水平对穿野),前后野与水平设野的剂量权重比为3∶2,设野微调最终以95%剂量线包绕PTV,常规分割,前半程处方剂量40 Gy/20次;后半程为三野等中心适形放疗,总处方剂量54~64 Gy /27~32次,中位剂量60 Gy。肺脏限制剂量为20 Gy,脊髓限制剂量为45 Gy,心脏限制剂量为45 Gy。外置光栅完成适形挡铅。
1.2.4 物理参数 采用横切面等剂量分布图、剂量体积直方图(DVH)评价治疗计划,观察并记录95%剂量覆盖相应靶体积(PTVV95)、95%PTV所接受照射的剂量参数(PTVD95),记录两侧肺接受5、20、25、30 Gy照射时的肺体积占全肺总体积的百分比(V5、V20、V25、V30)及双肺受照平均剂量(MLD)。
1.2.5 放射性肺损伤的评价标准 患者放疗结束后1、3、6个月时分别进行胸部X线片或胸部CT检查,作为评价放射性肺损伤的依据。肺损伤评价按NCI CTC 3.0急性放射性肺炎标准评价:0级,症状体征同放疗前,无明显变化;1级,无明显的呼吸道症状,仅X线片显示有炎性反应表现;2级,持续咳嗽,需用麻醉性镇咳药,未影响日常生活;3级,严重咳嗽,麻醉性镇咳药无效,严重影响正常生活,或需要间断吸氧或应用糖皮质激素;4级,严重呼吸功能不全,需持续吸氧或辅助通气,危及生命;5级,严重的放射性肺炎致死。诊断放射性肺炎时必须排除肺内感染及肺内病变进展。观察终点:≥2级放射性肺炎。
1.3 免疫学指标检测 于放疗前、放疗结束时(放疗后)、放疗后1个月分别进行静脉血淋巴细胞(LC)、C反应蛋白(CRP)、T淋巴细胞亚群(CD3+、CD4+、CD8+)及CD4+/CD8+测定。用流式细胞仪(FCM)测定T淋巴细胞亚群,采用化学发光法检测CRP(蛋白分析仪Array 360,美国贝克曼公司)。

2 结 果
2.1 中下段食管癌患者行3DCRT后发生放射性肺损伤的情况及其与各项指标的相关性分析 46例患者中发生2级以上放射性肺损伤者9例(20%),其中2级7例,3级2例;最早出现放射性肺损伤的时间在放疗结束后1周,最晚出现时间为放疗后2个月。将患者按年龄、性别、食管病变长度、TNM分期、双肺体积、是否行同步化疗、放疗总量和布野方式分组并进行分析,结果显示,肿瘤病变长度、是否同步化疗以及放疗总量与中下段食管癌患者行3DCRT后放射性肺损伤的发生相关,P值分别为0.002、0.004、0.031。 见表1。
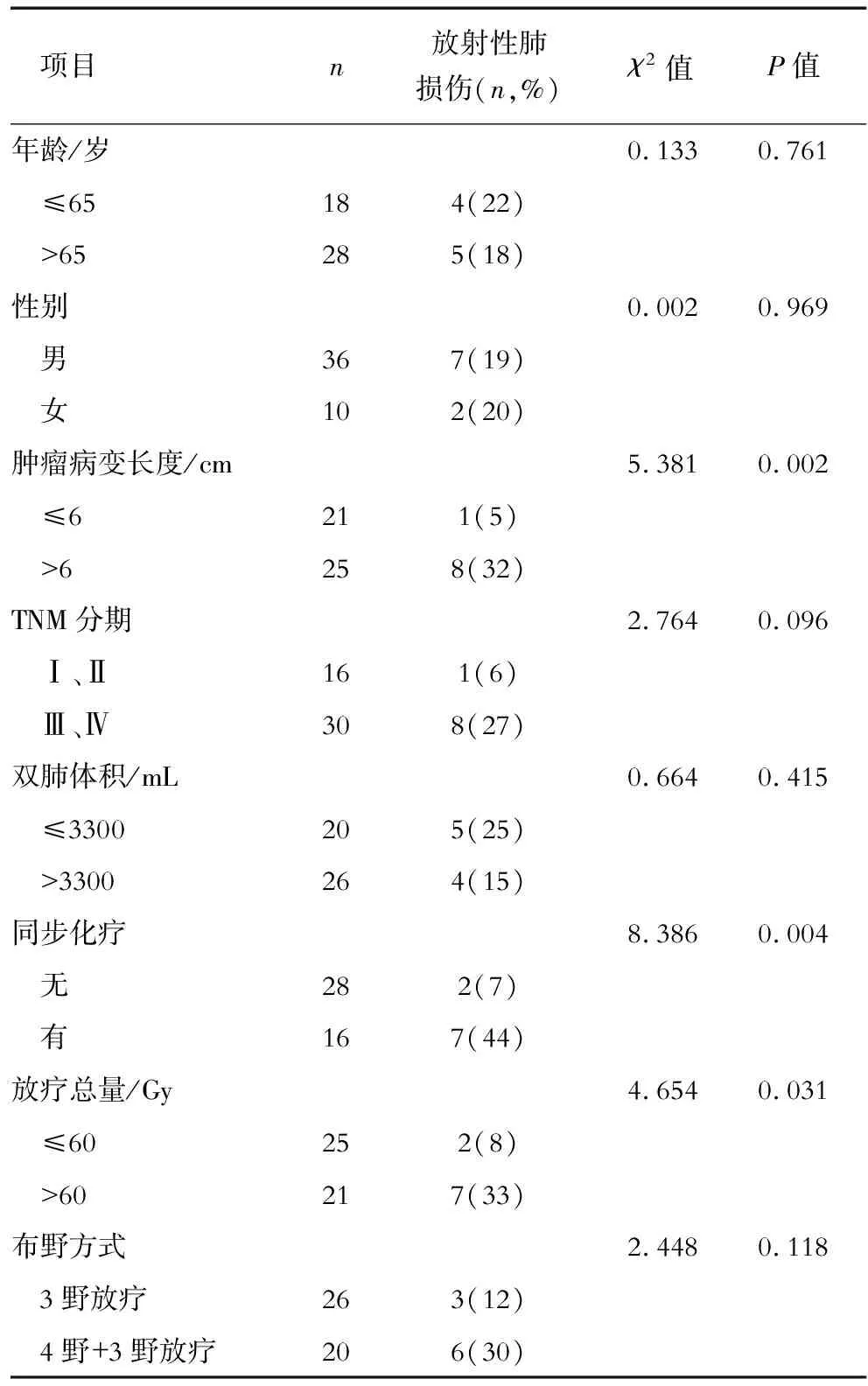
表1 中下段食管癌患者三维适形放疗后放射性肺损伤的发生与各项指标的相关性分析
2.2 未发生放射性肺损伤患者(非RP组)与放射性肺损伤患者(RP组)的物理参数比较 比较两组患者3DCRT的各项物理参数(PTVV95、PTVD95、肺MLD以及肺V30、V25、V20、V5)、肿瘤病变长度及靶区处方剂量,结果显示,两组的肿瘤病变长度、靶区处方剂量、PTVV95、PTVD95、肺MLD以及V25、V20、V5的差异均有统计学意义(P<0.05)。见表2。
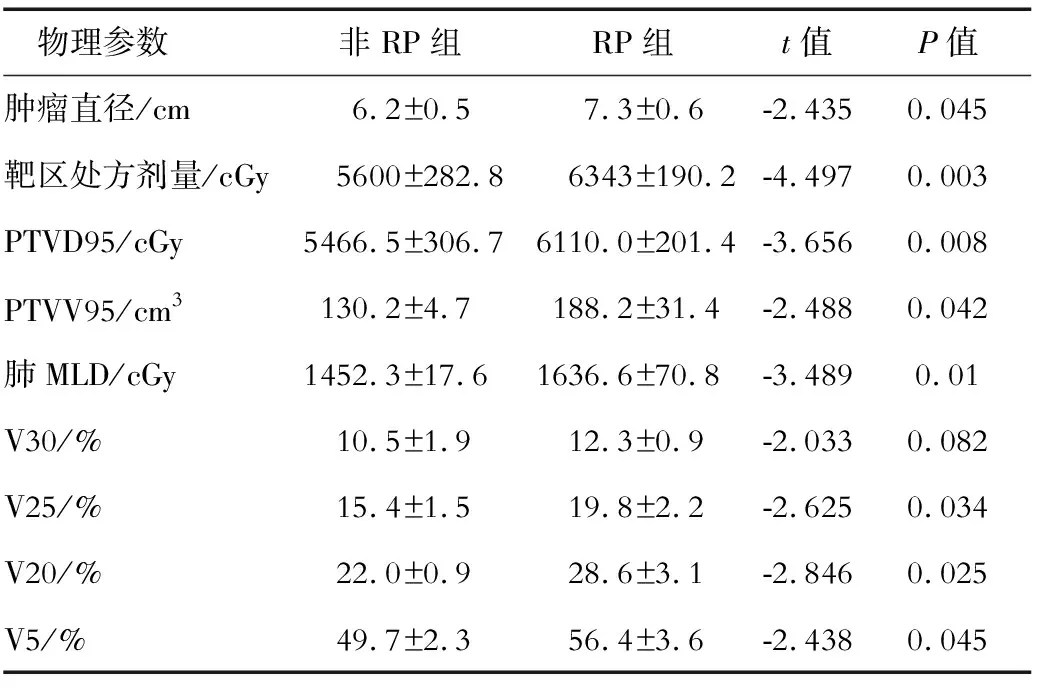
表2 非RP组与RP组的各项物理参数比较
2.3 非RP组和RP组的免疫指标比较 RP组放疗后LC低于非RP组(P<0.05),RP组CRP高于非RP组(P<0.05);两组放疗后 CD3+、CD4+T细胞亚群比例的组间差异有统计学意义(P<0.05),而CD8+T细胞亚群比例在两组的差异无统计学意义(P<0.05);RP组CD4+/CD8+低于非RP组(P<0.05)。见表3。
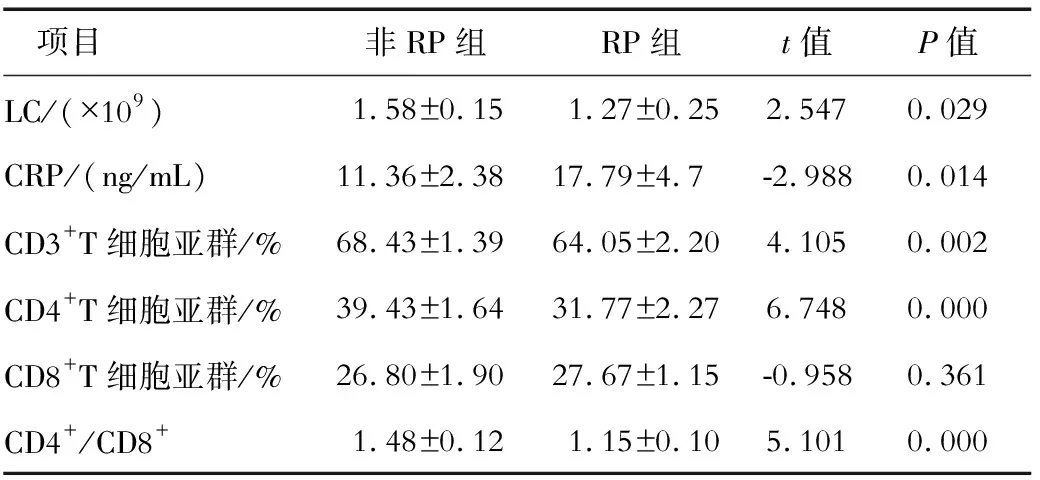
表3 非RP组与RP组的免疫学指标比较
对RP组放疗前、放疗后和放疗后1个月的各项免疫学指标进行单因素方差分析,结果见表4。外周血LC水平在放疗后和放疗后1个月均低于放疗前(P<0.05);CRP水平在放疗后、放疗后1个月均高于放疗前,但差异无统计学意义(P>0.05);CD3+、CD4+T细胞亚群比例在放疗后、放疗后1个月均低于放疗前(P<0.05),CD8+T细胞亚群比例在放疗后、放疗后1个月高于放疗前(P<0.05),CD4+/CD8+在放疗后、放疗后1个月低于放疗前,(P<0.05)。将放疗后各项免疫指标分别与放疗前比较并进行t检验,CRP水平在放疗后及放疗后1个月虽高于放疗前,但P>0.05;CD8+T细胞在放疗后1个月的水平仍高于放疗前水平,升高的程度有所回落(P>0.05)。

表4 RP组放疗不同时段的免疫学指标比较
3 讨 论
放射性肺损伤是限制食管癌(尤其是中下段食管癌)患者根治性放疗剂量的主要因素。放射性肺损伤不仅影响肿瘤放疗局控率,而且严重影响食管癌患者的生活质量,甚至危及生命。目前,有关放射性肺损伤的研究多集中于临床物理因素和细胞因子等生物因素方面,本研究着重分析食管癌患者行3DCRT的临床物理参数和患者的免疫学指标与放射性肺损伤的关系。
因食管属纵隔器官,且食管癌患者就诊时多属中晚期,导致中下段食管癌放射治疗的体积较大;肺脏属于“并行器官”,是放射敏感组织,部分肺组织受到照射时,放射性肺损伤的阈值一般为20~30 Gy[1];胸部肿瘤放疗时,放射性肺损伤的发生率为20%左右[2]。本研究中,中下段食管癌行3DCRT,放射性肺损伤的发生率为20%(9/46),症状出现时间为放疗后1周至放疗后2个月;肿瘤病变长度、同步化疗和放疗剂量与放射性肺损伤相关,其原因如下:(1)随着肿瘤病变长度的增加,食管癌局部外侵增加,局部淋巴结转移增多,因此照射靶体积增大,导致肺脏受照体积增加;(2)放疗剂量的增加使接受照射的肺组织单位体积的照射剂量增加;(3)某些化疗药物的肺毒性作用降低了正常肺组织的功能储备。既往研究[3]报告,五野以上的布野方式与放射性肺损伤的发生相关,而本研究将全程三野照射和四野+三野照射分组分析后,未发现布野方式与放射性肺损伤的发生相关,这也可能与本研究的放疗总剂量较低、病例数较少有关。
目前常用适形放疗计划系统的DVH来评价肿瘤组织及其周围敏感组织的受照剂量和体积。一项RTOG前瞻性研究[4]发现,肺V20不仅与放射性肺炎的发生相关,且与放射性肺炎的严重程度密切相关,故认为V20是放射性肺损伤的独立影响因子。Hernando等[5]对201例胸部放疗患者的肺相关指标进行分析后发现,最强的预测因素是V30(P=0.003);该研究建议,当接受45 Gy以上剂量时,如V30>35%,应调整治疗计划。近年来,随着胸部调强放疗(intensity-modulated radiation therapy,IMRT)的应用,有研究[6]认为,较大肺体积接受小剂量(5Gy)照射也是不安全的,因此V5也成为继V20、V30、MLD后评价放射性肺损伤的有力补充。本研究发现,RP组的肿瘤直径、放疗剂量、靶区剂量PTVD95、靶区体积PTVV95以及肺MLD、V25、V20、V5均大于非RP组(P<0.05); RP组肺V30大于非RP组,但差异无统计学意义。
放射性肺损伤是多细胞因子参与的肺组织病理过程,机体的免疫功能与这一过程的发生密切相关。本研究检测了中下段食管癌患者放疗不同时段时LC、CRP及T细胞亚群的变化,将RP组与非RP组放疗后的各项免疫指标进行比较,结果显示,RP组LC、CD3+T细胞亚群比例、CD4+T细胞亚群比例、CD4+/CD8+明显低于非RP组(P<0.05),而RP组CRP则高于非RP组(P<0.05);放疗后RP组CD8+T细胞亚群和非RP组对比变化不大,提示CD8+T细胞分布可能与放疗过程有关。本研究中,放疗后RP组CD4+T细胞亚群比例明显低于非RP组,提示CD4+T细胞可能参与了放射性肺损伤的发生。进一步对RP组放疗不同时段的各免疫指标进行单因素方差分析,结果显示,RP组放疗不同时段的LC和T细胞亚群的分布差异有统计学意义,放疗后和放疗后1个月CD4+/CD8+均低于放疗前水平,提示细胞免疫功能降低可能与放射性肺损伤的发生相关。有研究[7]报告,CRP的增高可以预测放射性肺损伤的发生,本研究仅发现放疗后RP组CRP高于非RP组,但RP组放疗不同时段的CRP水平差异无统计学意义。
综上所述,放射性肺损伤是多因素参与的炎性反应病理过程。本研究显示,食管癌患者行3DCRT的物理参数及放疗过程中伴随的免疫功能变化与发生放射性肺损伤存在相关性。但鉴于本研究样本数较少,可能出现统计数据的偏倚,因此,有待加大样本量作进一步的分析。
[1]Graham MV.Predicting radiation response(Editorial)[J].Int J Radiat Oncol Biol Phys,1997,39(3):561-562.
[2]Marks LB,Munley MT,Bentel Gc,et al.Phycical and biological predictors of changes in whole lung function following thoracic irradiation[J].Int J Radiat 0ncol Biol Phys,1997,39:563-570.
[3]沈文斌,祝淑钗,李任,等. 胸中下段食管癌三维适形放疗所致放射性肺损伤相关因素分析[J].中华放射肿瘤学杂志,2007,16(5):335-339.
[4]Ryhardt RW,Scott C,Sause WT,et al.Response, toxicity,failure patterns,and survival in five radiation therapy oncology group(RTOG)trial of aequential and/or concurrent chemotherapy and radiotherapy for locally advanced non-small carcinoma 0f the lung[J].Int J Radiat 0ncol Biol Phys,1998,42:469-478.
[5]Hernando,ML,LB Marks,GC Bentel. Radiation-induced pulmonary toxicity:a dose-volume histogram analysis in 201 patients with lung cancer[J].Int J Radiat Oncol Biol Phys,2001,51(3):650-659.
[6]Wang S,Liao ZX,Wei X,et al.Analysis of clinical and dosimetric factors associated with treatment-related pneumonitis(THP) in patients with non-small-cell lung cancer(NSCLC) treated with concurrent chemotherapy and three-dimensional conformal radiotherapy (3DCRT) [J].Int J Radiat Oncol Biol Phys,2006,66:1399-1407.
[7]Inoue A, Kunitoh H, Sekine I, et al. Radiation pneumonitis in lung cancer patients:a retrospective study of risk factors and the long-term prognosis[J].Int J Radiat Oncol Biol Phys,2001,49(3):649-655.

