微创心脏手术中的心肌保护措施及效果
赵东 王春生 朱仕杰 张致琦
(复旦大学附属中山医院心外科,上海 200032)
由于微创心脏手术的操作空间狭小,术中心肌保护有一定困难。微创心脏手术是否需要承担比胸骨正中切口心脏手术更高的风险及微创心脏手术中采用适当的心肌保护措施是否能使术中心肌损伤的风险降至与胸骨正中切口心脏手术相近,这些已成为临床上亟待解决的问题。本研究回顾分析了近年来在我院行微创心脏手术的患者术中的心肌保护措施及效果。
1 资料与方法
1.1 一般资料 选取2011年1月—2013年1月在复旦大学附属中山医院行微创心脏手术的63例患者,其中男性31例,女性32例;年龄29~67岁,平均(55.7±4.6)岁;其中行微创二尖瓣成形术15例,微创二尖瓣替换术27例,微创主动脉瓣替换术21例;术前纽约心脏病协会(New York Heart Association,NYHA)心功能分级Ⅱ级18例,Ⅲ级45例。另选同期63例在我院行胸骨正中切口心脏手术的患者,作为对照组,其中男性35例,女性28例;年龄44~65岁,平均(53.2±3.7)岁;包括二尖瓣替换术27例,二尖瓣成形术19例,主动脉瓣替换术17例;术前NYHA心功能分级Ⅱ级11例,Ⅲ级52例。2组患者一般资料比较,差异无统计学意义。所有患者自愿选择微创或常规切口手术方式,并签署知情同意书。
1.2 手术方法及心肌保护措施 微创二尖瓣成形或替换术采用右侧乳缘下4~5 cm的弧形切口,由第4肋间进胸;微创主动脉瓣替换术采用胸骨上段倒“L”型切口,于第3肋间向右侧断开一半胸骨。左房引流管由右上肺静脉开口处插入,停跳液灌注管由升主动脉根部插入。主要心肌保护措施为采用冷血停跳液顺行灌注结合冠状静脉窦逆行灌注,一般情况下,每隔20 min灌注停跳液1次,必要时可持续逆行灌注。主动脉阻断钳开放后,将停跳液灌注管改为倒吸管,持续负压吸引倒吸管及左房引流管。另外,在切开心脏前,即开始低流量(4 L/min)持续手术野灌注二氧化碳(CO2),注意将CO2弥散头放置在心包腔较低处,直至各切口完全缝闭后方可停止CO2灌注。所有患者在术中应用经食道超声心动图(transesophageal echocardiography,TEE)监测心肌收缩力及排气情况,术中静脉应用乌斯他丁,必要时术后加用磷酸肌酸以保护心肌。
比较微创组与对照组术后心脏自动复跳率、心电图ST段异常(心脏复跳至停止体外循环之前,ST段抬高或下降超过2 mm以上)发生率、左室射血分数(left ventricular ejection fraction,LVEF)以及心力衰竭发生率。
2 结 果
两组均无围手术期病死患者。微创组有2例患者术后出现呼吸窘迫综合征,经治疗后好转;对照组有1例患者术后出现肾功能衰竭,予血液透析后好转,1例患者出现伤口感染。微创组术后心脏自动复跳率、心电图ST段异常发生率、LVEF以及心力衰竭发生率与对照组比较,差异均无统计学意义(P>0.05)。见表1。
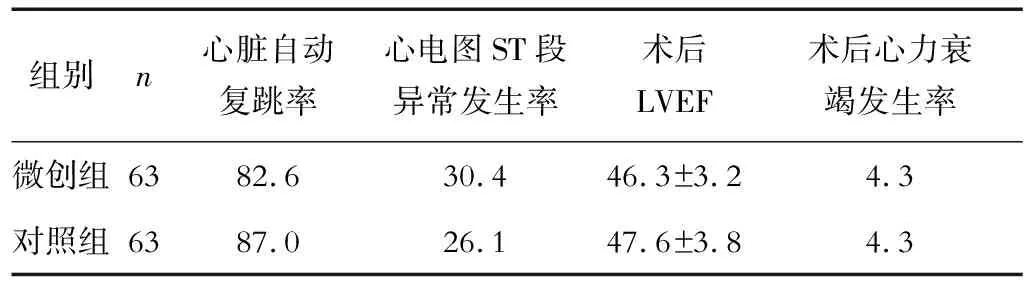
表1 微创组与对照组术后心肌受损指标的比较 %
3 讨 论
微创心脏手术因具有减轻疼痛、缩短住院时间、节省资源、快速康复等优点,得到了多数学者的认可;但是其体外循环时间及主动脉阻断时间较胸骨正中切口心脏手术稍长[1]。
心肌保护作为心脏外科手术中的重要环节,对于患者顺利渡过手术以及术后心功能的恢复具有重要意义[2-4]。Manecke等[5]认为,采取适当的心肌保护方法,可使微创心脏手术在心肌受损方面的风险降至与常规切口心脏手术相当。首先,微创心脏手术在体外循环中将整体温度降至25 ℃,可以很好地降低心肌的代谢;其次,采用顺行灌注加逆行灌注的方法,可有效地减轻心肌损伤;最后,在开放主动脉阻断钳至停止体外循环期间,可进行充分的左房引流或左室引流。
术中TEE对于监测心脏手术后心肌收缩、舒张功能以及测量心腔内的残留气体,都有很高的价值。尤其是用于术后LVEF的测定时,TEE能够更直接地反映心肌功能的变化,这对于提前发现问题及判断预后具有重要意义[6-8]。
本研究中63例行微创心脏手术的患者均采用冷血停跳液顺行灌注加逆行灌注,辅以相应的心肌保护措施,并以TEE监测心功能变化;结果显示,微创组心脏自动复跳率为82.6%,心电图ST段异常发生率为30.4%,LVEF为(46.3±3.2)%,心力衰竭发生率为4.3%;与对照组比较,差异均无统计学意义(P>0.05)。
综上所述,采取适当的心肌保护措施可有效降低微创心脏手术中心脏损伤的风险,效果与胸骨正中切口心脏手术相近。
[1]Nordstrand IA,Tam RK.Minimally invasive surgery for cardiac myxomas using an upper hemi-sternotomy and biatrial septal approach[J].Heart Lung Circ,2005,14(4):255-261.
[2]Kim BS,Soltesz EG,Cohn LH.Minimally invasive approaches to aortic valve surgery: Brigham experience[J].Semin Thorac Cardiovasc Surg,2006,18(2):148-153.
[3]Misfeld M,Davierwala P.Crystalloid-based cardioplegia for minimally invasive cardiac surgery[J].Semin Thorac Cardiovasc Surg,2012,24(4):305-307.
[4]Holzhey DM,Shi W,Borger MA,et al.Minimally invasive versus sternotomy approach for mitral valve surgery in patients greater than 70 years old:a propensity-matched comparison[J].Ann Thorac Surg,2011,91(2):401-405.
[5]Manecke GR,Coletta JM,Pretorius V,et al.Case 3--2013:Maldistribution of cardioplegia detected by transesophageal echocardiography during minimally invasive cardiac surgery[J].J Cardiothorac Vasc Anesth,2013,27(3):614-619.
[6]Mihaljevic T,Cohn LH,Unic D,et al.One thousand minimally invasive valve operations: early and late results[J].Ann Surg,2004,240(3):529-534.
[7]McClure RS,Athanasopoulos LV,McGurk S,et al.One thousand minimally invasive mitral valve operations:early outcomes,late outcomes,and echocardiographic follow-up[J].J Thorac Cardiovasc Surg,2013,145(5):1199-1206.
[8]Petracek MR,Leacche M,Solenkova N,et al.Minimally invasive mitral valve surgery expands the surgical options for high-risk patients[J].Ann Surg,2011,254(4):606-611.

