趋化因子CXCL9在结直肠癌中的表达及其临床意义
洪亮 程志俭 殷庆章 徐宏智 汤承辉 龚梨峰
(复旦大学附属上海市第五人民医院普外科,上海 200240)
结直肠癌(colorectal cancer,CRC)的发病率居世界恶性肿瘤的第2位,占恶性肿瘤总发病人数的9.74%,且其发病率呈上升趋势,尤其在发展中国家[1]。侵袭和远处转移是CRC患者预后不良的主要原因[2]。趋化因子是一类小分子蛋白多肽,属于具有化学趋化作用的细胞因子超家族。现已有超过50种的趋化因子被确认,其中,CXCL9、CXCL12、CXCL16、CXCL10等与肿瘤关系密切[3-4]。目前,关于CXCL9在CRC中的表达及其与肿瘤的发生、发展及患者预后的关系鲜有报道。本实验探讨CXCL9在结直肠癌中的表达及其与CRC临床病理因素间的关系。
1 资料与方法
1.1 一般资料 选择2011年7月—2012年12月在复旦大学附属上海市第五人民医院行根治性手术治疗的60例CRC患者(CRC组),均经术前活体组织检查确诊,临床资料完整,且未接受任何治疗。60例CRC患者中,男性39例,女性21例;年龄45~80岁,平均年龄(58.5±7.3)岁;结肠癌44例,直肠癌16例;肿瘤直径<5 cm 32例,≥5 cm 28例;Dukes A期19例,B期12例,C期14例,D期15例;有淋巴结转移19例,无淋巴结转移41例;右半结肠切除术19例,左半结肠切除术14例,乙状结肠切除术7例,横结肠切除术4例,直肠癌根治术16例。另选20例健康志愿者作为对照组,其中男性13例,女性7例;年龄38~62岁,平均年龄(45.3±6.8)岁。
1.2 标本采集 组织采集:术中取新鲜CRC组织、癌旁组织、正常结直肠组织和区域淋巴结(每例2份),分别于4%甲醛溶液中固定,置于-80 ℃超低温冰箱中保存;癌旁组织取自距癌组织≤1 cm的组织;正常结直肠组织取自距癌组织≥5 cm的组织;区域淋巴结取自肠周系膜组织,HE染色后确定转移情况。血清采集:CRC患者入院后未接受任何治疗,于入院后第1天清晨6时空腹抽取静脉血5 mL,肝素抗凝,于4 ℃冰箱静置1 h,然后以3000 r/min离心15 min,抽取上清液,-20 ℃冻存待检。健康志愿者的血清收集方法如前所述。
1.3 主要试剂 ELISA试剂盒购自美国R&D公司,抗人CXCL9单克隆抗体、二抗(辣根过氧化物酶标记的羊抗兔IgG)、S-P免疫组织化学试剂盒均购自美国Santa Cruz生物技术公司,Trizol购自美国Invitrogen公司,反转录试剂盒购自日本Takara公司,SYBR Green预混液购自美国ABI公司。
1.4 方法
1.4.1 CXCL9的表达及结果判定 将CRC组织、癌旁组织、正常结直肠组织和区域淋巴结进行石蜡包埋,以4 μm的厚度切片、烤片、脱蜡返水、抗原修复。采用免疫组织化学链霉菌抗生物素蛋白-过氧化物酶连结法(streptavidin-perosidase,SP)进行免疫组化染色,CXCL9抗体工作浓度为1∶150,二氨基联苯胺(3,3′-diaminobenzidine,DAB)染色,常规苏木素复染、脱水、透明、中性树胶封片。用磷酸盐缓冲液(phosphate buffer saline,PBS)代替一抗作为阴性对照。免疫组织化学染色结果由2位病理科医师分别双盲阅片。在光镜下,随机选择10个高倍视野(×400),计数1000个细胞,采用许良中等[5]的计分方法,即无着色记为0分,着色弱记为1分,着色适中记为2分,着色深记为3分;无着色记为0分,阳性细胞百分比≤10%记为1分,11%~50%记为2分,51%~75%记为3分,>75%记为4分。2项计分乘积>3分为阳性,否则为阴性。
1.4.2 CXCL9 mRNA的表达 取CRC组织、癌旁组织、正常结直肠组织和区域淋巴结,用Trizol抽取RNA,逆转录合成cRNA,然后采用实时荧光定量聚合酶链反应(Real-Time polymerase chain reaction,Real-Time PCR)法检测CXCL9 mRNA,引物序列参照Huang等[6]设计。CXCL9上游引物:5′-GGCATCATCTTGCTGGTTCT-3′;下游引物:5′-TCACTCTGCTGAATCTGG-3′。内参3-磷酸甘油脱氢酶(3-phosphate dehydrogenase,GAPDH)上游引物:5′-AGCCACATCGCTCAGACAC-3′;下游引物:5′-GCCCAATACGACCAAATCC-3′。PCR条件:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环;72 ℃总延伸5 min。目的基因CXCL9 mRNA的相对表达量以CXCL9和GAPDH的比值计算。
1.4.3 血清CXCL9的浓度 实验前将试剂、样本于室温中放置2 h,采用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测血清CXCL9的浓度。按试剂盒说明稀释标准品,加样,37 ℃孵育30 min;洗板5次,每孔依次加入50 μL酶标抗体,37 ℃孵育30 min;洗板5次,每孔依次加入显色剂A、B各50 μL,避光显色10 min;加入终止液,15 min内在酶标仪(波长450 nm)上读取OD值。根据标准品的浓度及相应OD值计算出标准曲线,并以此计算出各样本CXCL9的浓度。

2 结 果
2.1 CXCL9在各组织中的表达 免疫组织化学染色结果显示,CXCL9主要表达于细胞膜、细胞质中,呈淡黄色或棕黄色,间质不着色,见图1。正常结直肠组织、癌旁组织、无癌转移的区域淋巴结中的CXCL9蛋白表达阳性率均显著低于CRC组织;有癌转移的区域淋巴结中CXCL9蛋白表达阳性率显著高于无癌转移的区域淋巴结,差异有统计学意义(P<0.01),见表1。Real-Time PCR结果显示,各组织中均可见CXCL9 mRNA的表达;正常结直肠组织、癌旁组织、CRC组织中CXCL9 mRNA的表达依次增强,CRC组织中CXCL9 mRNA相对表达量显著高于癌旁组织、正常结直肠组织及无癌转移的区域淋巴结(P<0.01)。

表1 各组织中CXCL9蛋白表达阳性率的比较(n,%)
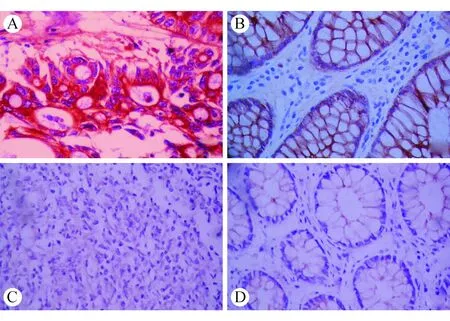
A:CRC组织;B:癌旁组织;C:区域淋巴结;D:正常结直肠组织
2.2 CXCL9的表达与CRC临床病理因素的相关性分析 随着浸润深度、Dukes分期的增加,CXCL9的阳性表达率明显增加(P<0.05);无淋巴结转移的CRC患者CXCL9 阳性表达率显著高于有淋巴结转移患者,差异均有统计学意义(P<0.05);不同年龄、性别、肿瘤部位、肿瘤直径的CRC患者CXCL9的阳性表达率差异均无统计学意义(P>0.05),见表2。
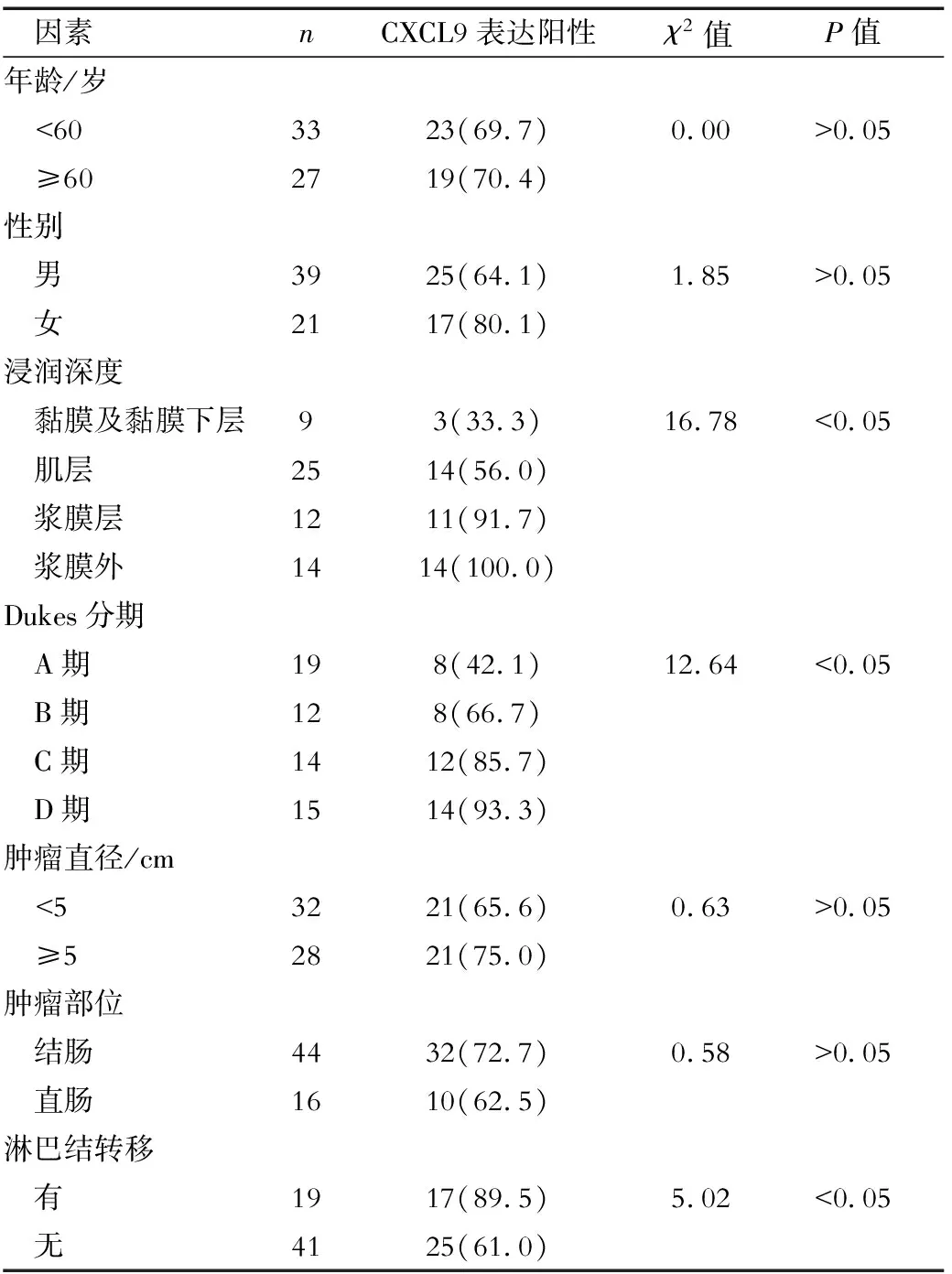
表2 CRC组织中CXCL9的表达与临床病理因素的关系(n,%)
2.3 CRC组与对照组血清CXCL9浓度的比较 CRC组血清CXCL9平均浓度为(28.43±6.41)ng/L,高于对照组(7.65±1.32)ng/L,差异有统计学意义(P<0.05);随着CRC Dukes分期的增加,血清CXCL9的平均浓度增加,差异有统计学意义(P<0.05)。无淋巴结转移CRC患者血清CXCL9的平均浓度[(31.84±5.73)ng/L]高于有淋巴结转移患者[(20.87 ±3.62)ng/L],差异有统计学意义(P<0.05),见图2~3。
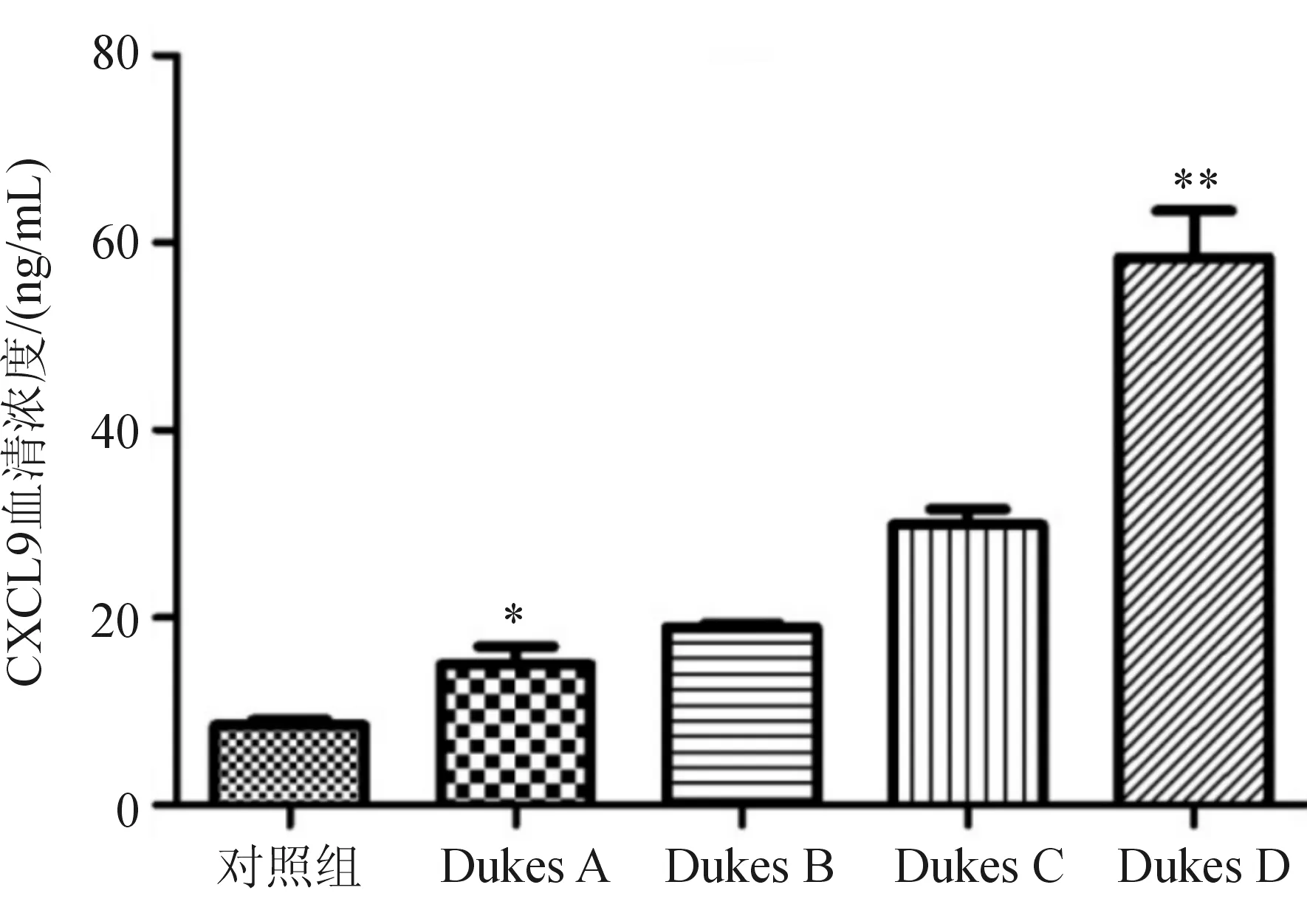
与对照组比较,*P<0.05,**P<0.01
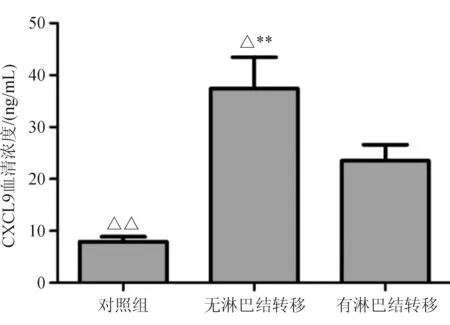
与对照组比较,**P<0.01,与有淋巴结转移组比较,△P<0.05,△△P<0.01
3 讨 论
CRC的发病因素复杂,通常与感染、免疫、遗传等因素有关。肿瘤的浸润和转移是CRC患者的主要死因,CRC患者中有50%~60%发生肿瘤远处转移,患者的5年生存率不足10%[7]。肿瘤的浸润和转移机制目前尚不清楚。研究[8]表明,肿瘤微环境在肿瘤浸润和转移中起重要作用。有研究[9-11]表明,CCL2、CCL3、CCL4、CCL5等炎性趋化因子和CXCL1、CXCL5、CXCL8等血管生成性趋化因子的表达水平在CRC组织中较正常组织明显升高,提示这些趋化因子及其受体在CRC的进展、血管发生及肿瘤转移过程中发挥重要作用。然而,抗血管生长因子CXCL9在CRC中的作用近年来才逐渐受到关注。
CXCL9又称Mig,即γ干扰素(interferon-γ,IFN-γ)诱导的趋化因子,由巨噬细胞及单核细胞分泌,主要趋化活化的T细胞,并在急性移植物抗宿主病中起重要作用。在恶性黑色素瘤中,CXCL9通过趋化T淋巴细胞至肿瘤部位而抑制肿瘤生长。同时,CXCL9与其配体CXCR3结合后可抑制肿瘤血管生成。 近年来的研究[3-4,12]显示,在胃癌、肺癌、乳腺癌、鼻咽癌、口腔鳞状细胞癌、黑色素瘤、淋巴瘤等患者的肿瘤组织及血清中均可检测到CXCL9的高表达。本研究发现,CRC组织中CXCL9蛋白及mRNA的均呈高表达,显著高于正常结直肠组织和癌旁组织(P<0.01),有癌转移的区域淋巴结中CXCL9表达显著高于无癌转移的区域淋巴结(P<0.01)。本研究发现,随着浸润深度、Dukes分期的增加,CXCL9的阳性表达率明显增加,且无淋巴结转移CRC患者CXCL9蛋白的表达显著高于有淋巴结转移患者,差异均有统计学意义(P<0.05)。不同年龄、性别、肿瘤部位、肿瘤直径的CRC患者间CXCL9的表达水平比较,差异均无统计学意义。此外,本研究还发现,CRC患者的血清CXCL9平均浓度高于健康志愿者(P<0.05);在Dukes分期不同的CRC患者中,CXCL9的平均浓度有升高趋势,差异有统计学意义(P<0.05);且无淋巴结转移CRC患者血清CXCL9浓度显著高于有淋巴结转移患者(P<0.05)。以上结果显示,CXCL9在CRC组织中呈过表达状态,且血清CXCL9含量可能与肿瘤负荷及远处转移相关。
综上所述,趋化因子CXCL9可能参与CRC的发生、发展过程,其表达水平与CRC的浸润深度、临床分期、转移等因素有关。随着研究的不断深入,趋化因子CXCL9可能会成为CRC复发、远处转移及预后的预测指标,并有望为进一步研究CRC的发病机制以及生物治疗靶点提供新的策略。
[1]Jemal A,Siegel R,Xu J,et al.Cancer Statistics,2010[J].CA Cancer J Clin,2010,60(5):277-300.
[2]李卫东,姚庆娟,刘刚,等.结直肠癌VEGF和MMP-9基因的表达[J].中国肿瘤临床,2008,35(13):756-758.
[3]Baier PK,Eggstein S,Wolf-voberk G,et al.Chemokines in human colorectal carcinoma [J].Anticancer Res,2005,25(5):3581-3584.
[4]Erreni M,Bianchi P,Laghi L,et al.Expression of chemokines and chemokine receptors in human colon cancer[J].Methods Enzymol,2009,460:105-121.
[5]许良中,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志,1996,6(4):229-231.
[6]Huang W,Hu K,Luo S,et al.Herpes simplex virus type 2 infection of human epithelial cell induces CXCL9 expression and CD4+ T cell migration via activation of p38-CCAA T/enhancer-binding protein-β pathway[J].J Immunol,2012,188(12):6247-6257.
[7]Van Cutsem E,Oliveira J.Primary colon cancer:ESMO clinical recommendations for diagnosis,adjuvant treatment and follow-up[J].Ann Oncol,2009,20(Suppl 4):49-50.
[8]Ruehlamnn JM,Xiang R,Niethammer AG,et al.Mig(CXCL9) chemokine gene therapy combines with antibody-cytokine fusion protein to suppress growth and dissemination of murine colon carcinoma[J].Cancer Res,2001,61(23):8498-8503.
[9]Lacher M,Kappler R,Berkholz S,et al.Association of a CXCL9 polymorphism with pediatric Crohn′s disease[J].Biochem Biophys Res Commun,2007,363(3):701-707.
[10]Baier PK,Eggstein S,Wolf-voberk G,et al.Chemokines in human colorectal carcinoma[J].Anticancer Res,2005,25(5):3581-3584.
[11]Zhang J,Patel L,Pienta KJ.C C chemokine ligand 2(CXCL2) promotes prostate cancer tumorigenesis and metastasis[J].Cytokine Growth Factor Rev,2009,21(1):41-48.
[12]Chang KP,Wu CC,Fang KH,et al.Serum levels of chemokine (C-X-C motif) ligand 9 (CXCL9) are associated with tumor progression and treatment outcome in patients with oral cavity squamous cell carcinoma[J].Oral Oncol,2013,49(8):802-807.

