蔷薇红景天低聚原花青素对D-半乳糖诱导小鼠过氧化损伤的拮抗作用
马 蕾,郝红伟,李慧玲,刘 敏,赵 文
(河北农业大学食品科技学院,河北省农产品加工工程技术中心,河北保定071000)
蔷薇红景天(Rhodiola rosea L.),是景天科红景天属植物。我国野生资源丰富,储藏量位居世界之首[1]。研究发现,红景天具有增强机体免疫功能、抗疲劳、抗衰老、抗肿瘤、抗病毒、抗辐射、减轻高原反应等多种功能[2-3]。卫生部于1991年批准其为食品新资源。有关蔷薇红景天活性成分的研究,主要是红景天苷和酪醇,对原花青素的研究较少。Gad G.Yousef等研究表明不同品种蔷薇红景天含有的原花青素聚合度不同[4];A.Panossian等证实,蔷薇红景天富含以表没食子儿茶素没食子酸酯(EGCG)为基本结构单元的原花青素[5]。赵文、孟玉彩[6-7]等研究表明,河北省张家口产蔷薇红景天富含原花青素,其含量为3.6%,是以EGCG/EGC为基本结构单元组成的原翠雀定类原花色素。但未见有关蔷薇红景天原花青素对抗脂质过氧化等抗氧化效应的研究报道。
有研究表明,自由基连锁反应引起的脂质过氧化会导致细胞损伤、衰老或死亡,与人体许多疾病及衰老密切相关[8-9]。超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)能特异地、有效地清除自由基,从而有效地阻止脂质过氧化。随机体的衰老,SOD和GSH-Px活性逐渐降低,体内自由基得不到及时清除,导致自由基作用于生物膜脂质双分子层中的不饱和脂肪酸,引起脂质过氧化,形成丙二醛(MDA)等脂质过氧化产物[10]。MDA能使蛋白质、核酸、脂类发生交联,使生物膜变性、细胞突变、衰老或死亡[11]。此外,许多研究表明,MDA的生成量反映体内细胞受自由基氧化的程度,在衰老过程中起重要作用[12]。单胺氧化酶(MAO)是线粒体外膜上参与胺类物质代谢的关键酶类,主要分布在大脑皮层、海马区、下丘脑以及肝脏、心脏等组织中,动物外周组织中该酶和脑组织中该酶亚型的水平与过氧化损伤程度正相关[13]。
对小鼠长期注射D-半乳糖是建立小鼠过氧化损伤模型的经典方法[14]。机体内D-gal浓度增高,产生过氧化氢(H2O2)与羟自由基(·OH)等自由基,会使体内的SOD、GSH-Px等抗氧化物水平降低,进一步加重自由基累积,进而导致线粒体功能紊乱,破坏ATP合成,启动自由基级联效应。因此,本实验以D-gal所致过氧化损伤模型小鼠作为实验对象,以模型小鼠的血清及心脏、肝脏、脑组织中的SOD、GSH-Px、MDA、MAO为观察指标,探讨了OPCRR对D-gal诱导机体过氧化损伤的保护作用,为开发新型保健食品提供科学依据。
1 材料和方法
1.1 材料与仪器
蔷薇红景天低聚原花青素 制作工艺参考专利方法[15];SPF 级 ICR 小鼠 雌性,18~22g,购自北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2009-0004;D半乳糖 Sigma公司;抗坏血酸分析纯,天津市福晨化学试剂厂;T-SOD、MDA、GSH-Px、MAO、总蛋白等试剂盒 南京建成生物工程研究所。
Scientz-ⅡD超声细胞破碎仪 宁波新芝生物科技股份有限公司;TDL-5离心机 上海安亭科学仪器厂;SK-1快速混匀器 江苏金檀医疗仪器厂;1500-823酶标仪 Thermo Scientific公司;96孔细胞培养板 Corning公司。
1.2 实验方法
1.2.1 OPCRR的制备 乙酸乙酯萃取与AB-8大孔吸附树脂吸附相结合制备蔷薇红景天原花青素。乙酸乙酯萃取25min、体积比(乙酸乙酯∶提取液)1.5∶1、萃取次数4次;AB-8大孔吸附树脂的最佳上样液pH为4.5,解析液pH为5,径高比为1∶40(cm)。由此分离纯化得到OPCRR的纯度为88.3%。
1.2.2 剂量设计与动物处理 动物购入后,适应性饲养7d后测量体重开始实验。将小鼠随机分为6组,依次为溶剂对照组、模型对照组、阳性对照组和OPCRR低、中、高剂量组,每组10只。除溶剂对照组外,其余5组采用D-半乳糖皮下注射法制备小鼠亚急性过氧化损伤模型,即每天定时颈背部皮下多点注射100mg/kg·bw的D-半乳糖,溶剂对照组以注射用生理盐水代替,连续49d。
在造模的同时,各剂量组动物灌胃给予OPCRR,三个剂量分别为80、160和320mg/kg·bw,阳性对照组给予维生素C 100mg/kg·bw,溶剂对照组和模型对照组给予蒸馏水。
1.2.3 样本采集与制备 实验(造模和给予受试物)第49d,每组随即选取十只小鼠,称量体重,摘眼球取血,制备血清。解剖小鼠取其肝、心和脑组织,称量脏器重量后所有样品储存于-80℃冰箱中待用。
指标检测前,按照试剂盒说明书及预实验确定实验条件和取样量。分装后的小鼠血清两份保留原液,一份用生理盐水按1∶3稀释为25%血清。小鼠的心、脑、肝组织加入9倍体积生理盐水后,在冰浴条件下采用超声细胞破碎仪破碎成匀浆。随后3000r/min离心10min,取上清液即为用于指标检测的10%组织匀浆。用生理盐水将10%组织匀浆按比例稀释为5%,1%和0.25%组织匀浆用于相关生化指标的检测。
1.2.4 生化指标测定 采用全自动生化分析仪依据试剂 盒 说 明 书 测 定 SOD[16]、GSH - Px[17]、MDA[18]、MAO[19]含量,蛋白定量按试剂盒说明用 BCA 法[20]测定。
1.2.5 数据处理 采用SPSS17.0统计软件进行数据分析,整体分析采用单因素方差分析法(One-way ANOVA),进一步组间比较分别采用Duncan氏多重分析法和LSD氏多重分析法。
2 结果与分析
2.1 OPCRR对小鼠体征、体重和脏器系数的影响
实验过程中,日常体征行为学观察发现:在实验初期的适应性饲养阶段,各组小鼠皮毛浓密有光泽,精神振奋,进食量大,反抗力强,难以抓取;随着实验的进行,除溶剂对照组变化较为缓慢外,其余各组均出现不同程度的过氧化损伤表征,以模型组最为明显,阳性对照组的小鼠则相对行动敏捷;至实验末期,溶剂对照组小鼠虽不如初期灵活和毛色光亮,但无明显脱毛和虚弱现象,而模型对照组则出现皮毛稀疏且少量脱毛的现象,反应迟缓,活动量锐减,四肢无力,抓取时反抗微弱,阳性对照组和各OPCRR剂量组介于两者之间。
小鼠的平均体重增长及心、肝、脑系数见表1。尽管数据软件分析发现各组间的体重增长存在不同程度差异,但无特定分布规律;溶剂对照组的脏器系数介于各组之间,虽有差别,但除去脑系数的高剂量组和心系数的中高剂量组外,各组之间比较,经统计学分析无显著性差异(p>0.05);模型对照组的脏器系数与溶剂对照无显著性差异。由此认为上述组间差异是由个体差别及环境等非实验因素造成,本文不再深入分析。
表1 小鼠体重增长和脏器系数±s)Table 1Body weight increase and apparatus coefficient of mice±s)
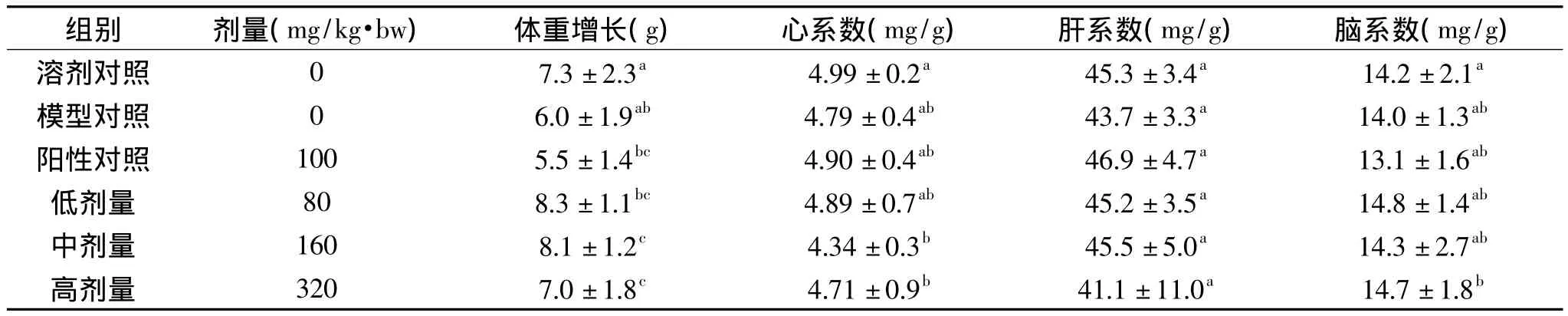
表1 小鼠体重增长和脏器系数±s)Table 1Body weight increase and apparatus coefficient of mice±s)
注:同列数值后的不同小写字母表示在0.05水平存在显著性差异。
组别 剂量(mg/kg·bw) 体重增长(g)心系数(mg/g)肝系数(mg/g)脑系数(mg/g)溶剂对照 0 7.3±2.3a 4.99±0.2a 45.3±3.4a 14.2±2.1a模型对照 0 6.0±1.9ab 4.79±0.4ab 43.7±3.3a 14.0±1.3ab阳性对照 100 5.5±1.4bc 4.90±0.4ab 46.9±4.7a 13.1±1.6ab低剂量 80 8.3±1.1bc 4.89±0.7ab 45.2±3.5a 14.8±1.4ab中剂量 160 8.1±1.2c 4.34±0.3b 45.5±5.0a 14.3±2.7ab高剂量 320 7.0±1.8c 4.71±0.9b 41.1±11.0a 14.7±1.8b
表2 OPCRR对过氧化损伤小鼠SOD水平的影响(s)Table 2 OPCRR’s effects on SOD lever of per-oxidative damage mices)
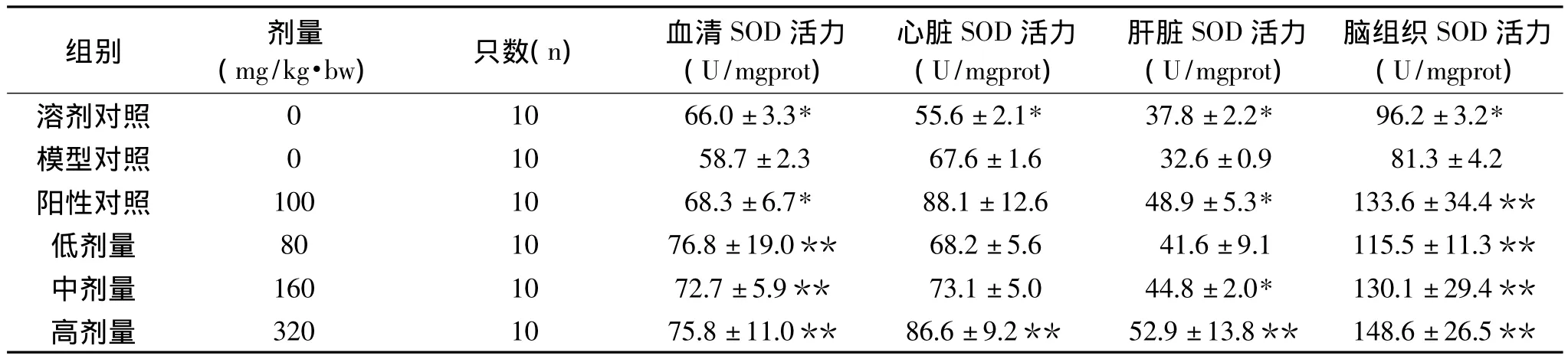
表2 OPCRR对过氧化损伤小鼠SOD水平的影响(s)Table 2 OPCRR’s effects on SOD lever of per-oxidative damage mices)
注:*表示与模型组存在的显著性差异,**表示极显著性差异,表3~表5同。
组别 剂量(mg/kg·bw)只数(n)血清SOD活力(U/mgprot)心脏SOD活力(U/mgprot)肝脏SOD活力(U/mgprot)脑组织SOD活力(U/mgprot)溶剂对照 0 10 66.0±3.3* 55.6±2.1* 37.8±2.2* 96.2±3.2*模型对照 0 10 58.7±2.3 67.6±1.6 32.6±0.9 81.3±4.2阳性对照 100 10 68.3±6.7* 88.1±12.6 48.9±5.3* 133.6±34.4**低剂量 80 10 76.8±19.0** 68.2±5.6 41.6±9.1 115.5±11.3**中剂量 160 10 72.7±5.9** 73.1±5.0 44.8±2.0* 130.1±29.4**高剂量 320 10 75.8±11.0** 86.6±9.2** 52.9±13.8** 148.6±26.5**
表3 OPCRR对过氧化损伤小鼠GSH-Px水平的影响s)Table 3 OPCRR’s effects on GSH-Px lever of per-oxidative damage mices)
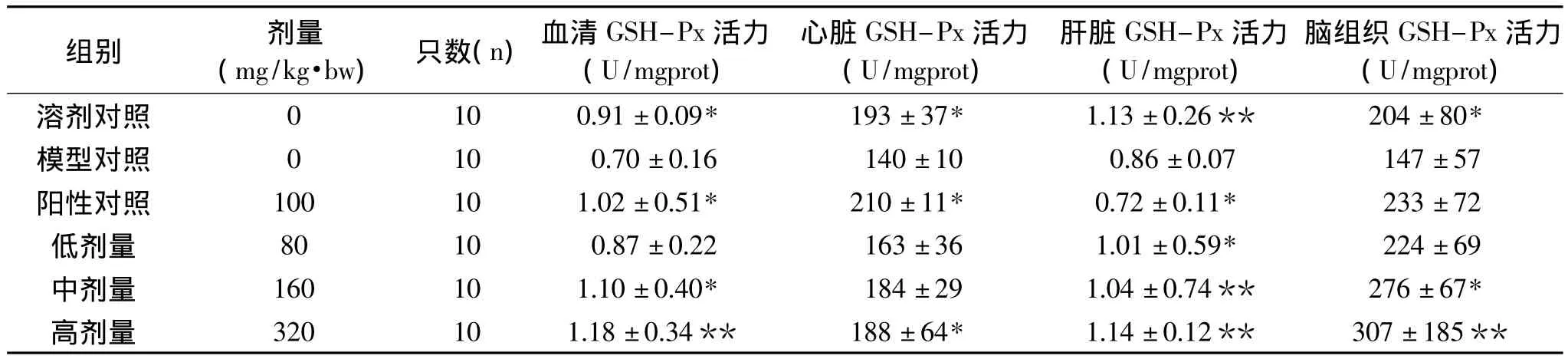
表3 OPCRR对过氧化损伤小鼠GSH-Px水平的影响s)Table 3 OPCRR’s effects on GSH-Px lever of per-oxidative damage mices)
组别 剂量(mg/kg·bw)只数(n)血清GSH-Px活力(U/mgprot)心脏GSH-Px活力(U/mgprot)肝脏GSH-Px活力(U/mgprot)脑组织GSH-Px活力(U/mgprot)溶剂对照 0 10 0.91±0.09* 193±37* 1.13±0.26** 204±80*模型对照 0 10 0.70±0.16 140±10 0.86±0.07 147±57阳性对照 100 10 1.02±0.51* 210±11* 0.72±0.11* 233±72低剂量 80 10 0.87±0.22 163±36 1.01±0.59* 224±69中剂量 160 10 1.10±0.40* 184±29 1.04±0.74** 276±67*高剂量 320 10 1.18±0.34** 188±64* 1.14±0.12** 307±185**
2.2 对过氧化损伤小鼠SOD水平的影响
表2表示OPCRR对小鼠血清及脏器中SOD活力的影响。模型对照组与溶剂对照均差异显著(p<0.05),说明本模型条件下血清及各脏器组织在SOD活力水平方面体现了过氧化损伤特征。与模型对照组相比,阳性对照组、OPCRR各剂量组均能升高血清SOD活力水平,其中OPCRR低中高三个剂量组均差异极显著(p<0.01);与模型对照组相比,OPCRR低、中剂量组有升高心脏SOD活力水平的趋势,但是无显著性差异(p>0.05),OPCRR高剂量组能极显著升高心脏SOD活力水平(p<0.01);与模型对照组相比,OPCRR低剂量组有升高肝脏SOD活力水平的趋势,但是无显著性差异(p>0.05),OPCRR中剂量组能显著升高肝脏SOD活力水平(p<0.05),OPCRR高剂量组能极显著升高肝脏SOD活力水平(p<0.01);与模型对照组相比,阳性对照组、OPCRR各剂量组均能升高脑组织SOD活力水平,且均差异极显著性(p<0.01)。
2.3 对过氧化损伤小鼠GSH-Px水平的影响
表3表示OPCRR对小鼠血清及脏器中GSH-Px活力的影响。模型对照组与溶剂对照均差异显著(p<0.05),说明本模型条件下血清及各脏器组织在GSH-Px活力水平方面体现了过氧化损伤特征。与模型对照组相比,OPCRR低剂量组有升高血清GSH-Px活力水平的趋势,但是无显著性差异(p>0.05),OPCRR中剂量组能显著升高血清GSH-Px活力水平(p<0.05),OPCRR高剂量组能极显著升高血清GSH-Px活力水平(p<0.01);与模型对照组相比,OPCRR低中剂量组有升高心脏GSH-Px活力水平的趋势,但是无显著性差异(p>0.05),OPCRR高剂量组能显著升高心脏GSH-Px活力水平(p<0.05);与模型对照组相比,OPCRR低剂量组有显著升高肝脏GSH-Px活力水平的趋势(p<0.05),OPCRR中高剂量组能极显著升高肝脏 GSH-Px活力水平(p<0.01);与模型对照组相比,OPCRR低剂量组有升高脑组织GSH-Px活力水平的趋势,但是无显著性差异(p>0.05),OPCRR中剂量组能显著升高脑组织GSH-Px活力水平(p<0.05),OPCRR高剂量组能极显著升高脑组织GSH-Px活力水平(p<0.01)。
表4 OPCRR对过氧化损伤小鼠MDA水平的影响s)Table 4 OPCRR’s effects on MDA lever of per-oxidative damage mice(s)
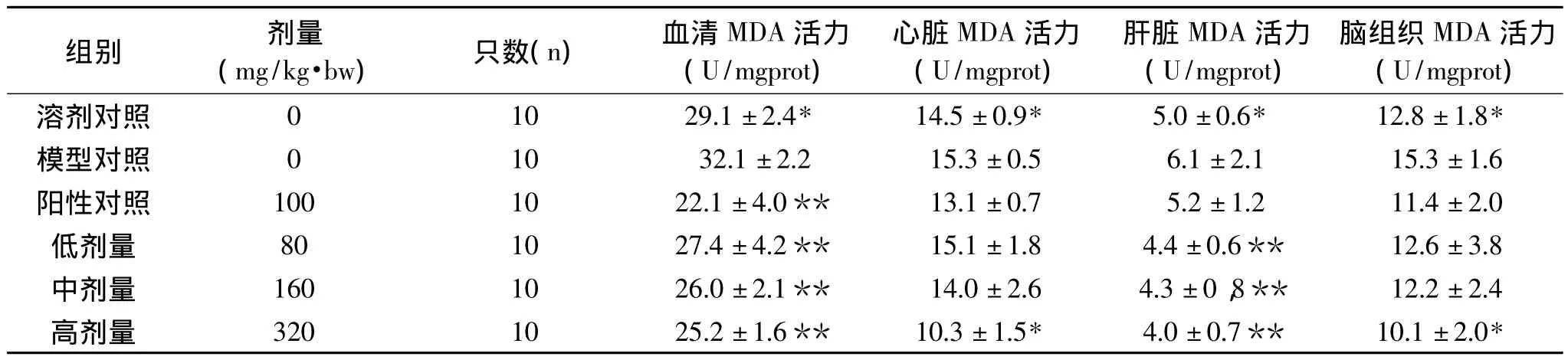
表4 OPCRR对过氧化损伤小鼠MDA水平的影响s)Table 4 OPCRR’s effects on MDA lever of per-oxidative damage mice(s)
组别 剂量(mg/kg·bw)只数(n)血清MDA活力(U/mgprot)心脏MDA活力(U/mgprot)肝脏MDA活力(U/mgprot)脑组织MDA活力(U/mgprot)溶剂对照 0 10 29.1±2.4* 14.5±0.9* 5.0±0.6* 12.8±1.8*模型对照 0 10 32.1±2.2 15.3±0.5 6.1±2.1 15.3±1.6阳性对照 100 10 22.1±4.0** 13.1±0.7 5.2±1.2 11.4±2.0低剂量 80 10 27.4±4.2** 15.1±1.8 4.4±0.6** 12.6±3.8中剂量 160 10 26.0±2.1** 14.0±2.6 4.3±0,8** 12.2±2.4高剂量 320 10 25.2±1.6** 10.3±1.5* 4.0±0.7** 10.1±2.0*
2.4 对过氧化损伤小鼠MDA水平的影响
表4表示OPCRR对小鼠血清及脏器中MDA含量的影响。模型对照组与溶剂对照均差异显著(p<0.05),说明本模型条件下血清及各脏器组织在MDA含量方面体现了过氧化损伤特征。与模型对照组相比,阳性对照组、OPCRR各剂量组均能降低血清MDA含量且均差异极显著(p<0.01);与模型对照组相比,OPCRR低中剂量组有降低心脏MDA含量的趋势,但是无显著性差异(p>0.05),OPCRR高剂量组能显著降低心脏MDA含量(p<0.05);与模型对照组相比,OPCRR各剂量组均能降低肝脏MDA含量且均差异极显著性(p<0.01);OPCRR低中剂量组有降低心脏MDA含量的趋势,但是无显著性差异(p>0.05),OPCRR高剂量组能显著降低心脏MDA含量(p<0.05)。
2.5 对过氧化损伤小鼠MAO水平的影响
表5表示OPCRR对小鼠脑组织和肝脏中MAO活力的影响。模型对照组与溶剂对照均差异显著(p<0.05),说明本模型条件下肝脏及脑组织在MAO含量方面体现了过氧化损伤特征。与模型对照组相比,OPCRR低剂量组有降低脑组织MAO活力水平的趋势,但是无显著性差异(p>0.05),OPCRR中高剂量组能极显著降低脑组织MAO活力水平(p<0.01);与模型对照组相比,OPCRR低中剂量组有降低肝脏MAO活力水平的趋势,但是无显著性差异(p>0.05),OPCRR高剂量组能显著降低肝脏MAO活力水平(p<0.05)。
表5 OPCRR对过氧化损伤小鼠MAO水平的影响(s)Table 5 OPCRR’s effects on MAO lever of per-oxidative damage mice(s)
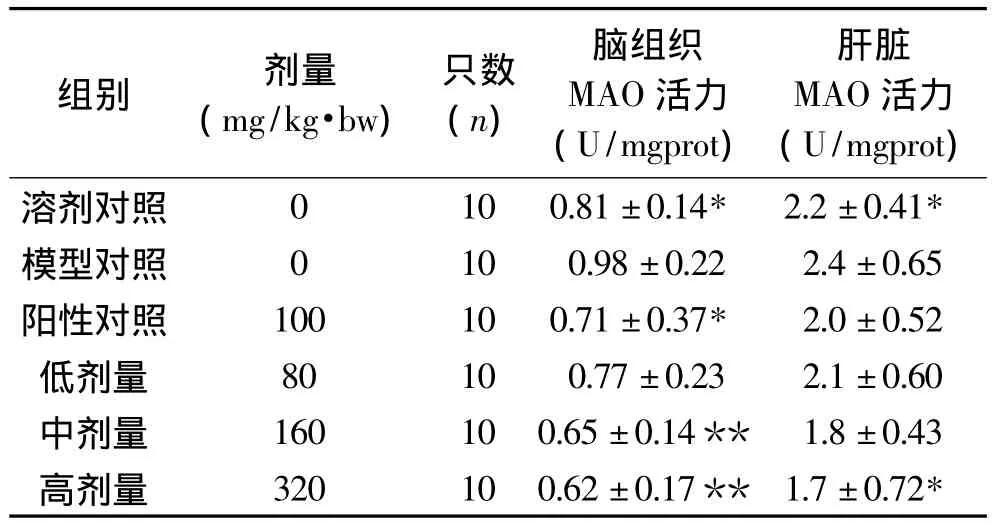
表5 OPCRR对过氧化损伤小鼠MAO水平的影响(s)Table 5 OPCRR’s effects on MAO lever of per-oxidative damage mice(s)
组别 剂量(mg/kg·bw)只数(n)脑组织MAO活力(U/mgprot)肝脏MAO活力(U/mgprot)溶剂对照 0 10 0.81±0.14* 2.2±0.41*模型对照 0 10 0.98±0.22 2.4±0.65阳性对照 100 10 0.71±0.37* 2.0±0.52低剂量 80 10 0.77±0.23 2.1±0.60中剂量 160 10 0.65±0.14** 1.8±0.43高剂量 320 10 0.62±0.17** 1.7±0.72*
3 结论与讨论
本实验利用D-gal建立小鼠过氧化损伤模型,以小鼠血清和心、肝、脑组织的SOD、GSH-Px活性、MDA及肝、脑MAO活性为检测指标,结果表明,与模型对照组相比,160~320mg/kg·bw OPCRR对主要脏器中SOD、GSH-Px活性的提高作用优于阳性对照,降低MDA含量的能力优于阳性对照,并不同程度降低脑组织和肝脏中MAO活力。
张明月等[21-22]研究表明,葡萄籽原花青素可提高小鼠全血SOD活力,降低MDA含量,并且提高脏器SOD、GSH-Px等抗氧化酶的活力,显示出其具有极强的抗过氧化损伤能力。张泽生等[23]发现50mg/kg·bw葡萄籽提取物可显著提高D-gal致氧化损伤小鼠血清SOD活性。Bagchi等[24]研究表明补充葡萄籽提取物可以改善心肌功能,减少MDA生成。葡萄籽提取物也可以保护小鼠由阿霉素诱导的心肌损伤[25]。本研究表明OPCRR在320mg/kg·bw的剂量下,可有效防止D-gal导致的小鼠心脏SOD的活性下降,使其活性提高28.1%。证明OPC对动物的心肌有保护作用,补充OPCRR可以改善心肌功能。Bagchi等[25]发现在100mg/kg·bw剂量下葡萄籽提取物OPC、VC、VE和β-胡萝卜素均可降低TPA(12-O-four sunflower acyl Buddha alcohol-13-acetate)诱导腹腔巨噬细胞产生的活性氧,且葡萄籽提取物OPC的作用优于其他抗氧化剂。张波等[26]发现葡萄籽提取物OPC在剂量为100mg/kg·bw时,可减少乙醇性肝损伤小鼠肝组织中MDA含量,SOD含量明显上升。张琳等[27]研究表明缺血再灌注会导致肝脏氧自由基清除不足并引发脂质过氧化反应,而300mg/kg·bw OPC预处理则可通过增强细胞的SOD活性,而减轻脂质过氧化反应。本研究证明OPCRR在80mg/kg·bw时,可明显增加小鼠肝组织GSH-Px活力,提高7.9%,并使MDA含量下降31.8%。说明OPCRR与葡萄籽OPC比较,在较低剂量下即具有保护肝脏对抗脂质过氧化的能力。刘玉梅等[28]考察葡萄籽原花青素(GSP)对小鼠脑组织过氧化损伤的保护作用。结果证明,96%的 GSP在剂量为20mg/kg·bw时,可抑制由D-gal所致的小鼠脑组织SOD、GSH-Px活力的下降,以及MDA含量的升高。本研究证明OPCRR在320mg/kg·bw时,可显著增加小鼠脑组织GSH-Px活力,提高50.3%,并使MDA含量下降了33.7%。此外,Koga等一次性给予禁食大鼠GSP 25mg/kg·bw,研究其对大鼠血浆抗氧化水平的影响[29],表明口服GSP可增加大鼠抗氧化能力。本研究发现,OPCRR在80mg/kg·bw时,可显著增加小鼠血清SOD活力,提高31.6%,在160mg/kg·bw时,显著提高血清GSH-Px活力,提高65.5%,MDA含量下降了19.1%。
综上,蔷薇红景天低聚原花青素有很好的抗氧化活性,通过增强机体清除氧自由基的能力,减少体内自由基产生,进而保护细胞免受过氧化损伤。与模型对照组相比,OPCRR实验组能提高血清及脏器中SOD、与GSH-Px活力,并降低MDA含量与MAO活力,由此可见,OPCRR可以从多个角度减轻小鼠的过氧化损伤状态,其机制与过氧化损伤老龄动物的抗氧化水平有关,而最佳作用条件还有待进一步探索。
[1]蓝晓红.红景天的现代研究与进展[J].中国新医药,2003,2(2):27-28.
[2]袁瑜,张良,李玉锋,等.红景天活性成分及药理作用[J].食品与药品,2007,9(5):54-57.
[3]金萍 .红景天的研究现状[J].光明中医,2011,26(7):1508-1511.
[4]GadG Yousef,MaryH Grace,DianaM Cheng,et al.Comparative phytochemical characterizeation of three Rhodiola species[J].Phytochemistry,2006,67:2380-2391.
[5]A Panossian,G Wikman,J Sarris.Rosenroot(Rhodiola rosea):Traditional use,chemical composition,pharmacology and clinical efficacy[J].Phytomedicine,2010,17:481-493.
[6]Zhao W,Meng YC,Yin ZP,et al.Study on the isolation and purification of proanthocyanidins from Rhodiola rose by macroporous adsorbent resin[J].Advanced Materials Research,2011,236-238:2053-2057.
[7]孟玉彩,赵文,郭潇,等.蔷薇红景天中原花青素提取与纯化研究[J].农业工程技术 .农产品加工,2007(7):48-51.
[8]郑建仙.功能食品[M].北京:中国轻工业出版社,1995.
[9]敬璞,丁晓雯,苏晔.柑桔皮水提液在小鼠体内的抗氧化作用研究[J].西南农业大学学报:自然科学版,2003,25(3):265-266
[10]Bokov A,Chaudhuri A,Richardson A,et al.The role of oxidative damage and stress in aging[J].Mechanism of Aging and Development,2004,125(6):811-826.
[11]Giardino R,Giavaresi G,Fini M,et al.The role of different chemical modifications of superoxide dismutase inprevent-ing a prolonged muscular ischemia/reperfusion injury[J].ArtifCells Blood Substit ImmobilBiotechnol,2002,30(3):189-198.
[12]周俭.保健食品设计原理及其应用[M].北京:中国轻工业出版社,1998:28-8.
[13]Fuhrman B,Volkbva N,Rosenblat M,et al.Lycopene synergistically inhibits LDL oxidation in combination with vitamin E,glabridin,rosmarinic acid,carnosic acid,or garlic[J].Antioxid Redox Signal,2000,2(3):491-506.
[14]秦红兵,杨朝晔,范忆江,等.D-半乳糖诱导衰老小鼠模型的建立与评价[J].中国组织工程研究与临床康复,2009,13(7):1275-1278.
[15]赵文.一种蔷薇红景天原花青素的制备方法:中国:CN 2011100915740[P].2013-08-14.
[16]Peskin AV,Winterbourn CC.A microtiter plate assay for superoxide dismutase using a water-soluble tetrazolium salt(WST-1)[J].Clin Chim Acta,2000,293(1-2):157-166.
[17]Wendel A.Glutathione peroxidase[J].Method enzymol,1981,77:325.
[18]FernandezJ,Perez- AlvarezJ,Fernandez- Lopez J.Thiobarbituric acid test for monitoring lipid oxidation in meat[J].Food chemistry,1997,59(3):345-353.
[19]Bortolato M,Chen K,Shih JC.Monoamine oxidase inactivation:from pathophysiology to therapeutics[J].Advanced drug delivery reviews,2008,60(9):1527-1533.
[20]Brown RE,Jarvis KL,Hyland KJ.Protein measurement using bicinchoninic acid:elimination of interfering substances[J].Anal biochem,1989,180(1):136-139.
[21]张明月,郑爱英,赵春红,等.葡萄籽提取物原花青素对溴苯诱导小鼠肝过氧化损伤拮抗作用研究[J].现代预防医学,2008,35(1):55-56.
[22]尹进,胡怡秀,胡余明,等.葡萄籽提取物对小鼠MDA、SOD和GSH-Px的影响[J].中国热带医学,2007,7(8):1285-1286.
[23]张泽生,郭莹,刘琳,等.山楂提取物对D-半乳糖致衰小鼠抗氧化系统的影响[J].食品研究与开发,2009,30(5):1-2.
[24]BagchiD.Oxygen free radicalscavenging abolitionsof Vitamins C and Vitamins E,and a grape seed proanthocyanidin extract in vitro research[J].Communications in Molecular Pathology and Pharmacology,1997,95(2):179.
[25]Bagchi D,bagchi M,Stohs SJ,et al.Free radicals and grape seed proanthocyanidin extract:importance in human health and disease prevention[J].Toxicology,2000,148(2-3):187-197.
[26]张波,沈新南,张亚东,等.原花青素对小鼠乙醇性肝损伤的保护作用机制[J].卫生研究,2007,26(3):295~298.
[27]张琳,买买提祖农.买苏尔,袁一木,等.葡萄籽原花青素对大鼠肝缺血再灌注损伤的抗氧化作用研究[J].新疆医科大学学报,2010,33(2):121-123.
[28]刘玉梅,张自强,邓雯,等.葡萄籽原花青素对小鼠脑组织氧化损伤的保护作用[J].食品科学,2009,30(21):374-376.
[29]Koga T,Moro K,Nakamori K,et al.Increase of antioxidative potential of rat plasma by oral administration of proanthocyanidin-rich extract from grape seeds[J].Agric Food Chem,1999,47(5):1892-7.

