水滑石类化合物及其在腐蚀防护应用中的研究进展
陈 君1,张勤勇1,宋影伟,单大勇,韩恩厚
(1.西华大学先进材料及能源研究中心,四川 成都 610039;2.中国科学院金属研究所材料环境腐蚀中心,辽宁 沈阳 110016)
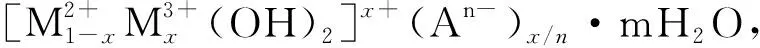
水滑石类化合物的主体层板内有较强的共价键存在,而层间则是一种弱的相互作用力;层间阴离子通过氢键、范德华力、静电作用等与层板结合,因此HTs层间阴离子具有可交换性。这些特殊的结构使此类材料具有许多独特的性质,人们可以利用这些性能对水滑石进行调控,制备出具有不同用途和性能的水滑石功能材料,在催化、吸附、医药、军工、防腐材料等很多领域具有极大的应用潜力。本文重点介绍水滑石类化合物的性质、制备及其在腐蚀应用方面的研究进展,以引起广大工程技术人员对水滑石膜层在腐蚀防护应用方面的重视和关注。
1 水滑石的性质
水滑石的主体层板和层间客体的组成和结构的特殊性,赋予它众多独特的性能,主要具有以下一些性质。
1)层板组成的可变性。组成水滑石层板的M2+或M3+可用其他的金属离子代替,形成新的层状类水滑石物质。一般地,只要金属阳离子的离子半径适宜,就可形成HTs层板。其中研究较多的M2+有Mg2+、Zn2+、Ca2+、Cu2+、Fe2+、Co2+、Ni2+等,M3+有Al3+、Cr3+、Fe3+、Ga3+、Co3+、Ln3+(稀土金属离子)等。M3+取代M2+的范围是0.20≤x≤0.33(x为M3+/(M2++M3+)的摩尔比),即在结构稳定的HTs组成中,M2+和M3+物质的量之比为4/1~2/1,因此,HTs的层板化学组成具有很强的可调控性。
2)层间阴离子的可交换性。水滑石的主体层板和层间阴离子通过弱化学键如氢键等连接,因此层间阴离子易于与外来阴离子交换,但是对外来阴离子的种类具有选择性。利用水滑石的这一性能可将各种阴离子(无机、有机、配合物等)引入层间,以获得具有不同功能的材料[4]。关于无机物插层的离子交换能力已经得到较为广泛和深入的研究,可用体积较大的阴离子去取代体积较小的阴离子,以此来改变层间距获得更多的反应空间,并暴露更多的活性中心。离子的交换能力及交换后层间阴离子的量、排列状况等可通过主体层板的M2+/M3+比值来进行调控[4]。
3)晶体粒径的可控性。根据晶体学理论,调变水滑石形核时溶液的浓度、温度可控制晶体的成核速率;调变溶液浓度和温度,以及晶化的时间,可控制晶体的生长速率:因此,水滑石的晶粒尺寸及分布可以在较宽范围内进行调控[5-6]。
4)记忆效应。水滑石物质在一定温度下焙烧一定时间后,煅烧后的化合物可重新吸收水和阴离子,其结构可部分或全部恢复到有序层状的水滑石结构。一般而言,焙烧温度在500 ℃以内,结构的恢复是可能的,以Mg/A1-HTs为例,温度在500 ℃内的焙烧产物接触水后,其结构部分恢复[7]。
5)碱性及低表面能。水滑石层板上存在大量的氢氧基团,是弱碱性化合物,具有丰富的碱中心,可作为催化剂载体或固体碱催化剂应用于多种催化反应中;另外,水滑石因其特殊的层状结构,表现出较低的表面能:因此在制备时无需辅助剂或高能耗的生产设备,便可获得具有纳米尺寸的水滑石,而且在应用时易于均匀分散,不易聚集[8]。
2 水滑石的制备方法及其优缺点
水滑石一般主要通过盐和碱、盐和氧化物反应以及离子交换反应制得。为了制得理想的水滑石类材料,国内外研究工作者做了大量的探索工作,通过改变合成路线、优化合成工艺条件,衍生出不同的制备方法。
2.1 共沉淀法
共沉淀法是通过金属盐的混合溶液与碱金属氢氧化物反应来获得水滑石,它是最为常用的方法。其中金属盐可用硝酸盐、氯化物、硫酸盐和碳酸盐等,碱可以用氨水、氢氧化钠、氢氧化钾等。
共沉淀法最主要的优点是适用范围广。几乎所有的水滑石物质都可用共沉淀法制备,只要调整M2+和M3+的原料比,就可制备出一系列[M2+]/[M3+]比值不同的水滑石物质;也可通过选择不同种类的阴离子,制备一系列具有相同金属离子但阴离子不同的水滑石。只有在盐类不可溶或金属离子在碱性介质中不稳定的情况下,才无法使用共沉淀法;但是共沉淀法耗时长(一般需要6~168 h不等),结晶度也不够理想,还会产生大量的废弃物[9-13]。
2.2 离子交换法
离子交换法是当某些类水滑石成分不能直接用共沉淀法制备时,可先用共沉淀法制备出不同阴离子的类水滑石,然后用所需的阴离子去交换原有阴离子,得到所需的水滑石;因此,可以说离子交换法是共沉淀法的一种补充。最近,Poznyak等[14]通过离子交换法,将有机缓蚀剂喹哪啶(QA)和巯基苯并噻唑(MBT)添加到水滑石中,所得的涂层具有很好的防腐效果。主要是因为这些缓蚀性有机阴离子能从水滑石膜中释放出来,起到了很好的抑制腐蚀的作用。
但离子交换法的使用会受一些因素的限制。1) 一般地,不能用交换能力低的阴离子去取代具有高交换能力的阴离子。常见无机阴离子的交换顺序为CO32->SO42->HPO4->OH->F->Cl->Br->NO3-,高价阴离子易于交换进入水滑石的插层中间,而低价阴离子则易于被置换出来[15]。2) 水滑石主体层板的组成对离子交换反应也会产生一定的影响,如Mg-Al、Zn-Al系列水滑石通常容易进行离子交换,而Ni-Al则较难。这种交换能力的差异与水滑石中水分子的结合形态有关,层间结合水较少时则有利于交换,而表面结合水较多时则不利于交换[16]。
离子交换法是合成较大插层阴离子水滑石的重要方法,而且通过控制反应条件,不仅可维持水滑石化合物原有的晶体结构,还可对层间阴离子的数量和种类进行设计和组装;但能用离子交换法来制备的水滑石种类是有限的,而且耗时。
2.3 水热合成法
水热合成法是通过将含有构成水滑石主体层板的金属离子的氧化物或氢氧化物(如MgO、Al2O3、Mg(OH)2、Al(OH)3等),与混合碱溶液在高温高压下进行水热处理后,由金属氧化物或氢氧化物进行原子重排最终获得水滑石。水热法最大的优点是通过高温高压可有效控制晶相及晶粒尺寸,获得的水滑石层状结构明显,晶相结构完整,结晶度高[17]。
2.4 尿素法
尿素法是利用尿素在溶液温度超过90 ℃时会发生分解的这一特点,通过将分解出的氨溶于水中提供共沉淀的碱性环境,而分解出的CO2溶于水形成CO32-进入层间,从而最终形成HTs/CO32-。该方法的主要优点是溶液内部的pH值始终保持稳定,因而可以制备出高结晶度的Mg-Al、Ni-Al、Zn-Al类水滑石,但难以合成Co-Al、Co-Cr、Mn-Al等类水滑石[18]。曾虹燕等[19]分别采用尿素法和滴定共沉淀法制备了镁铝水滑石,发现尿素法制备的水滑石结晶度高、晶粒规整均匀,其催化活性明显好于过饱和法制备的镁铝水滑石。
2.5 原位生长法
原位生长法是在金属基体表面直接生长一层薄膜。原位生长水滑石膜与制备水滑石粉体的重要不同之处在于,金属基体成分在成膜液中发生溶解反应,并参与成膜过程,导致水滑石膜的生长过程更加复杂。水滑石类材料需要在pH>10.5的碱性条件下生成[20],锌和铝都是两性金属,可在碱性溶液中发生溶解反应生成Al3+或Zn2+。这些离子再与溶液中添加的其他组分结合形成水滑石涂层直接生长在基体表面;因此,在锌或铝基合金上原位生长水滑石膜要容易得多,已有不少关于在纯铝、铝合金、氧化铝基体以及覆盖有铝/锌涂层的玻璃基板/不锈钢基体上原位生长Li-Al、Mg-Al、Ni-Al或Zn-Al水滑石膜的报道[12,21-25]。如Chen等[22-23]采用原位生长法将阳极氧化铝/铝基片置于可溶性二价金属离子溶液(0.1 mol·L-1的Zn(NO3)2·6H2O和0.6 mol·L-1的NH4NO3)中,缓慢添加1%的氨水溶液直至pH值达到6.5。在45 ℃水浴中保温36 h,利用基片表面的铝源获得薄膜,膜与基体具有较好的结合力和机械强度,经过简单的化学处理可以得到具有超疏水性的薄膜。在镁合金表面制备水滑石涂层的方法与在铝、锌合金上的不同。镁在碱性溶液中是惰性的,不能溶解生成Mg2+;因此在镁基体上原位生长水滑石膜更为复杂,对成膜液的要求也特别苛刻。需要将整个成膜过程分成2个阶段完成:首先在酸性溶液中快速生成水滑石前驱体膜,然后在碱性溶液中使前驱体膜转化成稳定的水滑石涂层。已经有在镁合金上原位生长水滑石膜的成功例子,Lin等[26-28]通过将AZ91合金浸泡在50 ℃的饱和碳酸溶液中,基体腐蚀溶解,这样就提供了成膜所需的Mg2+和Al3+,随着析氢反应和基体的腐蚀,溶液pH值升高,达到成膜所需的碱性条件;但他们的研究方法不适合在含铝量低的镁合金上成膜,只适合高铝含量的镁合金。Chen等[29]通过在饱和碳酸溶液中滴加溶有饱和Al化合物的Na2CO3溶液的方法来添加Al成分,成功在AZ31这种低Al含量的镁合金上原位生长出Mg-Al水滑石膜。
共沉积法得到的薄膜与基体的结合力比较弱,当膜较厚时,很容易从基体上脱落。通过原位生长法得到的薄膜是直接附着在基体上的,由于存在化学键合,因此膜与基体结合得更好[30]。另外,原位生长法方法简单、易于操作,受到人们越来越多的关注。
2.6 其他合成方法
微波照射法[31]:用电磁波进行加热,频率范围在300 MHZ~300 GHz之间,与传统的加热方法比,可大大节省制备时间。利用该法制得的HTs往往具有更大的比表面以及更大的催化活性。Fetter等[32]控制pH值在10.5附近,微波功率为180~360 W,获得了大比表面的水滑石。
溶胶-凝胶法[31]:用金属醇盐或非醇盐先生成前驱物,在一定条件下水解形成溶胶,再制成凝胶后,经干燥、热处理最终获得所需的纳米粒子。
机械-化学法[13]:通过碾磨或手工研磨转化合成HTs,该法可让固体反应物直接发生反应,无需水溶液,这样就避免了大量溶液的调制、废气排放和废水处理等问题,而且无需加热处理,可简便、快速得获得HTs。
另外,还有成核-晶化隔离法、诱导水解法和焙烧还原法等制备方法[33]。
3 水滑石作为耐腐蚀材料的研究
水滑石层间阴离子的种类在较宽范围内可调变,环境中的腐蚀性阴离子能与层间阴离子交换而被截留在水滑石层间,避免了与基体直接接触,从而起到减缓腐蚀的效果,加上其表面的疏水性等特性使其在腐蚀领域具有潜在的应用前景。另外,原位生长法制备的膜层与基体间存在化学键,膜/基结合良好,可以通过在金属表面原位生长水滑石膜的方法来改善金属的耐蚀性。
最初是在Al或Zn合金上原位制备类水滑石膜以提高基体的耐蚀性,因此关于这方面的研究报道较多。赵丽丽等[34]将铝合金浸泡在硝酸铵和硝酸锌混合溶液中36 h后,在铝合金表面原位生长出ZnAl类水滑石涂层,在3.5% NaCl溶液中浸泡12天后,涂层表面没有出现明显的腐蚀破坏现象。Zhang[35]用同样方法在氧化铝/铝(PAO/Al)基体上获得ZnAl-LDH-NO3膜,并利用月桂酸根离子置换出硝酸根离子,得到ZnAl-LDH-laurate膜,该膜极大地提高了PAO/Al的耐蚀性,使其腐蚀电流密度降低到1 nA·cm-2,并具有自愈合功能。Buchheit等[36-37]也通过类似的浸泡方法分别在镀锌钢和铝合金表面原位生长出ZnAl类水滑石涂层,其耐蚀性与铬酸盐相当,也具有自愈合能力。可见,金属表面原位生长水滑石膜可以在很大程度上改善材料的耐蚀性,是一种极具应用潜力的防护方法。
但水滑石膜用于镁合金防护的研究报道不多[26-28,38-48],关于镁合金表面原位生长水滑石膜的研究则更少。Wang等[38]采用水热合成法在AZ31D镁合金上制备出MgAl水滑石膜,该膜降低了基体的自腐蚀电流密度,使其从5.364 μA/cm2降低到1.467 μA/cm2,提高了镁合金的耐蚀性;但随着浸泡时间的延长,逐渐失去其防护效果。而最初使用原位生长法在镁合金上制备水滑石膜的人是Lin等[26-28],他们报道了在AZ91镁合金上原位生长出MgAl水滑石膜,在0.6 M的NaCl溶液浸泡60 h后膜表面并未见明显损坏,并通过改进成膜工艺后,使成膜时间缩短为4 h。该膜经72 h盐雾腐蚀试验后表面没有腐蚀坑,而普通的镁合金转化膜仅经过24 h盐雾试验后就严重破损。Chen等[46]采用两步法在低Al含量的AZ31镁合金表面也原位生长出优质的Mg-Al水滑石膜。该膜非常致密、均匀,能对AZ31合金起到很好的防护作用。另外,他们还采用植酸改性来能提高水滑石膜的耐蚀性,尽管自腐蚀电位降低了,但减少了腐蚀电流密度。植酸处理能有效地提高膜的阻挡层作用,并且具有减缓腐蚀发展的效果。该膜大大延长了点蚀萌生的时间,其优异的稳定性可能与磷酸盐缓蚀剂的释放有关[47]。Ishizaki等[48]采用蒸汽原位生长的方法,将AZ31镁合金放置在423 K的高压釜中6 h,获得了80 μm厚的MgAl水滑石和Mg(OH)2的复合涂层,该涂层具有非常优异的耐蚀性,使基体的腐蚀电流密度降低了至少6个数量级。
关于水滑石膜改善镁合金耐蚀性的机制,尚没有得到统一认识。Lin等[27]认为水滑石膜能提高镁合金耐蚀性的原因之一是Cl-能交换出水滑石层间阴离子CO32-,抑制了Cl-的侵蚀作用。这与文献[15]矛盾,究其原因可能是腐蚀介质中添加了CaCl2,Ca容易与CO32-形成CaCO3沉淀,才使得Cl-置换出CO32-。Kuzawa等[49]的实验结果也证实,添加CaCl2后形成了磷酸钙沉淀物,会覆盖在表面。关于腐蚀机制的另一研究来自Yi等[39],他们相信CO32-与主体层板的高亲和力会阻止Cl-的攻击;但由于CO32-在NaCl溶液中会不断减少,Cl-取代进入水滑石插层中间也是有可能的,因此,他们也认同Lin等的观点,认为水滑石膜优异的耐蚀性归功于CO32-与Cl-在含氯的腐蚀介质中的交换作用,而且不改变水滑石的双层结构。Chen等[46]近期研究了Cl-的取代或吸附效应,发现水滑石在NaCl溶液中,Cl-不能取代CO32-,只有先排除CO32-,Cl-才有可能进入到插层中间以平衡电荷;因此,水滑石膜的防腐机制主要是基于其疏水性和阻挡层的作用,Cl-会吸附到膜表面加速腐蚀。
4 未来研究方向
水滑石具有复杂的层状结构,具有很多独特的性能,一直备受关注,被应用到很多领域;另外,其层间阴离子的可交换性使其耐蚀机制与众不同。综合上述报道,对水滑石膜的研究将有可能在以下方向继续开展:
1)原位生长水滑石是一种新型的防护手段,目前主要应用在Mg-Al系列的镁合金上,调整工艺后,有望在各种系列镁合金上原位生长优质水滑石膜;
2)水滑石膜改善金属耐蚀性的机制还存在争议,而且不同服役环境(腐蚀介质)下,可能会表现出不同的腐蚀现象,揭示水滑石膜在特定介质下的腐蚀机制是一个重要的方向;
3)水滑石具有很多独特的性能,可以充分发挥其优势,扩大其应用范围。
[1]唐玉菲, 吴茂英, 罗勇新. 水滑石的结构特性及作为塑料助剂的应用[J]. 化工科技, 2006, 14(2): 65-74.
[2]Evans D G, Slade R C T. Structural Aspects of Layered Double Hydroxides[J]. Structure and Bonding, 2006, 119: 1-87.
[3]Williams G R, O’Hare D. Towards Understanding, Control and Application of Layered Double Hydroxide Chemistry[J]. Journal of Materials Chemistry, 2006, 16(30): 3065-3074.
[4]Taviot-Gueho C, Feng Y J, Williams G R, et al. Selective Anion-exchange Properties of Second-stage Layered Double Hydroxide Heterostructure[J]. Chemistry Materials, 2006, 18(18): 4312-4318.
[5]陈天虎, 庆承松, 谌香秀, 等. 物理化学条件对合成Mg/A1-LDH结晶度和结构的影响[J]. 岩石矿物学杂志, 2005, 24(4): 324-328.
[6]冯桃, 李殿卿, 段雪. 层状双金属氢氧化物晶粒尺寸的控制[J]. 应用化学, 2003, 20(2): 117-120.
[7]刘鑫, 舒万艮, 桂客, 等. 十二烷基苯磺酸柱撑类水滑石的热稳定性研究[J]. 中国塑料, 2004, 18(10): 70-72.
[8]杨飘萍, 吴通好. 水滑石的结构性质合成及催化作用[J]. 石化技术与应用, 2005, 23(1): 161-166.
[9]Guo X X, Zhang F Z, Xu S L, et al. Effects of Varying the Preparation Conditions on the Dielectric Constant of Mixed Metal Oxide Films Derived From Layered Double Hydroxide Precursor Films[J]. Industrial and Engineering Chemistry Research, 2009, 48(24): 10864-10869.
[10]Goha K H, Lim T T, Banas A, et al. Sorption Characteristics and Mechanisms of Oxyanions and Oxyhalides Having Different Molecular Properties on Mg/Al Layered Double Hydroxide Nanoparticles[J]. Journal of Hazardous Materials, 2010, 179(1/3): 818-827.
[11]Li K W, Kumad N, Yonesaki Y, et al. The pH Effects on the Formation of Ni/Al Nitrate Form Layered Double Hydroxides (LDHs) by Chemical Precipitation and Hydrothermal Method[J]. Materials Chemistry and Physics, 2010, 121(1/2): 223-229.
[12]Lü Z, Zhang F Z, Lei X D, et al. In Situ Growth of Layered Doublehydroxide Films on Anodic Aluminum Oxide/aluminum and Its Catalytic Feature in Aldol Condensation of Acetone[J]. Chemical Engineering Science, 2008, 63(16): 4055-4062.
[13]Ay A N, Zümreoglu-Karan B, Mafra L. A Simple Mechanochemical Route to Layered Double Hydroxides: Synthesis of Hydrotalcite-like Mg-Al-NO3-LDH by Manual Grinding in a Mortar[J]. Zeitschrift fur Anorganische und Allgemeine Chemie, 2009, 635(9/10): 1470-1475.
[14]Poznyak S K, Tedim J, Rodrigues L M, et al. Novel Inorganic Host Layered Double Hydroxides Intercalated with Guest Organic Inhibitors for Anticorrosion Applications[J]. ACS Applied Materials & Interfaces, 2009, 1(10): 2353-2362.
[15]Parker L M, Milestone N B, Newman R H. The Use of Hydrotalcite as an Anion Absorbent[J]. Industrial and Engineering Chemistry Research, 1995, 34(4): 1196-l202.
[16]宋国君, 孙良栋, 李培耀, 等. 水滑石的合成、改性及其在功能复合材料中的应用[J]. 材料导报, 2008, 22(1): 53-57.
[17]严岩, 刘岗, 刘斌. 水滑石形成机理与形貌控制的研究现状[J]. 绝缘材料, 2006, 39(6): 28-31.
[18]杨飘萍, 宿美平, 杨胥徽, 等. 尿素法合成高结晶度类水滑石[J]. 无机化学学报, 2003, 19(5): 485-489.
[19]曾虹燕, 冯震, 廖凯波, 等. Mg-Al水滑石的制备及其催化合成丙二醇单甲醚的性能[J].石油化工, 2008, 37(8): 788-792.
[20]Williams G, McMurray H N. Inhibition of Filiform Corrosion on Polymer Coated AA2024-T3 by Hydrotalcite-like Pigments Incorporating Organic Anions[J]. Electrochemical and Solid-State Letters 2004, 7(5): B13-B15.
[21]Gao Y F, Nagai M, Masuda Y, et al. Surface Precipitation of Highly Porous Hydrotalcite-like Film on Al From a Zinc Aqueous Solution[J]. Langmuir, 2006, 22(8): 3521-3527.
[22]Chen H Y, Zhang F Z, Fu S S, et al. In Situ Microstructure Control of Oriented Layered Double Hydroxide Monolayer Films with Curved Hexagonal Crystals as Superhydrophobic Materials[J]. Advanced Materials, 2006, 18(23): 3089-3093.
[23]Chen H Y, Zhang F Z, Chen T, et al. Comparison of the Evolution and Growth Processes of Films of M/Al-layered Double Hydroxides with M=Ni or Zn[J]. Chemical Engineering Science, 2009, 64(11): 2617-2622.
[24]Hsieh Z L, Lin M C, Uan J Y. Rapid Direct Growth of Li-Al Layered Double Hydroxide (LDH) Film on Glass, Silicon Wafer and Carbon Cloth and Characterization of LDH Film on Substrates[J]. Journal of Materials Chemistry, 2011, 21(6): 1880-1889.
[25]Liu J P, Li Y Y, Huang X T, et al. Layered Double Hydroxide Nano-and Microstructures Grown Directly on Metal Substrates and Their Calcined Products for Application as Li-ion Battery Electrodes[J]. Advanced Functional Materials, 2008, 18(9): 1448-1458.
[26]Yu B Y, Lin J K, Uan J Y. Applications of Carbonic Acid Solution for Developing Conversion Coating on Mg Alloy[J]. Transactions of Nonferrous Metals Society of China, 2010, 20(7): 1331-1339.
[27]Lin J K, Hsia C L, Uan J Y. Characterization of Mg,Al-hydrotalcite Conversion Film on Mg Alloy and Cl- and CO32- Anion Exchangeability of the Film in a Corrosive Environment[J]. Scripta Materialia, 2007, 56(11): 927-930.
[28]Lin J K, Uan J Y. Formation of Mg,Al-hydrotalcite Conversion Film on Mg Alloy in Aqueous HCO3-/CO32- and Corresponding Protection Against Corrosion by the Coating[J]. Corrosion Science, 2009, 51(5): 1181-1188.
[29]Chen J, Song Y W, Shan D Y, et al. In Situ Growth of Mg-Al Hydrotalcite Conversion Film on AZ31 Magnesium Alloy[J]. Corrosion Science, 2011, 53(10): 3281~3288.
[30]Guo X X, Xu S L, Zhao L L, et al. One-step Hydrothermal Crystallization of a Layered Double Hydroxide/alumina Bilayer Film on Aluminum and its Corrosion Resistance Properties[J]. Langmuir, 2009, 25(17): 9894-9897.
[31]薛红丹, 柏永清, 王甫丽, 等. 水滑石类化合物的结构及其制备方法[J]. 河北建筑工程学院学报, 2012, 30(4): 13-16.
[32]Fetter G, Botello A, Lara V H, et al. Detrital Mg(OH)2 and Al(OH)3 in Microwaved Hydrotalcites[J]. Journal of Porous Materials, 2001, 3(8): 227-232.
[33]刘红, 陆天虹, 李淑萍. 类水滑石化合物制备方法研究综述[J]. 南京师范大学学报:自然科学版, 2009, 32(2): 82-86.
[34]赵丽丽. 类水滑石薄膜的制备及其耐腐蚀性能研究[D]. 北京:北京化工大学, 2008
[35]Zhang F Z, Zhao L L, Chen H Y, et al. Corrosion Resistance of Superhydrophobic Layered Double Hydroxide Films on Aluminum[J]. Angewandte Chemie International Edition, 2008, 47(13): 2466-2469.
[36]Buchheit R G, Guan H. Formation and Characteristics of Al-Zn Hydrotalcite Coatings on Galvanized Steel[J]. JCT Research, 2004, 4(1): 277-290.
[37]Buchheit R G, Mamidipally S B, Schmutz P, et al. Active Corrosion Protection in Ce-modified Hydrotalcite Conversion Coating[J]. Corrosion, 2002, 58(1): 3-14.
[38]Wang J, Li D D, Yu X, et al. Hydrotalcite Conversion Coating on Mg Alloy and Its Corrosion Resistance[J]. Journal of Alloys and Compounds, 2010, 494(1-2): 271-274.
[39]Yi J L, Zhang X M, Chen M A, et al. Effect of Na2CO3on Corrosion Resistance of Cerium Conversion Film on Mg-Gd-Y-Zr Magnesium Alloy Surface[J]. Scripta Materialia, 2008, 59(9): 955-958.
[40]Yu X, Wang J, Zhang M L. Synthesis, Characterization and Anticorrosion Performance of Molybdate Pillared Hydrotalcite/In Situ Created ZnO Composite as Pigment for Mg-Li Alloy Protection[J]. Surface & Coatings Technology, 2008, 203(3-4): 250-255.
[41]于湘, 王君, 陈玉涵, 等. 功能性Zn-Al-[V10O28]6-水滑石在镁合金防腐涂层中的应用[J]. 功能材料, 2008, 39(8): 1370-1372.
[42]于湘, 王君, 黎晖, 等. Zn-Al-[V10O28]6-水滑石在镁合金防腐中的机理研究[J]. 工程材料, 2008(12): 30-33.
[43]Zhang F Z, Sun M, Xu S L, et al. Fabrication of Oriented Layered Double Hydroxide Films by Spin Coating and Their Use in Corrosion Protection[J]. Chemical Engineering Journal, 2008, 141(1/3): 362-367.
[44]Uan J Y, Yu B L, Pan X L. Morphological and Microstructural Characterization of the Aragonitic CaCO3/Mg,Al-hydrotalcite Coating on Mg-9 wt pct Al-1 wt pct Zn Alloy to Protect Against Corrosion[J]. Metallurgical and Materials Transactions A, 2008, 39(13): 3233-3245.
[45]Zhang W, Buchheit R G. Hydrotalcite Coating Formation on Al-Cu-Mg Alloys From Oxidizing Bath Chemistries[J]. Corrosion, 2002, 58(7): 591-600.
[46]Chen J, Song Y W, Shan D Y, et al. Study of the Corrosion Mechanism of the In Situ Grown Mg-Al-CO32- Hydrotalcite Film on AZ31 Alloy[J]. Corrosion Science, 2012, 65: 268-277.
[47]Chen J, Song Y W, Shan D Y, et al. Modifications of the Hydrotalcite Film on AZ31 Mg alloy by Phytic Acid: The Effects on Morphology, Composition and Corrosion Resistance[J]. Corrosion Science, 2013, 74: 130-138.
[48]Ishizaki T, Chiba S, Suzuki H. In Situ Formation of Anticorrosive Mg-Al Layered Double Hydroxide-Containing Magnesium Hydroxide Film on Magnesium Alloy by Steam Coating[J]. ECS Electrochemistry Letters, 2013, 2(5): C15-C17.
[49]Kuzawa K, Jung Y L, Kiso Y, et al. Phosphate Removal and Recovery with a Synthetic Hydrotalcite as an Adsorbent[J]. Chemosphere, 2006, 62(1): 45-52.

