化疗间期联合序贯应用厄洛替尼治疗晚期非小细胞肺癌的疗效观察
罗向晖, 曹燕飞, 陈耀华, 吴 昱, 杨 晔
(陕西省人民医院 胸外科, 陕西 西安, 710068)
肺癌是一种在全球各国人群的发病率和死亡率均较高的恶性肿瘤,近年来,中国肺癌的发病率和死亡率也呈现不断上升,已成为死亡率上升速度最快的恶性肿瘤,肺癌在中国人群导致的死亡病例数位居所有恶性肿瘤的第5位[1]。有研究[2]结果显示,有多种因素与肺癌的发病具有密切关系,主要包括吸烟、被动吸烟、居住地污染、肺癌家族史等,且这些因素之间还存在交互效果,吃水果、锻炼、饮茶则是保护因素。同时,随着中国人口的老龄化趋势日益明显,老年肺癌患者的数量也不断上升,这提高了肺癌的治疗难度,使肺癌患者的死亡率进一步上升[3]。肺癌可分为非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)两类, NSCLC患者约占80%~85%, 而其中有30%~40%的患者在临床确诊时肿瘤已发展到晚期,已丧失了应用手术治疗的机会。目前,临床上针对晚期NSCLC患者的一线标准治疗方案是含铂类的化疗方案,单一的化疗方案仅可使晚期NSCLC患者的死亡风险下降20%~30%。因此,临床工作者近年来正在积极探索包括靶向治疗在内的各类新型治疗方法,并且取得了较大的进展。本研究针对化疗间期联合序贯应用厄洛替尼治疗晚期NSCLC的疗效进行了观察和分析,现将研究的具体情况报告如下。
1 资料与方法
1.1 一般资料
选取2009年10月—2012年12月本院收治的晚期NSCLC患者45例作为研究对象,所有患者均经病理学或细胞学检查证实为进展期或者复发Ⅲb、Ⅳ期NSCLC,患者至少有一个可评价的病灶,血液学和血液生化检查显示患者各重要器官功能未有严重损伤,排除应用过抗表皮生长因子受体药物、出现明显肿瘤脑转移症状、无法耐受本研究治疗方案的患者。在纳入的患者中,有男性患者31例,女性患者14例;患者的中位年龄为57岁;初治患者为29例,复治患者为16例;腺癌患者为37例,非腺癌患者为8例。
1.2 治疗方法
对于初治患者应用吉西他滨联合铂类进行化疗,方案为吉西他滨(给药剂量为1250 mg/m2)静脉注射,第1、8天;顺铂(给药剂量为75 mg/m2)或卡铂(AUC=5)静脉注射,第1天;对于复治患者,应用多西他赛(给药剂量为75 mg/m2)或培美曲塞(给药剂量为500 mg/m2)静脉注射,第1天。所有患者均同时应用厄洛替尼(给药剂量为每日150 mg)口服, 第15~28天。以28 d为一个治疗周期。每治疗两个周期后对患者的疗效进行评价。于序贯治疗6个周期后,对所有患者均给予厄洛替尼维持治疗,化疗过程中给予患者止吐药物及相关对症治疗,如患者出现副反应不可耐受或因病情进展,则结束治疗退出本研究。
1.3 疗效评价和随访期
自开始给予患者序贯治疗起对患者进行随访,直至患者疾病进展或无法耐受化疗副反应而终止治疗,随访期至2013年4月2日,根据世界卫生组织(WHO)制定的实体瘤疗效评价标准对患者进行疗效评价,评价标准为: ① 完全缓解(CR):影像学检查可见病灶完全消失,且持续时间超过1个月; ② 部分缓解(PR): 影像学检查可见肿瘤缩小50%以上,且持续时间超过1个月; ③ 稳定(SD): 影像学检查肿瘤缩小幅度小于50%; ④ 进展(PD):有病灶增大幅度超过25%或有新病灶出现,以疗效为“CR”或“PR”为临床有效,以疗效“CR”、“PR”或“SD”为临床控制。同时,根据美国国家癌症研究所(NCI)制定的毒副反应标准对化疗期间患者出现的毒副反应进行评价。
2 结 果
2.1 不同类型患者近期疗效的比较
经治疗,初治患者和复治患者的临床有效率分别为27.6%和18.8%, 初治患者和复治患者的各项近期疗效结果及临床有效率的差异均无统计学意义(P>0.05), 而初治患者的临床控制率显著高于复治患者(P<0.05), 具体结果见表1。
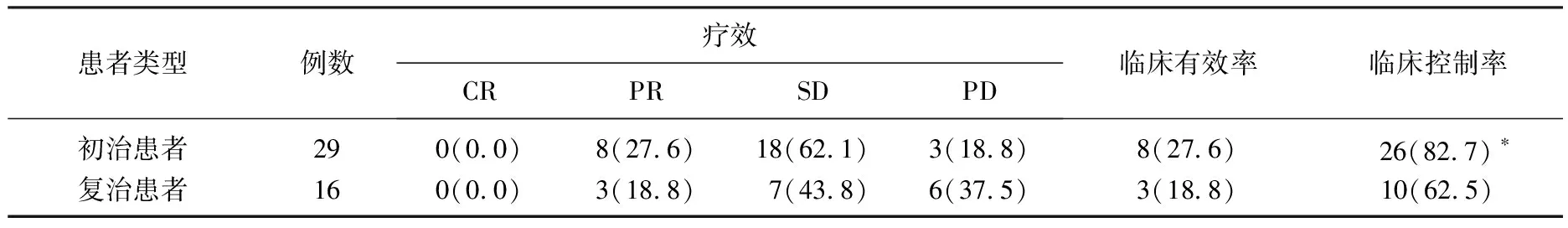
表1 初治和复治患者近期疗效的比较[n(%)]
2.2 患者的近期疗效与临床因素的关系
年龄≥65岁的初治患者的临床有效率显著高于年龄<65的初治患者(P<0.05),具有吸烟史患者的临床有效率显著低于无吸烟史的患者(P<0.05), 病理类型为腺癌的复治患者的临床有效率显著高于病理类型为非腺癌的复治患者(P<0.05), Ⅲb期的初治患者的临床有效率显著高于Ⅳ期的初治患者(P<0.05), 其他因素比较时差异均无统计学意义(P>0.05)。具体结果见表2。
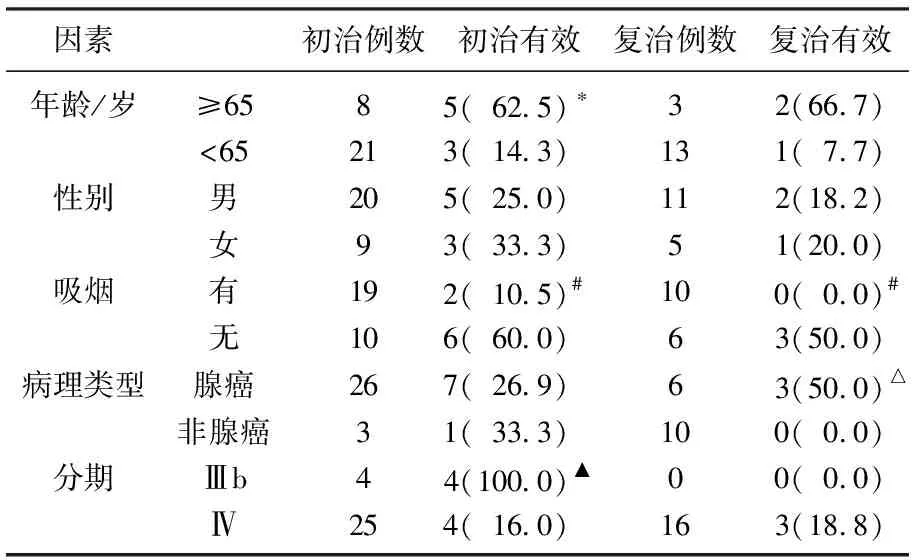
表2 患者的近期疗效评价结果[n(%)]
2.3 患者在化疗期间的副反应情况
患者在化疗期间的主要副反应为皮疹、恶心、腹泻、呕吐、食欲减退等,血液毒性主要为中性粒细胞和血小板计数水平的下降,初治患者与复治患者的各项副反应的差异无统计学意义(P>0.05), 具体结果见表3。
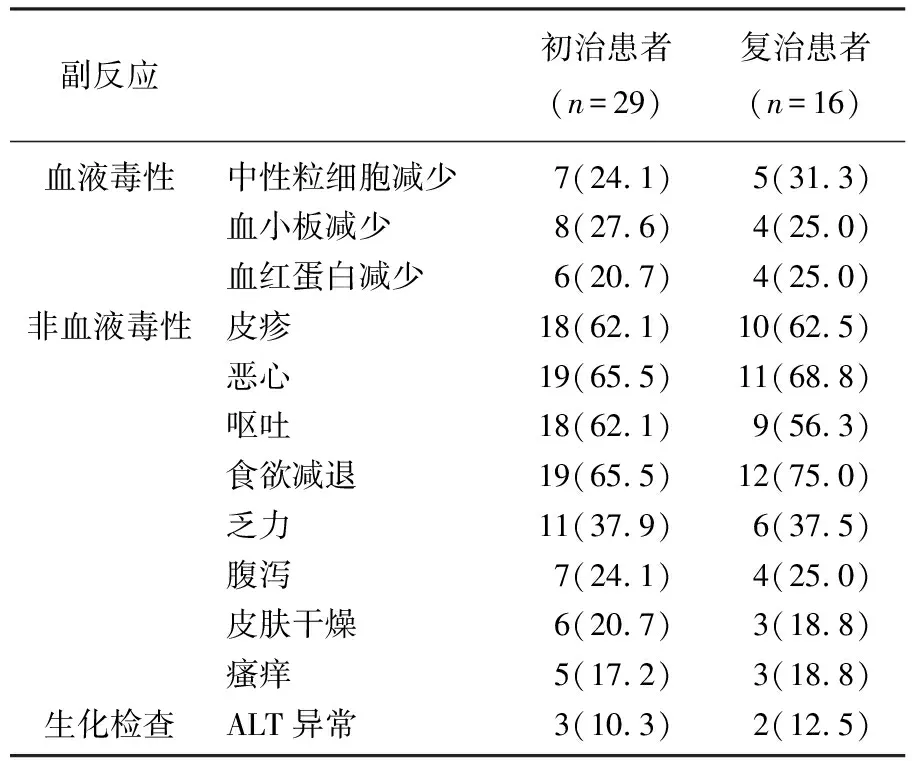
表3 患者在化疗期间的副反应情况[n(%)]
3 讨 论
根据Meta分析研究结果,吸烟、来源于配偶或同事的女性被动吸烟、慢性支气管和慢性肺部疾病、肿瘤或肺癌家族史等都是与肺癌发病相关的危险因素,其中,吸烟的危险度最高,其次为被动吸烟、肺气肿和肿瘤家族史等,这一研究结果也提示了肺癌发病与环境因素和遗传因素都具有密切的关系[4]。由于肺癌的病情复杂且易发生早期转移,其治疗的问题一直是困扰临床医生的棘手问题,临床工作者也在这一方面进行了积极的探索。SCLC的恶性度很高,不仅肿瘤生长迅速,而且侵袭性高、早期转移较常见。多数患者在确诊时已不具备手术指征,因此,临床上针对SCLC的主要治疗方法是化疗和放疗。而且, SCLC患者在接受一线治疗后发生复发或转移的比例较高,二线治疗药物又较少,因此,SCLC治疗是临床的难点问题[5]。与SCLC相比,NSCLC的恶性度相对较低,近年来,除了手术治疗之外,针对NSCLC的新型化疗方法和分子靶向治疗方法也取得了长足的进步,从而使NSCLC的治疗效果得到了提高,但患者的预后情况仍然未能达到预期的水平。以多学科联合、个性化的治疗方案提高患者的预后水平已成为NSCLC治疗的发展方向[6];由于两药含铂的NSCLC一线标准方案的有效率一般仅为30%左右,患者的中位生存时间一般只有8~11个月,因此,提高一线治疗的有效率并减少化疗不良反应是肿瘤内科治疗的重要课题。近年来,分子生物学技术被越来越多引入肿瘤治疗领域,这也催生了多种针对肿瘤的靶向治疗方法,其中,吉非替尼和厄洛替尼已经成为目前针对肿瘤的二线治疗标准药物,它们都属于表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),大量的临床研究已证实了该类药物的显著疗效,在应用多西他赛之后序贯应用厄洛替尼的治疗方案可使其M期阻滞作用和诱导凋亡作用得到增强,这也间接证实了靶向治疗与化疗方案的有效序贯应用可发挥协同增效的作用[7]。但国内外大多数临床研究表明,在化疗同期联合应用EGFR-TKI类药物并不能提高患者的生存期。有体外研究结果显示,在NSCLC细胞株中,当顺铂的浓度超过3 μmol/L时,如果同时应用EGFR-TKI类药物,该类药物可通过剂量依赖性模式对顺铂进入肿瘤细胞的过程产生干扰,从而降低铂类化疗药物的疗效,而在应用顺铂24 h后,这种干扰作用便可得到消除[8]。这一机制的发现也促使研究者将研究重点从联合化疗方案转向序贯使用化疗药物和靶向药物的治疗方案。国外研究者在亚洲进行的Ⅲ期多中心双盲随机试验证实,应用GC方案联合序贯厄洛替尼进行治疗,可大幅度延长了患者的生存期,降低肿瘤进展的风险,提高治疗的有效率[9]。同期的其他研究[10-11]也证实了吉非替尼和厄洛替尼作为二线治疗药物的显著疗效,但这些研究也体现出了二线治疗的有效率已经达到了的瓶颈,很难再取得进一步的提高。本研究结果显示,初治患者和复治患者的临床有效率分别为27.6%和18.8%, 初治患者和复治患者的各项近期疗效结果及临床有效率的差异均无统计学意义(P>0.05), 而初治患者的临床控制率显著高于复治患者(P<0.05), 说明化疗间期联合序贯应用厄洛替尼治疗晚期NSCLC的近期临床有效率并不高,而对于初治患者病情进展的控制效果较显著。具有吸烟史患者的临床有效率显著低于无吸烟史的患者(P<0.05), 年龄≥65岁的初治患者的临床有效率显著高于年龄<65的初治患者(P<0.05), Ⅲb期的初治患者的临床有效率显著高于Ⅳ期的初治患者(P<0.05), 病理类型为腺癌的复治患者的临床有效率显著高于病理类型为非腺癌的复治患者(P<0.05), 说明吸烟史、年龄、肿瘤分期、病理类型等因素都可能对化疗间期联合序贯应用厄洛替尼治疗晚期NSCLC的疗效造成影响。患者在化疗期间的主要副反应为皮疹、恶心、腹泻、呕吐、食欲减退等,而血液毒性副反应的发生率均在20%~30%, 说明化疗间期联合序贯应用厄洛替尼治疗晚期NSCLC的毒副反应多数为非血液毒性副反应,患者的可耐受度较高。
[1] 邹小农. 中国肺癌流行病学[J]. 中华肿瘤防治杂志, 2007, 14(12): 881.
[2] 黄萌, 陈星, 邱月锋, 等. 肺癌危险因素及交互作用研究[J]. 中华疾病控制杂志, 2011, 15(2): 91.
[3] 张明云, 张菁华, 李兴德, 等. 老年肺癌流行病学及临床治疗现状[J]. 现代肿瘤医学, 2012, 18(12): 2505.
[4] 王冬梅, 陈勃江, 李为民, 等. 肺癌危险因素的Meta分析[J].中国循证医学杂志, 2010, 10(12): 1446.
[5] 王欢, 胡毅. 小细胞肺癌治疗进展[J]. 军医进修学院学报, 2012, 33(4):422.
[6] 范江, 姜格宁. 非小细胞肺癌治疗进展[J]. 中华临床医师杂志(电子版), 2008, 2(1): 19.
[7] 宋正波, 陆舜, 虞永峰, 等. 化疗间期序贯应用厄洛替尼治疗晚期非小细胞肺癌的临床观察[J]. 临床肿瘤学杂志, 2010, 15(1): 48.
[8] Chen T, Chang K, Csiao S H, et al. Combination effects of gefitinib plus cisplatin in non-small cell lung cancer (NSCLC): Why have phase Ⅲ trials failed[J]. J Clin Oncol, 2009, 27,(s5): a11022.
[9] Lee J S, Ignacio J, Yu C, et al. FAST-ACT: A phase Ⅱ randomized double-blind trial of sequential erlotinib and chemotherapy as first-line treatment in patients (pts) with stage ⅢB/Ⅳ non small cell lung cancer (NSCLC)[J]. J Clin Oncol, 2008, 26,(s1): a8031.
[10] Douillard J Y, Kim E, Hirsh V, et al. Gefitinib docetaxel in patients with locally advanced or metastasis non-small cell lung cancer pre-treated with platinum-based chemotherapy; a randomized, open-label phase Ⅲ study (INTEREST)[J]. J Thrac Oncol, 2007, 2(S4): 305.
[11] Groen H, Arrieta O G, Riska H, et al. The global TRUST study of erlotinib in advanced non-small-cell lung cancer(NSCLC)[J]. J Clin Oncol, 2008, 26,(s1): a19000.

